2023-07-03 理化学研究所
理化学研究所(理研)生命医科学研究センター 免疫細胞治療研究チームの清水 佳奈子 上級研究員、藤井 眞一郎 チームリーダーらの研究チームは、白血病マウスモデルに対する「人工アジュバントベクター細胞(aAVC)[1]」ワクチンとサイトカイン[2]の併用療法の開発に成功しました。
本研究成果は、進行期がん患者に対する免疫療法の効果を増大させ、生存率の上昇に貢献すると期待できます。
研究チームは、がんや感染症に対する免疫療法としてaAVCワクチンを独自に開発し、最近、再発・治療抵抗性の急性骨髄性白血病[3]患者に対して、医師主導治験第一相試験[4]を行いました。治験では、自然免疫[5]と獲得免疫[5]の両方の誘導とともに、腫瘍量の減少という臨床効果が得られましたが、完全な治癒には至りませんでした。
今回、研究チームはインターロイキン-2(IL-2)[2]というサイトカインに着目しました。進行期白血病マウスモデルに対して、aAVC投与による免疫誘導後にCD122指向型IL-2複合体(S4B6)[6]を投与したところ、100%のマウスが6カ月間以上も生存するという著しい抗腫瘍効果の誘導に成功しました。この併用療法では、自然免疫と獲得免疫の免疫細胞群を最大限に増強し長期に維持することができます。特に、ナチュラルキラー(NK)細胞[7]とCD8陽性T細胞[8]では、”若返り分子”ともいえる幹細胞様表現型[9]が増加していました。
本研究は、科学雑誌『Journal for ImmunoTherapy of Cancer』オンライン版(7月3日付:日本時間7月3日)に掲載されました。
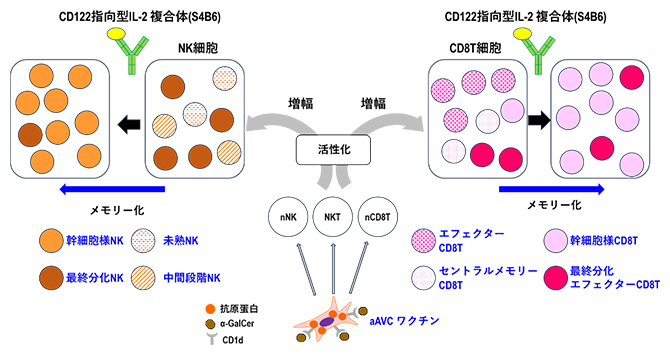
aAVCとCD122指向型IL-2複合体の併用による免疫効果の模式図
背景
研究チームは、がんや感染症に対して自然免疫と獲得免疫を賦活化する「人工アジュバントベクター細胞(aAVC:エーベック)ワクチン」を独自に開発し、研究を進めています。
最近、再発性・治療抵抗性(進行期)の急性骨髄性白血病の患者に対して、WT1[10]抗原発現aAVC(aAVC-WT1)(図1)を投与し治療する、医師主導治験第一相試験を行いました。この治験は、「First in human」と呼ばれる世界で初めてヒトを対象とするものです。治験では、自然免疫と獲得免疫の両方を誘導できること、キラーT細胞[8]を長期に誘導できる記憶免疫[11]効果、および白血病細胞の低下を指標とする有効な臨床効果が得られました注1)。一方で、完全な治癒には至らなかったことから、抗腫瘍効果をより長期間持続させる方法を開発する必要があります。
進行期のがん患者では、化学療法などの治療や病態により、免疫細胞、特にリンパ球の数や増幅能が低下しています。さらに、一般に進行期がんでは免疫にブレーキをかける制御性T細胞[12](Treg)が増殖するため、免疫を賦活化するには免疫環境を変える必要があります。そこで、より効果的な治療戦略のためのリバーストランスレーショナル研究[13]として、aAVCワクチンと、がんに免疫応答するエフェクター細胞[14]をさらに増幅し得るサイトカインの併用療法を検討しました。
研究チームは、インターロイキン-2(IL-2)というサイトカインに着目しました。IL-2は1980年代からナチュラルキラー(NK)細胞やT細胞[8]を増幅させる目的でがん免疫療法に使用され、1992年に米国食品医薬品局(FDA)で転移性腎がん、1998年には転移性悪性黒色腫の治療に認可されました。しかし、IL-2は体内では半減期が15分以下と短く、また血管内皮細胞がIL-2受容体(CD25)を発現するため、毛細管漏出症候群[15]を引き起こすなどの副作用の問題があります。また、CD25を発現する制御性T細胞も増幅してしまうため使用が難しいことから、現在IL-2による新しい治療法の研究・開発が行われています。
IL-2受容体(IL-2R)には、CD25(IL-2Rα)、CD122(IL-2Rβ)、CD132(IL-2Rγ)の三つのサブユニットがあり、これらがヘテロ二量体や三量体の状態で存在しています。これらのサブユニットは、エフェクター細胞の種類や活性化状態により細胞表面での発現パターンが異なることが知られています。そこで本研究では、IL-2受容体への感受性の異なる2種類のIL-2と抗IL-2抗体の複合体(IL-2Cx)を用いて、治療効果を調べました。
注1)2022年9月24日プレスリリース「人工アジュバントベクター細胞投与による免疫の活性化」
研究手法と成果
研究チームは、治験においてaAVC単独投与では治療の難しかった高腫瘍量群に対する治療効果を引き上げるため、aAVCにCD122指向型IL-2Cx(S4B6)およびCD25指向型IL-2Cx(JES6)[6]をそれぞれ併用し、比較検討しました。CD122指向型IL-2Cx(S4B6)は通常、CD122を高発現するNK細胞や記憶免疫CD8陽性T細胞に作用しやすく、CD25指向型IL-2Cx(JES6)はCD25を高発現する制御性T細胞に作用しやすいという特徴があります。
まず、マウスに通常量のWT1発現白血病細胞(C1498-WT1)を投与し、WT1発現aAVC(aAVC-WT1)で治療すると、80%のマウスが生き残りました(図1B)。その生き残ったマウスに3~6カ月後、C1498-WT1を再度投与したところ、全てのマウスに抗WT1特異的な記憶免疫T細胞が誘導され、がん細胞を拒絶できることが分かりました。
次に、マウスに通常の5倍量のC1498-WT1を投与し、aAVC-WT1で治療したところ、その効果が腫瘍接種から40日後には約50%に、60日後には約20%まで低下することを確認しました(図1C)。そこで、この高腫瘍量マウスにaAVC-WT1での治療後7日目から、2種類のIL-2Cxのうち1種類を7日間投与しました(図1C)。すると、IL-2Cx(JES6)併用群では60%以上のマウスが腫瘍接種から80日以降まで生存し、IL-2Cx(S4B6)併用群では100%のマウスが180日以上生存しました。つまり、この併用療法で高腫瘍量マウスの免疫を賦活化でき、特にIL-2Cx(S4B6)併用群で効果が高いことが分かりました。一方、aAVC-WT1を用いないIL-2Cx(S4B6)単独投与群では、生存率は未治療群と変わりませんでした。
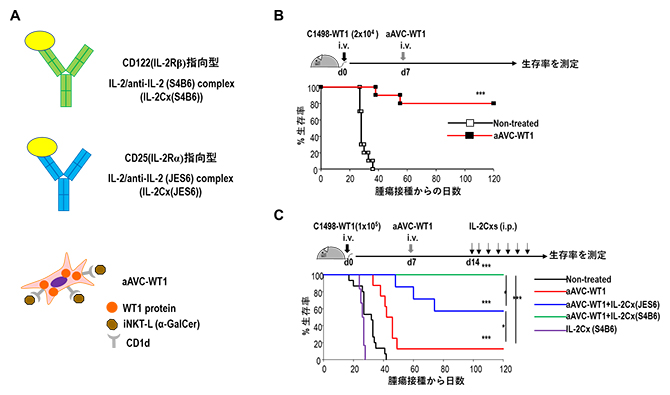
図1 進行白血病モデルマウスに対するaAVCとIL-2Cxの併用投与による生存率
A.上から、CD122指向型IL-2Cx(S4B6)、CD25指向型IL-2Cx(JES6)、aAVC-WT1を示す。aAVCは細胞表面上にCD1d/a-GalCer複合体を発現し、細胞内にWT1抗原を発現している。
B.B6マウスに2万細胞のB6マウス由来の白血病細胞株(C1498)にWT1を発現させたC1498-WT1を静脈内投与し、その7日後にaAVC-WT1で治療した。80%のマウスが腫瘍接種から120日後も生存した。
C.B6マウスに10万細胞C1498-WT1を投与、7日後にaAVC-WT1で治療し、その7日後に2種類のIL-2Cxのうち1種類をそれぞれ投与した。IL-2Cx(JES6)併用群(青線)では60%以上のマウスが腫瘍接種から80日以降まで生存し、IL-2Cx(S4B6)併用群(緑線)では100%のマウスが120日以上(実際には180日以上)生存した。aAVC-WT1を用いないIL-2Cx(S4B6)単独投与群(紫線)では治療効果は見られなかった。
この抗腫瘍効果のメカニズムを明らかにするために、aAVC-WT1の代わりにOVA[10]抗原を発現したaAVC-OVAでの治療後にIL-2Cxを投与した白血病マウスモデルの免疫細胞の数を解析しました。その結果、自然免疫をつかさどるナチュラルキラーT(NKT)細胞[7]については、aAVC-OVA単独投与群に比べて、IL-2Cx(S4B6)併用群、IL-2Cx(JES6)併用群ともに、抗腫瘍効果を発揮するインターフェロンガンマ(IFN-γ)[16]産生性のNKT細胞が増加していました。NK細胞については、IL-2Cx(S4B6)併用群で有意に増加し、特に分化の中間段階にあるNK細胞(増殖能と細胞傷害活性を持つ)が著しく多く見られました。一方、獲得免疫をつかさどるCD8陽性T細胞についても、IL-2Cx(S4B6)併用群で著しく増加しました。これらの結果は、IL-2Cx(S4B6)併用群では、がん細胞を攻撃できるエフェクター細胞(NK細胞、NKT細胞、CD8陽性T細胞)が有意に増幅され、強力な抗腫瘍効果を誘導できることを示しています。
aAVCを投与すると、活性化した各々のエフェクター細胞のIL-2受容体は投与前には発現していなかったCD25やCD122を発現するというように発現パターンが変化します。このIL-2受容体の発現パターンの経時的な変化とエフェクター細胞数の増加には整合性が見られました。
さらに、エフェクター細胞の質について解析しました。aAVC-OVA単独投与群やIL-2Cx(JES6)併用群では、抗原刺激を受け活性化し、細胞傷害活性を持ったエフェクターCD8陽性T細胞(CD44highCD62L-)が優位に誘導されました。これに対して、IL-2Cx(S4B6)併用群では、主として記憶免疫T細胞の一種で、自己複製能力の高いセントラルメモリーCD8陽性T細胞(CD44highCD62L+)に近いタイプが誘導されたことが分かりました(図2A上段)。他の表現型をみると、IL-2Cx(S4B6)併用群では、「幹細胞様記憶免疫CD8陽性T細胞[17]」(KLRG1-CD127+CXCR3+CD27+Sca-1+)という長期間持続的に機能するエフェクター細胞に分化できる細胞群が誘導されたことが分かりました(図2A下段)。
IL-2Cx(S4B6)併用群の幹細胞様記憶免疫CD8陽性T細胞に関与する転写因子[18]を調べたところ、転写因子TCF1が強く発現しており、幹細胞様記憶免疫CD8陽性T細胞の誘導にTCF1が関わっていることが分かりました(図2B)。実際、抗原特異的CD8陽性T細胞を解析すると、IL-2Cx(JES6)併用群は短期間ではaAVC-OVA単独投与群に比べて3倍以上のT細胞応答が起こりましたが、約60日間経過するとaAVC-OVA単独投与群と同じくらいまで低下しました。一方、IL-2Cx(S4B6)併用群は短期間でaAVC-OVA単独投与群の約8倍のT細胞応答が起こり、さらに160日を経過しても2倍以上の記憶免疫CD8陽性T細胞が持続することが分かりました(図2C)。
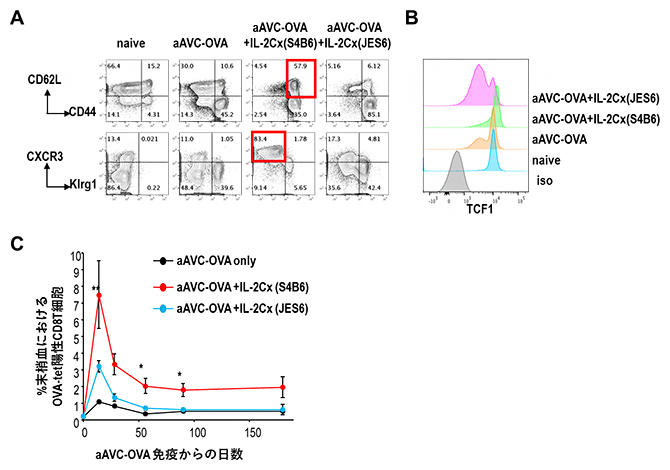
図2 各マウス治療群におけるエフェクター細胞の質の解析結果
A.aAVC-WT1の代わりにOVA抗原を発現したaAVC-OVA単独投与群とIL-2Cxの併用群において、各治療群での脾臓のCD8陽性T細胞の表現型をフローサイトメトリーにより測定した。上段はCD44およびCD62L、下段はKlrg1およびCXCR3の発現を表す。赤枠で示すようにIL-2Cx(S4B6)併用群では、自己複製能力が高く、長期間にわたって持続的に、エフェクターCD8T細胞を供給できる幹細胞様記憶免疫CD8T陽性細胞が誘導された。
B.各治療群での脾臓のCD8陽性T細胞の転写因子TCF1の発現を示す。IL-2Cx(S4B6)併用群でTCF1の発現が著しかった。
C.OVA特異的CD8陽性T細胞(テトラマー陽性細胞)の末梢血における細胞頻度を経時的に測定した。IL-2Cx(JES6)併用群(水色線)は短期間でaAVC-OVA単独投与群(黒線)の3倍以上の細胞頻度を示したが、60日間くらい経過するとaAVC-OVA単独投与群とほぼ変わらなくなった。IL-2Cx(S4B6)併用群(赤線)は短期間でaAVC-OVA単独投与群の約8倍の細胞頻度を示し、160日を経過しても2倍以上の記憶免疫が持続した。
一方で、抑制性の制御性T細胞への影響も明らかになりました。制御性T細胞はCD25を高発現し、IL-2によって増幅されます。また、がん細胞が増加する際には制御性T細胞も増加することが知られています。エフェクター細胞であるCD8陽性T細胞と制御性T細胞の比(CD8/Treg比)は、予後のマーカーとなることも報告されています。CD8/Treg比は、aAVC単独投与だけでも上昇しますが、IL-2Cx(S4B6)併用群では著しく上昇すること、IL-2Cx(JES6)併用群では逆に低下することが判明しました。
さらに、白血病の腫瘍部位である骨髄を詳しく解析しました。すると、白血病細胞(C1498-WT1)投与後21日目において、IL-2Cx(S4B6)併用群では、NK細胞とCD8陽性T細胞において他の群とは異なる発現パターンを示す集団が増加しました(図3A)。いずれも幹細胞様マーカー(Klrg1-CD62L+TCF1+)を呈する集団であり、最終的に主成分分析(PCA)[19]により、このような記憶免疫NK細胞と記憶免疫CD8陽性T細胞は、表現型の発現パターンが非常に類似していることが検証されました(図3B)。
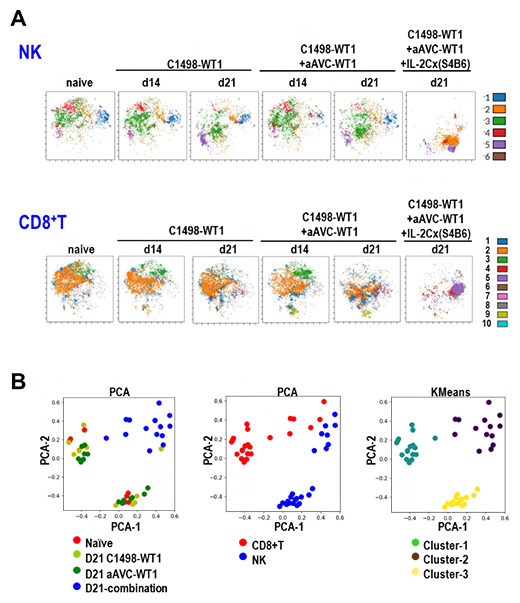
図3 aAVC-W1単独とIL-2Cx(S4B6)併用よる骨髄内NK細胞、CD8陽性T細胞への影響
A.NK細胞(上段)およびCD8陽性T細胞(下段)のt-SNE解析の結果。白血病細胞投与後21日目のIL-2Cx(S4B6)併用群(右端)では、NK細胞とCD8陽性T細胞、いずれも他の群とは異なる細胞集団が増加したことが分かる。
B.NK細胞およびCD8陽性T細胞の主成分分析(PCA)およびK-Means法[20]を用いたクラスタリング。色付きのドットは各々のサンプルを示し、三つの図で同じ場所にあるドットは同じサンプルである。似たような表現型の発現パターン示すサンプルは近接して分布している。左図は4種類の実験群のサンプルが示され、そのうちIL-2Cx(S4B6)併用群のサンプルは右上に青のドットで示されている。中図は、左図のサンプルの細胞の種類を示しており、CD8陽性T細胞(赤)とNK細胞(青)である。他の実験群のCD8陽性T細胞とNK細胞は離れて分布しているのに対し、IL-2Cx(S4B6)併用群では近接して分布している。それが主観的でないことを確認するために、K-Means法という統計手法を用いて、これらを三つの集団(クラスター)に分けたのが右図である。IL-2Cx(S4B6)併用群のCD8陽性T細胞とNK細胞は、同じ集団(クラスター2)に入ることが示された。これは、IL-2Cx(S4B6)併用群ではCD8陽性T細胞とNKが非常に類似していることを示している。
以上の結果から、aAVCとIL-2Cxの併用療法では、aAVCで誘導されたエフェクター細胞を若返らせ、その数を増幅させることで強力な抗腫瘍効果をもたらしたと考えられます。特にaAVCとIL-2Cx(S4B6)の併用療法において、著しい効果が見られました。
今後の期待
本研究では、aAVCとIL-2Cxを併用することにより、体内において長命かつ持続的にエフェクター細胞を供給できる幹細胞様の記憶免疫NK細胞および記憶免疫CD8陽性T細胞の増幅、つまり自然免疫と獲得免疫の増強・長期維持に成功しました。この併用療法は、腫瘍免疫環境において制御性T細胞の数を制限することも分かりました。
このような抑制性免疫の改善と免疫賦活作用を同時に誘導することで免疫環境を変化させ、腫瘍量の多い白血病マウスモデルにおいても効果があることを示したことは、今後、分子標的療法や抗がん剤に対して抵抗性になった症例において、有効な手立てになると期待できます。
補足説明
1.人工アジュバントベクター細胞(aAVC)
がんの免疫療法で研究が進められている人工細胞。aAVCはエーベックと読む。他家細胞(マウス用にはNIH3T3細胞、ヒト用にはHEK293細胞)に、CD1d分子のmRNAと標的がん抗原分子のmRNAを遺伝子導入させ、CD1d上にアルファガラクシトシルセラミド(α-GalCer)を発現させた細胞。アジュバントとは免疫反応を増幅させること、ベクターは運び屋という意味である。aAVCは、artificial adjuvant vector cellsの略。
2.サイトカイン、インターロイキン-2(IL-2)
サイトカインは、細胞間相互作用を担うタンパク質性因子のこと。IL-2は、標的細胞によって免疫賦活活性と免疫抑制活性を発揮する多面的なサイトカインである。IL-2には、IL-2Rα(CD25)、IL-2Rβ(CD122)、common γ(CD132)の三つの受容体と、IL-2RαβγcとIL-2Rβγcの2種類のヘテロ三量体、二量体が存在する。高親和性ヘテロ三量体であるIL-2Rαβγcは、制御性T細胞に主に発現し、エフェクターT細胞では一過性に発現する。一方、中間親和性ヘテロ二量体であるIL-2Rβγは記憶免疫CD4陽性T細胞およびCD8陽性T細胞、NK細胞に発現している。
3.急性骨髄性白血病
骨髄の中の未熟な細胞(幼若骨髄系細胞)ががん化し、増殖し、骨髄を占拠することにより、正常な血液細胞が作られなくなり、貧血症状、出血、感染による症状が現れる疾患。通常は化学療法や移植治療が行われる。
4.医師主導治験第一相試験
医師主導治験とは、医師自らが治験を企画・立案し、治験届を提出し治験を実施するもの。臨床試験のうち第一相試験の目的は、主に治験薬の安全性および薬物の体内動態、薬剤の最大用量を確認することである。
5.自然免疫、獲得免疫
自然免疫は先天的な免疫システムで、さまざまな種類の抗原を対象に初期防衛を担う。獲得免疫は、抗体や多様な細胞性免疫応答によって特定の異物を認識し排除する免疫システムである。
6.CD122指向型IL-2複合体(S4B6)、CD25指向型IL-2Cx(JES6)
組換えIL-2タンパク質はそのままでは体内での半減期が短いが、抗IL-2抗体と複合体(Cx)の形にすると半減期が延長される。また、抗IL-2抗体の種類によりIL-2受容体への選択性も生じる。抗IL-2(S4B6)抗体は、IL-2/IL-2Rα(CD25)の相互作用を立体的に阻害し、IL-2/IL-2Rβ(CD122)の相互作用を増強する。そのため、CD122陽性の細胞に作用する。一方、抗IL-2(JES6)抗体は、IL-2/IL-2Rβ(CD122)の相互作用を阻害する。CD25が高発現している場合にのみ、IL-2複合体(JES6)とCD25が結合できる。その後JES6はIL-2から解離し、CD25に結合したIL-2が解放され、CD122/CD132をリクルートし、機能的なシグナル伝達複合体を形成する。つまりCD25高発現細胞に作用する。
7.ナチュラルキラー(NK)細胞、ナチュラルキラーT(NKT)細胞
両者とも自然免疫リンパ球の一種である。NK細胞は、ウイルスによる感染やがん細胞に対する初期防御機構としての働きを担っているリンパ球の一種。NKT細胞は、NK細胞のマーカーと1種類のT細胞受容体を発現していて、アレルギー疾患、がん、自己免疫疾患を制御する機能を持つ中核的な免疫調節細胞である。
8.CD8陽性T細胞、キラーT細胞、T細胞
T細胞は胸腺という組織で分化、成熟したリンパ球の一種。獲得免疫をつかさどり、抗原提示細胞から抗原情報を受け取ることで、さまざまな機能を発揮する。T細胞の中でCD8陽性T細胞は、細胞表面にCD8と呼ばれる特徴的なタンパク質を発現するもので、活性化するとキラーT細胞に分化し、ウイルス感染細胞やがん細胞を殺傷する役割を果たす。
9.表現型
ある生物の持つ遺伝子型が形質として表現されたもの。その生物の形態、構造、行動、生理的性質などを含む。
10.WT1、OVA
WT1はさまざまな増殖関連遺伝子の転写を調節しており、急性骨髄性白血病をはじめ、さまざまな腫瘍の細胞に発現している。OVA(Ovalbumin)は卵白アルブミンで、マウスでの抗原特異的免疫応答をモニタリングする際にモデル抗原としてよく用いられる。
11.記憶免疫
免疫反応で、特定の抗原に対する抗体の構造が保持されており、2回目の抗原の進入に対して強い免疫応答を起こすことができる。
12.制御性T細胞
免疫応答を抑制するT細胞。転写因子FoxP3を発現し、リンパ節を含むリンパ組織と、皮膚や腸管などの末梢組織にも存在し、膠原病などの免疫病の発症を阻止する。体が正常な状態のときも、自分の組織に対する免疫応答を抑え、免疫恒常性を維持する役割を果たす。
13.リバーストランスレーショナル研究
基礎研究で得られた発見を診断や治療に結びつける研究をトランスレーショナル研究と呼ぶ。トランスレーショナル研究から明らかとなった課題や疑問点を基礎研究にフィードバックする研究がリバーストランスレーショナル研究である。
14.エフェクター細胞
活性化刺激を受け、特定のエフェクター機能を獲得した細胞。例えば、がん細胞やウイルス感染細胞に対して細胞傷害活性を示すエフェクターCD8陽性T細胞、また特定のサイトカインを産生するエフェクターCD4陽性T細胞(Th1、Th2、Th9、Th17など)などを指す。
15.毛細管漏出症候群
毛細血管の透過性亢進により血漿タンパク質と水分が血管外に漏出し、血液濃縮と血液量減少性ショックを来す疾患。
16.インターフェロンガンマ(IFN-γ)
抗原刺激や微生物感染に反応してT細胞やNK細胞、NKT細胞などから分泌されるサイトカインの一種。抗腫瘍作用、抗ウイルス能増強、他の免疫細胞の活性化などさまざまな機能がある。
17.幹細胞様記憶免疫CD8陽性T細胞
記憶免疫T細胞には、分化段階の異なる複数の種類が存在する。中でも、幹細胞様記憶免疫T細胞は、最も未感作T細胞に近く、最も長命であり、免疫記憶を保持すると考えられている。幹細胞様記憶免疫CD8陽性T細胞は、(1)自己複製能力が高く、長寿である、(2)他の記憶免疫T細胞やエフェクターT細胞を生み出すことができる、(3)抗原に再曝露されたときには素早く活性化して免疫応答を引き起こす、などの性質がある。
18.転写因子
遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子の発現を制御する領域(エンハンサー、プロモーター、サイレンサーなど)に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。
19.主成分分析(PCA)
多変量データの次元を削減し、特徴的に変動している因子を発見する統計手法。相関のある多数の変数からなるデータを、互いに相関のない少数の変数によって説明する。PCAはPrincipal Component Analysisの略。
20.K-Means法
互いに近いデータ同士は同じクラスタであるという考えに基づいたデータ群をk個に分類するクラスタリングの手法。
研究チーム
理化学研究所 生命医科学研究センター 免疫細胞治療研究チーム
上級研究員 清水 佳奈子(シミズ・カナコ)
研究員 植田 翔悟(ウエダ・ショウゴ)
客員主管研究員 中林 潤(ナカバヤシ・ジュン)
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(科技ハブ産連本部 創薬・医療基盤プログラム 副プログラムデイレクター)
原論文情報
Kanako Shimizu, Shogo Ueda, Masami Kawamura, Honoka Aoshima, Mikiko Satoh, Jun Nakabayashi and Shin-ichiro Fujii, “Combination of cancer vaccine with CD122-biased IL-2/anti-IL-2 Ab complex shapes the stem-like effector NK and CD8+ T cells against tumor”, Journal for ImmunoTherapy of Cancer, 10.1136/jitc-2022-006409
発表者
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
上級研究員 清水 佳奈子(シミズ・カナコ)
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
報道担当
理化学研究所 広報室 報道担当