2023-08-22 日本原子力研究開発機構,J-PARCセンター,総合科学研究機構,広島大学
【発表のポイント】
- 食品、医薬品、生体組織などを凍結保存する際には、糖などの凍結保護剤を添加することで氷結晶の成長を抑制し、細胞や細胞小器官などの損傷を防いでいます。
- しかし、従来の光学顕微鏡法では数十マイクロメートルにまで成長した氷結晶しか観測できないため、分子計算で提唱されている分子レベルの成長抑制メカニズムを議論できませんでした。
- そこで我々は、技術開発を進めてきた「スピンコントラスト変調中性子小角散乱法」を用いて、毒性の低い凍結保護剤として注目される糖の凍結溶液中で、核生成したばかりのナノスケールの氷結晶を観察しました。
- 解析の結果、高濃厚のグルコースを添加した溶液では、厚さが氷結晶の最小生成サイズとおなじ数ナノメートルしかないプレート状の氷結晶が生成することを見出しました。
- このような形状は、糖が水分子を水和することで氷結晶の成長を抑制するという従来のモデルでは説明できません。糖分子が氷結晶の特定の面に強く吸着するなど、別の結晶成長抑制メカニズムを兼ね備えている可能性を示しています。
- 今回の研究結果は、凍結保存技術の開発のみならず、極地環境に住む生物の糖の分泌による生命維持機能の解明など、今後幅広い研究に貢献できることが期待されます。
水素原子核のスピンを入射中性子のスピン方向に対し平行・反平行に整列(偏極)させて測定した複数の中性子小角散乱曲線を解析した結果、グルコース溶液を急速凍結した際に生成した氷結晶は厚さ2-3 nmのナノプレートを形成することが判明した。
【概要】
国立研究開発法人日本原子力研究開発機構(理事長 小口正範 以下、原子力機構という)物質科学研究センター・J-PARCセンターの熊田高之研究主幹、中川洋研究主幹、関根由莉奈研究副主幹らは、総合科学研究機構の大石一城次長ら、広島大学川井清司大学院統合生命科学研究科教授とともに、スピンコントラスト変調中性子小角散乱法を用いてグルコース水溶液中に生成した直後の氷結晶の特異な形状を観測することに初めて成功しました。
コップの水を0℃以下に冷やすと氷が出来ます。しかし、0℃をまたいだ途端にコップの水全体が氷になるわけではありません。水の中に生成したナノサイズの氷結晶の核は周囲の水分子を取込みながら大きな塊へと成長します。水を多く含む食品、医薬品、生体組織を凍らせて保存する場合、この氷結晶の成長により細胞膜や細胞小器官などが破壊されてしまうことが問題になります。そこで、凍結保護剤を添加して氷結晶の成長を阻害する手法の開発が進められています1,2。なかでも、糖は毒性の低い凍結保護剤として注目されています。
そこで我々は、これまで開発を進めてきた「スピンコントラスト変調中性子小角散乱法」を用いて、構造科学の観点から糖による氷結晶成長の阻害メカニズムを解明できないかと考えました。中性子小角散乱法は、散乱角の小さな中性子散乱成分を解析することで散乱体のナノ構造を解析する手法です。しかしながら、従来の小角散乱法では氷結晶の散乱が他成分の散乱に隠れてしまい、氷結晶の構造情報を抽出することができませんでした。これに対し我々は、スピンコントラスト変調技術を組み合わせることにより氷結晶の散乱成分を識別できると考え、J-PARCの中性子小角・高角散乱装置 (TAIKAN) に水素核偏極装置を組み込むことでスピンコントラスト変調中性子小角散乱実験を行いました。
実験の結果、グルコースを添加すると、生成した氷結晶は厚さが2-3 nmに対して数十nm以上の広がりをもつプレートを形成していることが分かりました。この厚さは過冷却水中で氷結晶の核が生成するために必要な大きさ(臨界径)とほぼ同じ大きさです。つまり、グルコース溶液中に生成した氷結晶の核は特定の軸方向にはほとんど成長していないことを示しています。従来、糖は周囲の水分子を束縛(水和)することで氷結晶の成長を妨げていると考えられてきました。しかし、ただ水和するだけでは氷結晶はプレート状に成長しません。本結果は、グルコースは水分子を水和するのみならず、他の凍結保護剤のように氷結晶の特定の面に強く結合して、その面方向の成長を抑えるなどの機能も兼ね備えている可能性を示しています。今後、計算科学などを組みあわせてグルコース分子や他の凍結保護剤による氷結晶成長抑制メカニズムを明らかにしていきたいと考えています。
本研究は、原子力機構 物質科学研究センターが研究全体をとりまとめ、J-PARCセンター、総合科学研究機構、広島大学大学院統合生命科学研究科と共同で研究を行ったものです。
本成果は、国際学術誌「The Journal of Physical Chemistry Letters」のオンライン公開版(8月22日(日本時間))に掲載されました。
【これまでの背景・経緯】
近年、食品、医薬品、生体組織などの凍結保存技術の高度化に向けて、氷結晶の成長を抑制して細胞組織の損傷を防ぐ凍結保護剤の開発が進められています。氷結晶は水中で氷核とよばれるナノサイズの氷結晶が生成した後、まわりの水分子を取込みながら大きな塊に成長します。水を多く含む食品、医薬品、生体組織を凍らせる際、この氷結晶の成長により組織が破壊されてしまい、結果として食品や医薬品の品質低下や生体組織の機能が損なわれてしまうことが大きな問題になっています。そこで、試料中に糖などの凍結保護剤を添加して氷結晶の成長を抑制する手法がとられています。これまで、糖は隣接する水分子と強く結合(水和)することで、水分子の自由度を奪い結晶成長を阻害すると考えられてきました。その一方で、不凍タンパク質などの凍結保護剤は氷結晶面に吸着することで結晶成長を阻害すると考えられています。ともに凍結保護剤でありながら、結晶成長の阻害メカニズムはこれほどにも線を引いたように二分されるのでしょうか?例えば、糖分子が氷結晶面に吸着するような結晶成長阻害メカニズムはないのでしょうか?
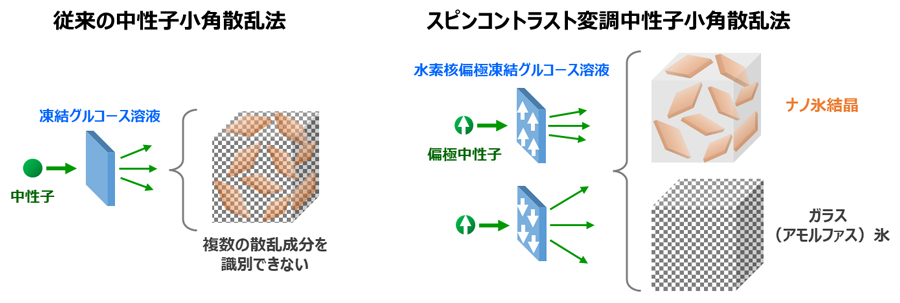
このような結晶成長の阻害メカニズムを解明するために、糖と氷結晶表面の分子構造計算研究がすすめられています。同時に、光学顕微鏡測定では糖の添加により過冷却水中で成長したマイクロメートル以上の氷結晶が様々な形状を作ることが報告されています。しかし、顕微鏡で観察している氷結晶は糖分子の何万倍もの大きさです。分子構造論にもとづいて分子レベルで結晶成長の阻害メカニズムを議論するためには、核生成してすぐのナノスケールの氷結晶を実験的に観測する必要があります。そこで、我々が長年技術開発を進めてきた中性子と水素核のスピンによる構造解析法であるスピンコントラスト変調中性子小角散乱法(図1)を用いて、糖溶液中におけるナノメートルサイズの氷結晶の観測に挑みました。
図1 スピンコントラスト変調中性子小角散乱法の概略図
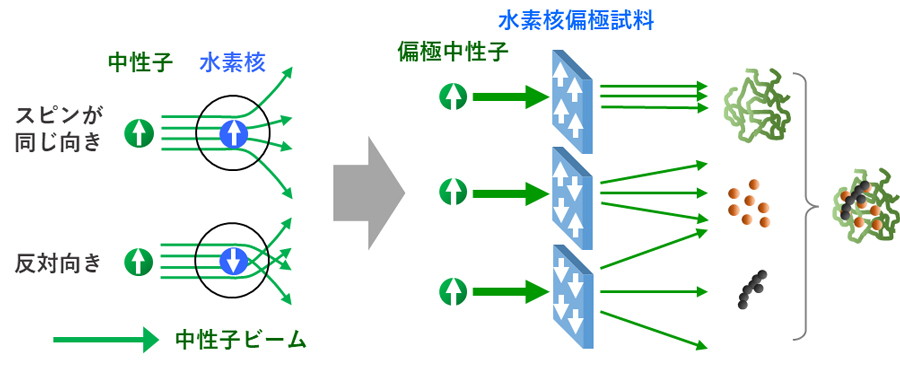
スピンコントラスト変調法は、中性子の水素核に対する散乱が互いのスピンの向きによって大きく異なる性質を利用した構造解析法です。スピンコントラスト変調中性子小角散乱法では、スピンを揃えた中性子ビーム(偏極中性子)のスピン方向に対する試料中の水素核スピンの整列度(水素核偏極度)によって変化する複数の偏極中性子散乱から、多成分によって構成される複合材料中の複数の散乱成分を識別してそれぞれのナノ構造を決定できます。
【今回の成果】
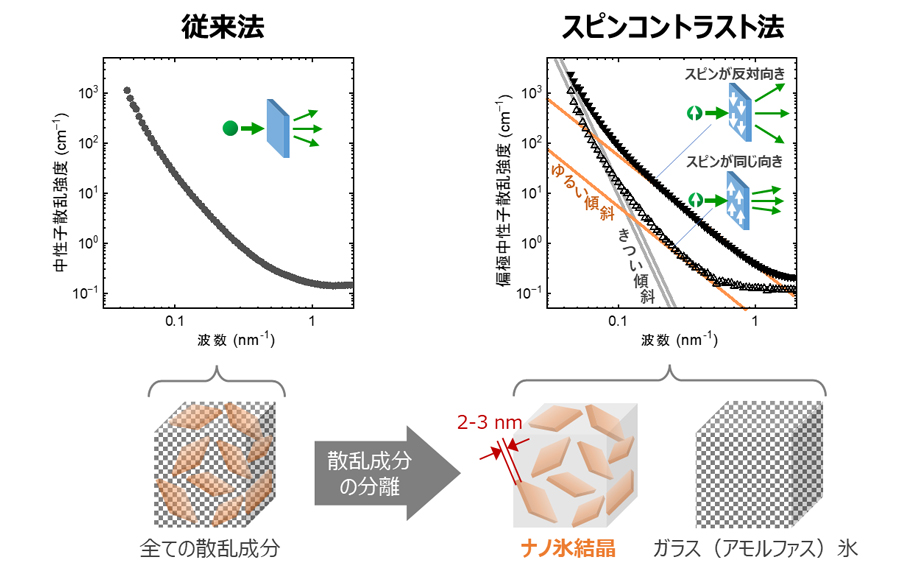
図2左は、-272℃で測定したグルコース水溶液の中性子小角散乱曲線です。中性子小角散乱実験では、散乱される中性子のカウント数(強度)を散乱角の指標である波数ごとにプロットした散乱曲線を解析することで、ナノスケールの散乱体の形状がわかります。しかし、さすがにこのようなのっぺりとした散乱曲線一本だけでは、形状を議論する前にそもそもこの散乱が何の散乱体によるものかすらわかりません。
図2右は同試料のスピンコントラスト変調中性子小角散乱曲線です。中性子に対する水素核スピンの向きに応じて散乱曲線は非相似的に変化しました。この変化から、散乱曲線はスピンに対して散乱強度変化が小さな傾斜のきつい散乱(灰)と、スピンに対する強度変化の大きな傾斜の緩い散乱(橙)の2つの散乱成分によって構成されていることがわかりました。解析の結果、前者はガラス(アモルファス)状氷中のひび割れなどによる散乱で、後者は数十ナノメートル以上の拡がりに対して厚さが2-3nmしかないプレート状のナノ氷結晶の散乱であることがわかりました。この厚さは、水中で氷が結晶核を形成するのに必要な最小限の大きさ(臨界径)3とほぼ同じ大きさです。つまり、この氷結晶は核生成したあと特定の軸方向にほとんど成長していないことを示しています。従来、グルコースを含めて糖は周囲の水分子を束縛(水和)することで水分子の運動を束縛して氷結晶の成長を妨げていると考えられてきました。しかし、同モデルでは氷結晶がプレート状に成長する結果を説明できません。本結果は、グルコースは水分子を水和するのみならず、氷結晶の特定の面に対して選択的に結合し、その面方向の成長を抑えるなどの機能も兼ね備えている可能性を示しています。
図2 従来法(左)とスピンコントラスト法(右)によって得られたグルコース水溶液の中性子小角散乱曲線
【今後の展望】
今後、計算科学などとあわせてグルコース分子や他の凍結保護剤による氷結晶成長抑制メカニズムを明らかにするとともに、長期的には本測定法を通じて臓器・細胞・卵子や精子の冷凍保存技術の開発や、寒冷地における生物の生命維持機能の解明に貢献していきたいと考えています。
【論文情報】
雑誌名:The Journal of Physical Chemistry Letters
タイトル:Polarized Neutrons Observed Nanometer-Thick Crystalline Ice Plates in Frozen Glucose Solution
著者名:Takayuki Kumada1,2, Hiroshi Nakagawa1,2, Daisuke Miura1, Yurina Sekine1, Ryuhei Motokawa1, Kosuke Hiroi2, Yasuhiro Inamura2, Takayuki Oku2, Kazuki Ohishi3, Toshiaki Morikawa3, Yukihiko Kawamura3, and Kiyoshi Kawai4
所属先:1日本原子力研究開発機構 物質科学研究センター、2日本原子力研究開発機構 J-PARCセンター、3総合科学研究機構 中性子科学センター、4広島大学大学院統合生命科学研究科
【各機関の役割】
各研究者の役割は以下の通りです。
- 熊田(日本原子力研究開発機構):研究総括、中性子実験
- 中川、三浦(日本原子力研究開発機構):試料調整、中性子実験
- 関根、元川、稲村(日本原子力研究開発機構)、川井(広島大学):データ解析
- 廣井(日本原子力研究開発機構)、大石、森川、河村(総合科学研究機構):中性子実験、データ解析
- 奥(日本原子力研究開発機構):J-PARC MLFプロジェクト研究課題総括
【参考文献】
1Zhang, M.; Gao, C.; Ye, B.; Tang, J.; Jiang, B. Effects of four disaccharides on nucleation and growth of ice crystals in concentrated glycerol aqueous solution. Cryobiology 2019, 86, 47-51. DOI: 10.1016/j.cryobiol.2018.12.006
2Chang, T.; Zhao, G. Ice Inhibition for Cryopreservation: Materials, Strategies, and Challenges. Adv Sci (Weinh) 2021, 8 (6), 2002425. DOI: 10.1002/advs.202002425
3Pereyra, R. G.; Szleifer, I.; Carignano, M. A. Temperature dependence of ice critical nucleus size. J. Chem. Phys. 2011, 135 (3), 034508. DOI: 10.1063/1.3613672
【助成金の情報】
文部科学省科学技術研究費基盤B (21H03741)
原子力研究開発機構萌芽研究予算
【J-PARC MLF採択研究課題】
J-PARC MLFプロジェクト研究課題「中性子光学デバイスおよび検出システムの開発と応用」