2023-09-01 東京大学
発表のポイント
◆深層学習を用いた、対話型画像解析プラットフォーム「PHILOW」を開発しました。
◆優性遺伝性視神経萎縮症の発症と非常に高い関連が知られるOPA1タンパク質が、シート(ラメラ)状クリステとチューブ状クリステの量比を制御することをPHILOWによる解析によって新たに発見しました。
◆本プラットフォームを用いた細胞内微細構造の迅速かつ正確な解析手法は、今後、さまざまな疾患における細胞内微細構造の解析への応用が期待されます。
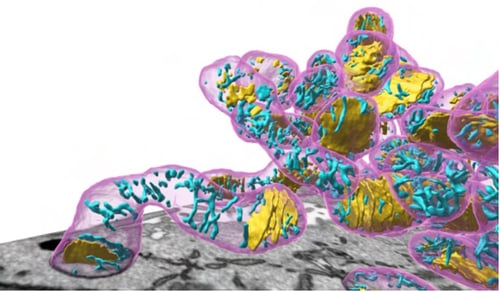
PHILOWを用いて正確に抽出されたミトコンドリア(マゼンタ)とチューブ状クリステ(シアン)とラメラ状クリステ(黄)
発表概要
東京大学大学院工学系研究科化学生命工学専攻の菅翔吾大学院生、中村航規大学院生、中西優大学院生、河合宏紀客員研究員、平林祐介准教授の研究グループは、沖縄科学技術大学院大学イメージングセクションのブルーノ・ホンベルマネージャー(研究当時)と共同で、深層学習と人間による対話(Human-in-the-loop)型の画像解析プラットフォームPython-based human-in-the-loop workflow(PHILOW)を開発し、ミトコンドリア(注1)内部立体構造の詳細な可視化に成功しました。
ミトコンドリアなどのオルガネラ(注2)構造を解析するには、細胞内に複雑に混在するさまざまな構造が映り込んだモノクロの電子顕微鏡(電顕)(注3)画像中から目的のオルガネラだけを塗り絵のように手作業でトレースする(抽出する)必要があります。そのため、これまでその解析には膨大な時間を要しました。そこで本研究グループは深層学習と人間による対話型画像解析プラットフォームPHILOWを開発し、電顕画像からの目的構造の抽出を圧倒的に正確かつ高速化しました(図1)。その結果、ミトコンドリア全体の内部膜(クリステ(注4))立体構造を、人間の力を超えた(superhuman)精度で初めて可視化し、定量的に解析することが可能になりました。実際に今回、この手法を用い、優性遺伝性視神経萎縮症の発症と非常に高い関連が知られるOPA1タンパク質(注5)のクリステ形成制御における新たな役割を解明しました。今後、AIと人間との対話型手法を用いることで、さまざまな疾患の原因解明や、医療や産業への応用が期待されます。
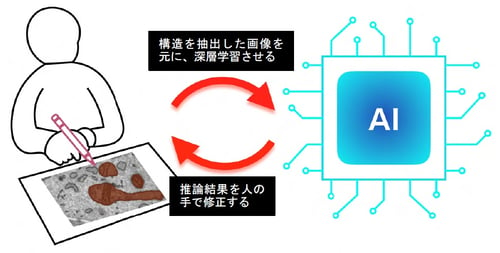
図1:深層学習と人間による対話型学習法(Human-in-the-loop)の概略図
発表内容
〈研究の背景〉
近年、さまざまな技術が発達し、どのような遺伝子の変異がどのように細胞に影響を与えるのかを効率的に解析できるようになりました。その結果、多くの遺伝子がミトコンドリアなどのオルガネラ構造を制御し、その制御の破綻が病気の原因となる可能性が示唆されました。しかし、それぞれの遺伝子がどのようにオルガネラの構造を変化させているのかについて、多くのことが解明されていません。これは、ナノメートルサイズのオルガネラの構造を解析することが未だに非常に非効率であることが原因でした。電顕はナノメートルレベルの解像度で撮影することができる顕微鏡で、オルガネラの超微細構造を観察するのには欠かせません。しかし、ナノメートルレベルの解像度で撮影された電顕画像中には、さまざまな膜構造や核酸などが全てモノクロ画像として写っており、目的の構造物のみを電顕画像から抽出する必要があります。これまでこの抽出作業、つまり目的構造のみをトレースする作業は、ほとんどエキスパートによって手作業で行われ多大な労働量を必要としていました。
〈研究の内容〉
まず、集束イオンビーム走査型電子顕微鏡(FIB-SEM)(注6)を用いて培養細胞の連続した数百枚の電顕画像、つまり細胞の断層画像を取得しました。これまでであれば、この画像の中から全てのミトコンドリア、および内部膜構造を人間の手でトレースし、初めて解析することが可能でした。しかし、その作業には膨大な労力と時間を要するため、本研究では深層学習を用いてコンピュータに自動で目的の構造をトレースさせることを試みました。深層学習を用いた解析にはまず、コンピュータにお手本(教師データ(注7))として「人間であったらどのような構造を電顕画像中のミトコンドリアだと判断するのか」を示さなくてはなりません。そのために、まず数百枚の連続断層電顕画像の中から数十枚おきに選んだ10枚程度の電顕画像についてその画像内のミトコンドリアを手で塗り分け、深層学習を用いることでコンピュータにミトコンドリアの構造的特徴を学ばせた「モデル」を作成しました。このモデルを用いて元の数百枚の電顕画像の中から、ミトコンドリアだと判断される領域をコンピュータに推論させたところ、約70%のミトコンドリア領域は正確に推論されていましたが、残りの30%は手作業で修正する必要があり、未だ多くの時間と労力を割く必要がありました(図2A)。これはお手本で与えた教師データに含まれない、すなわちコンピュータにとっては見たことのない形をしたミトコンドリアが多く、それらをコンピュータがミトコンドリアと認識出来なかったことによります。そこで、多様なミトコンドリアの特徴をカバーする教師データを効率的に作成するために、「コンピュータによるモデルの学習→モデルを用いたコンピュータによる推論→コンピュータの間違いの人間による修正(コンピュータが知らなかったミトコンドリアを人間が教える)→コンピュータによるモデルの学習」という、Human-in-the-loop法(HITL法)を導入することを考案しました(図2B)。この方法では、少ない枚数の教師データからスタートし、コンピュータが知らなかった構造だけを選択的に教えてあげれば良いので、非常に効率よく包括的な教師データを作成することが出来ます。ただ、HITL法を行うためには、電顕画像から目的の構造を抽出するためのいわゆる色塗りツールと、深層学習のプラットフォームを交互で利用しつつ、その間に同時に教師データや推論結果などの画像ファイルや深層学習用のプログラミングコードを適切に管理しなくてはならず、その実行は非常に煩雑で、実現することは事実上不可能でした。そこで、本研究グループは、プログラミングのコードを書かずにHITL法を使えるように、これらの作業を行うために必要な全ての機能を搭載した独自のプラットフォームPHILOWを開発しました。PHILOWは誰でも使えるよう、無料で公開しており、インストール方法から使用方法まで詳細に説明しています。
(PHILOW:https://github.com/neurobiology-ut/PHILOW)
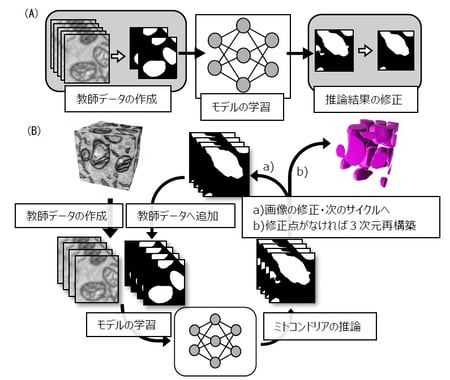
図2:(A)従来の深層学習による構造抽出方法、(B)PHILOWを用いた構造抽出方法
PHILOWでは、さらに2次元平面の電顕画像からの構造抽出アルゴリズムを3次元の連続電顕画像により効果的に適用すべく、X-Y平面の画像から学習させた深層学習のモデルをY-Z平面、Z-X平面にも適用し、1つの構造が目的構造であるか3方向から推論して多数決で決める手法、Three-Axes Prediction法(TAP法)を実装しました。その結果、3次元的に構造を解析することで、ミトコンドリアの境界線部分も非常に高い精度で抽出可能になり、PHILOWを使用し連続した数百枚の電顕画像からミトコンドリアを抽出したところ、抽出精度を99%以上にまで向上させることができました。これは、従来の深層学習による抽出法を用いて3ヶ月かかった構造抽出に、10日しか必要としないことを意味しています。
ミトコンドリアは限られた体積で効率的にエネルギーであるATP(注8)の産生などの生化学反応を行うために、複雑で折り畳まれた内部構造、クリステを形成しています。さまざまな細胞や組織において必要とされる生化学反応の種類や速度は異なり、それに応じてクリステは多様な形態をとっていると考えられています。しかし、クリステが複雑な構造であるがために3次元構造の定量的情報は決定的に欠けていました。そこで、PHILOWを用いたHITL-TAP手法によりFIB-SEMで撮影した数百枚の連続した電顕画像からクリステの抽出を試みたところ、人間による抽出よりも高精度に、つまりsuperhumanの精度でクリステを3次元的に再構築することに世界で初めて成功しました(図3)。
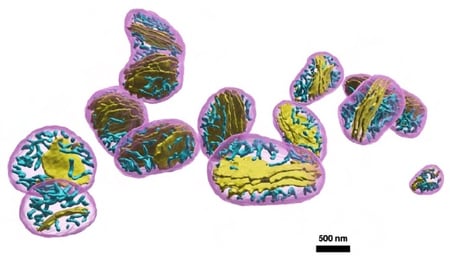
図3:ミトコンドリアとその中のクリステ構造の3次元再構築
次に、優性遺伝性視神経萎縮症との関連性がよく報告されているタンパク質OPA1に着目し、PHILOWを用いた解析を行いました。OPA1遺伝子が変異することで、クリステ構造が変化すること自体は知られていたものの、どのように変化するのかを、3次元的かつ定量的に解析した研究例はいままで報告されていませんでした。そこで、OPA1を欠損させた培養細胞の3次元連続電顕画像をFIB-SEMで撮影しました。そして、HITL-TAP法を用いて、100個以上のミトコンドリアとその内部のクリステを抽出し、3次元再構築を行いました。近年の電子線トモグラフィー(注9)を用いた研究により、クリステ構造はシート(ラメラ)構造とチューブ構造に分けられることがわかっていましたが、今回3次元再構築したデータを元に定量解析を行ったところ、OPA1欠損細胞では、ミトコンドリアの一定の体積におけるクリステの量は変わらないものの、チューブ状クリステの割合のみが減っていました(図4)。これにより、OPA1はクリステがラメラ状かチューブ状か、どちらの構造を取るかのバランスを決定する上で重要な役割を果たしていることを新たに発見しました。
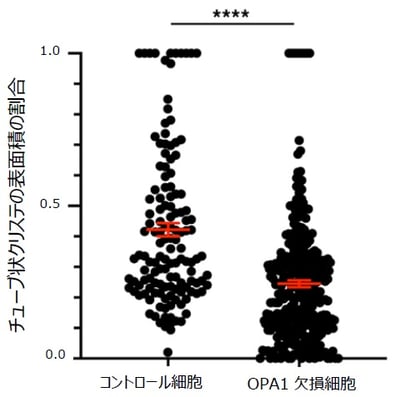
図4:OPA1がクリステの構造の割合の決定に重要であることを発見
〈今後の展望〉
今回開発したPHILOWは、今後、深層学習を用いたさまざまな画像解析に応用され、多様な研究を促進することが期待されます。また、今回のOPA1の機能の新たな理解は、優性遺伝性視神経委縮症などの疾患におけるミトコンドリアの変異と病態の関連を探る上で重要な一歩となります。今後、本手法を用いることで、クリステ構造が異常になることが知られているパーキンソン病などの神経変性疾患やミトコンドリア病、さらにはミトコンドリア以外のオルガネラが関与した疾患について、原因究明の加速が期待されます。
研究グループの構成
東京大学大学院工学系研究科化学生命工学専攻
菅 翔吾(博士課程)
中村 航規(博士課程)
中西 優(修士課程)
河合 宏紀(客員研究員)
平林 祐介(准教授)
沖縄科学技術大学院大学イメージングセクション
ブルーノ ホンベル(Bruno M. Humbel)(研究当時:マネージャー)
論文情報
〈雑誌〉PLOS Biology
〈題名〉An interactive deep learning-based approach reveals mitochondrial cristae topologies
〈著者〉Shogo Suga, Koki Nakamura, Yu Nakanishi, Bruno M. Humbel, Hiroki Kawai*, Yusuke Hirabayashi*
研究助成
本研究は、国立研究開発法人日本医療研究開発機構(AMED)(課題番号:JP19dm0207082)、創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)(課題番号:19am0101116j0003、20am0101116j0004)、日本学術振興会科学研究費補助金「新学術領域研究(課題番号:20H04898)」、「挑戦的研究(課題番号:21K19253)」、「研究活動スタート支援(課題番号:20K22622)」、「特別研究員奨励費(課題番号:22J23099、22J23115)」、公益財団法人 セコム科学技術振興財団「特定領域研究助成」、公益財団法人 上原記念生命科学財団「特定研究助成金」、Chan zuckerberg initiative「napari Ecosystem Grants」の支援により実施されました。
用語解説
(注1)ミトコンドリア
細胞内に存在する、細胞内小器官(オルガネラ、後述)の1つ。ミトコンドリアは、エネルギーを産生し、細胞内のカルシウムイオン濃度を調整するなど、重要な役割を果たしている。
(注2)オルガネラ
細胞内に存在している、機能を持った小器官の総称。細胞内小器官とも呼ばれており、例としては核、ミトコンドリア、小胞体、ゴルジ体、リソソームなどがある。
(注3)電子顕微鏡
光よりも波長の短い電子線を照射することで、試料の原子レベルの微細構造を観察することができる顕微鏡。光学顕微鏡の分解能がおよそ1マイクロメートルであるのに対し、電子顕微鏡の分解能はおよそ0.1ナノメートルと、約10,000倍の分解能を持っている。
(注4)クリステ
ミトコンドリアの内膜のうち、内側に陥入した層状あるいはチューブ状の折り畳まれた構造のこと。複雑な構造をとることで表面積を増やし、化学反応が生じる場を増加させることで、呼吸におけるエネルギー生産の効率を上昇させている。
(注5)OPA1(Optic Atrophy 1)
優性視神経委縮症の1型から同定された、GTP加水分解タンパク質。ミトコンドリア内膜に局在し、クリステの構造を制御していることが知られており、ミトコンドリアの融合に関与している。
(注6)集束イオンビーム走査型電子顕微鏡(Focused ion beam scanning electron microscopy: FIB-SEM)
集束イオンビーム装置(FIB装置)と走査型電子顕微鏡(SEM)を1つに統合した装置。細く集束したイオンビームを試料表面で走査することで、試料表面を薄く削り、削った面をSEMで撮影する。このサイクルを繰り返すことで、3次元電顕画像を撮影することができる。
(注7)教師データ
AIが機械学習や深層学習に利用するデータのこと。「このデータを入力するとこの正解データが出ます」となるよう、オリジナルのデータとそれに対応する正解のデータをペアにして、AIに入力する。
(注8)ATP(アデノシン三リン酸)
全ての細胞において必要不可欠なエネルギーの供給源のこと。ATPはアデニン(塩基)とリボース(糖)が結合したアデノシンのリボース部分に3つのリン酸がついたものであり、生体内でATPからリン酸が外れてADP(アデノシン二リン酸)になることで大きなエネルギーを放出し、ADPにリン酸が結合することでエネルギーを貯蔵する。
(注9)電子線トモグラフィー
透過型電子顕微鏡(Transmission Electron Microscopy: TEM)を用いて電子線を試料に連続的に傾けながら照射して投影像を撮影し、撮影した画像を計算機トモグラフィー(Computerized Tomography: CT)で3次元再構築する手法。
プレスリリース本文:PDFファイル
PLOS Biology:https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002246