2023-09-08 理化学研究所
この動画にはナレーションはありません
©Lab Animal
理化学研究所(理研)バイオリソース研究センター 実験動物開発室の仲柴 俊昭 専任研究員、吉木 淳 室長、疾患ゲノム動態解析技術開発チーム(研究当時)の阿部 訓也 チームリーダー(現 バイオリソース研究センター 客員主管研究員)、脳神経科学研究センター 細胞機能探索技術研究チームの宮脇 敦史 チームリーダーらの共同研究グループは、ホタル由来の発光遺伝子を導入し、異なる波長で非常に明るく発光する2種の新しいマウス系統を開発し、生体深部組織の発光イメージング(BLI)[1]を飛躍的に改善させました。
本研究成果は、生体深部の細胞や臓器の振る舞いを非侵襲的に可視化することができる技術であり、今後、がんや免疫反応など病的な状態にある生体システムの理解に貢献するものと期待されます。
共同研究グループは今回、最新の発光システムを利用し、肉眼でも観察可能なほどに全身が明るく光る遺伝子改変マウス系統の作出に成功しました。開発した新しいマウス系統を用いれば、生体深部にある特定の細胞や組織を標識することも、生体外から観察することもできます。さらに、異なる色(黄色と深赤色)に発光するマウス系統を用いることで、同一個体内にある二つの標識組織を同時に検出することも可能になりました。
本研究成果は、科学雑誌『Lab Animal』オンライン版(9月7日付)に掲載されました。
背景
これまで動物個体の発光イメージング(BLI)では、ホタルの生物発光システムである、北米産のホタル(Photinus pyralis)由来の発光酵素のルシフェラーゼ[2](Fluc)と、ホタル由来の発光基質のルシフェリン[3](D-luciferin)を反応させるという生物発光のシステムが一般的でした。
しかし、FlucとD-luciferinの酵素反応によって得られる光の強度は弱く、生体深部の観察には不十分でした。しかも哺乳類の細胞で用いると、オレンジ色の単色でしか発光しません。そのため、世界中でより明るく光る発光システムを持つ生物種の探索、既存システムのFluc遺伝子を改変してより明るく光る人工生物発光システムを開発する研究、ならびにD-luciferinを改変して発光する色を変化させる研究が盛んに行われてきました。
これらの先行研究の中で、オリンパス株式会社(研究当時、現株式会社エビデント)の研究グループは、沖縄に生息するホタル(Pyrocoelia matsumurai)由来のルシフェラーゼ(oFluc)がD-luciferinと反応すると、従来のFlucに比べて4~10倍も明るく発光し、その発光色が黄色になることを発見しました注1)。また、宮脇チームリーダーらは、人工酵素Akalucと人工基質AkaLumine-HClを組み合わせると、発光色が深赤色になり、発光イメージングの効率が従来の発光システムと比べ100~1,000倍になる人工生物発光システムAkaBLIを開発しました注2)。
本研究では、これら最新の発光システムを用いることで、全身で発光するマウス系統と、生体内でさまざまな細胞や組織を標識できるマウス系統の開発に挑みました。
注1)Ogoh, K., Akiyoshi, R. & Suzuki, H. Cloning and mutagenetic modification of the firefly luciferase gene and its use for bioluminescence microscopy of engrailed expression during Drosophila metamorphosis. Biochem Biophys Rep 23, 100771 (2020).
注2)2018年2月23日プレスリリース「脳の深部を非侵襲的に観察できる人工生物発光システムAkaBLI」
研究手法と成果
明るく光る最新の発光システムをマウス個体に導入するため、ゲノム編集技術[4]を用いて、マウスのゲノムにルシフェラーゼのoFluc遺伝子、あるいはAkaluc遺伝子を挿入(ノックイン)した2種の新しいマウス系統を作出しました(oFlucマウスとAkalucマウス)。これらのマウスでは転写を防ぐNeo(薬剤耐性遺伝子)カセットによってルシフェラーゼの発現が抑えられているため発光しません。しかし、Cre-loxPシステム[5]の部位特異的組換え技術を組み合わせると、Neo(薬剤耐性遺伝子)カセットを取り除くことができ、強力なCAGプロモーター[6]によってマウス生体内のさまざまな細胞や組織で特異的にルシフェラーゼのoFluc、あるいはAkalucを発現させて標識できるようになり、狙った細胞や組織を発光させることができるようになります(図1)。
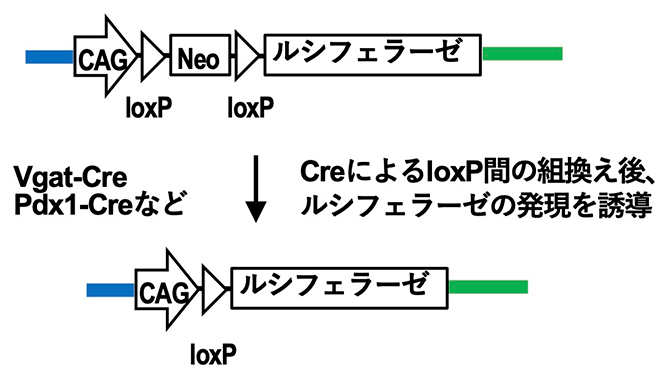
図1 Cre-loxPシステムの部位特異的組換え技術でルシフェラーゼを発現
DNA組換え酵素のCreによってゲノム上のloxP(Creの認識配列)ペアの間で組換えを生じると、プロモーター(CAG)の直下にルシフェラーゼが配置されるようになる。その結果ルシフェラーゼが発現する。DNA組換え酵素のCreによる組換えが生じていない細胞や組織では、ルシフェラーゼの発現は転写を防ぐNeo(薬剤耐性遺伝子)カセット(DNA配列)によって抑えられている。
マウスの全身でCre-loxPシステムを働かせてoFlucあるいはAkalucを発現させると、D-luciferinを投与したCAG-oFlucマウスは黄色に発光し、AkaLumine-HClを投与したCAG-Venus/Akalucマウスは深赤色に光るようになりました(図2)。これら「光るマウス」の発光強度は肉眼でも観察できるほど強く、2色の異なる色に発光するマウスを一般的な家庭用のデジタルカメラでリアルタイムに撮影できます(動画参照)。
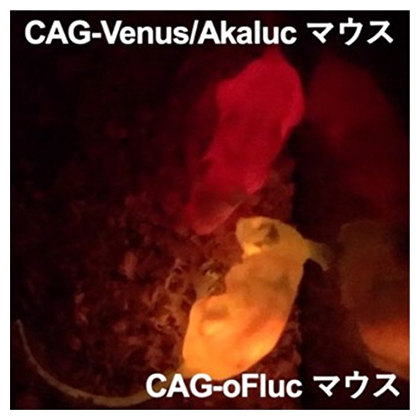
図2 「光るマウス」
CAG-Venus/AkalucマウスにAkaLumine-HClを投与すると深赤色に(上)、CAG-oFlucマウスにD-luciferinを投与すると黄色に発光する(下)。家庭用のデジタルカメラで撮影。
次に、光らないAkalucマウスやoFlucマウスと、生体内で特定の細胞や組織を特異的に標識できるCreマウス[7]とを組み合わせることで、AkalucあるいはoFlucを発現させ、生体深部組織の非侵襲的な発光イメージングの実現可能性について検証しました。脳を構成する一部の抑制性神経細胞[8]を標識できるVgat-Creマウス[9]と交配したところ、実際に神経細胞からの発光を確認できました(図3左)。ただ、Akalucを用いたマウスの方がoFlucを用いたマウスよりも、脳からの発光シグナルが30倍以上も強いことが分かりました(図3右)。これはAkalucの基質であるAkaLumine-HClが血液脳関門[10]を通過して脳深部まで浸透しやすい一方、oFlucの基質であるD-luciferinは血液脳関門を通過しづらいことを示しています。
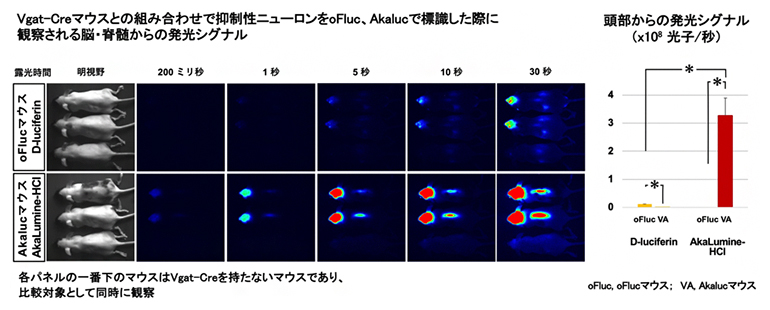
図3 抑制性神経細胞の発光イメージング
(左)Vgat-Creマウスを使い、抑制性神経細胞をoFlucまたはAkalucで標識した場合に、脳と脊髄の抑制性神経細胞から検出された発光シグナル。異なる露光時間で撮影して比較すると、oFlucマウス(上段)に比べてAkalucマウス(下段)の方の発光シグナルが強いことが分かる。
(右)頭部からの発光シグナルを定量化(×108光子/秒)。Akalucマウス(赤)の方がoFlucマウス(黄)よりも30倍以上強い。
膵臓は脳とは異なり、D-luciferinの生体内浸透度[11]が問題となりません。そこで、光らないAkalucマウスあるいはoFlucマウスを、Pdx1-Creマウス[12]と交配して膵臓を標識したところ、Akalucを用いたマウスとoFlucを用いたマウスで、同程度の発光シグナル強度が得られることが分かりました(図4左)。さらに、標識する細胞や組織によっては、oFlucもAkalucと同程度に生体深部組織の非侵襲的な発光イメージングに利用できることが判明しました。また、oFlucとAkalucが生体深部から発光する光の色の違いをデジタルカメラで撮影することができました(図4右)。
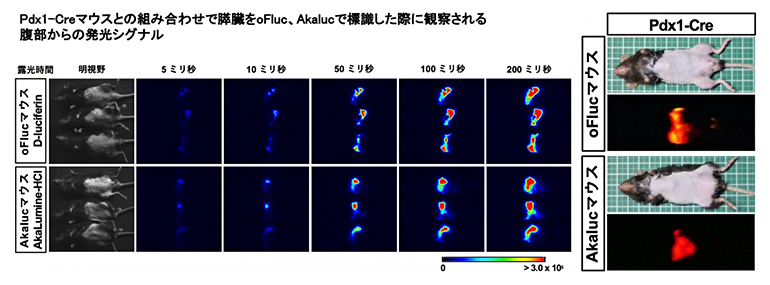
図4 膵臓の発光イメージング(左)と膵臓から発光した光の色の違い(右)
(左)Pdx1-Creマウスを使い膵臓をoFlucまたはAkalucで標識した場合に、腹部から検出された発光シグナル。異なる露光時間で撮影して比較しても、oFlucとAkalucのシグナル強度は同じくらいであった。
(右)膵臓で発光する左のマウスを家庭用デジタルカメラで体外から撮影した。oFlucマウスは黄色、Akalucマウスは深赤色を呈する。
多色でのイメージングが実現すれば、複数の生体現象を同時に可視化することができることから、単色でのイメージングよりも多くの情報が得られます。そこで、oFlucとAkalucの発光色の違いを利用して、2色同時の発光イメージングが可能かどうかを検証しました。AkalucはAkaLumine-HClを基質として発光し、oFlucはD-luciferinを基質として発光します。
まず、oFlucとAkalucがそれぞれの逆の基質との交差反応[13]がどれくらいかを把握する必要があります。先行研究から、AkalucはD-luciferinを加えても発光しないことが報告されていました。他方、oFlucはAkaLumine-HClを加えた場合にどの程度発光するかについては全く知られていませんでした。膵臓をoFlucで標識したマウスにAkaLumine-HClを投与した場合には、D-luciferin投与の場合に比べてわずか1%以下の発光シグナルしか検出できませんでした。こうしたことから、それぞれの基質とルシフェラーゼの間の交差反応は非常に低く、それぞれの特異性が高いことが分かりました。
次に、先の光るマウスの子孫である「光る胎児」を左右二つある子宮でそれぞれ育てている妊娠マウスに、D-luciferinとAkaLumine-HClを段階的に投与しました。すると、はじめに投与された基質に対応する胎児が発光し、追加でもう一つの基質を投与すると、その基質に対応する胎児が光るようになりました(図5左)。2色同時に発光している妊娠マウスに対して、発光する色の違い(波長の違い)を分離する光学的フィルター[14]を用いて撮影すると、oFlucとAkalucの光る胎児を明瞭に区別することができ、oFlucとAkalucを使ったマウス系統で2色同時の発光イメージングが可能であることが明らかになりました(図5右)。
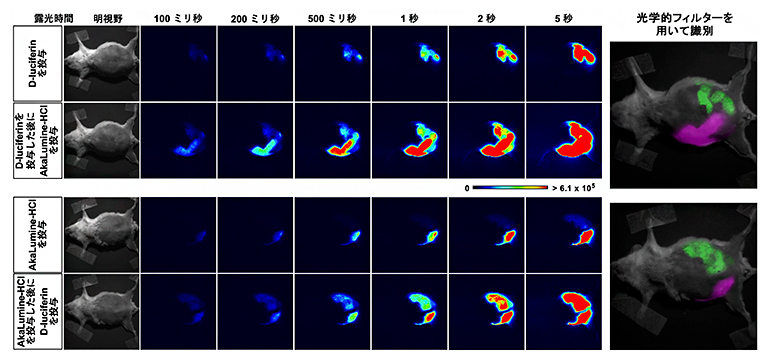
図5 2色同時の発光イメージング
(左)CAG-oFlucの胎児を左の子宮で、CAG-Venus/Akalucの胎児を右の子宮で育てている妊娠マウス(胎生期14.5日齢)に対して、上段ではD-luciferinを投与して撮影した(上)後に、AkaLumine-HClを投与して撮影(下)。下段では逆の順番で投与して撮影した。投与された基質に対応した胎児から発光シグナルが検出されるようになる。先に投与された基質に対応する胎児も、発光シグナルを出し続ける。
(右)光学的フィルターを使うと、発光する光の色の違い(波長の違い)を利用してどちらのルシフェラーゼを持つ胎児であるか識別できる。緑がCAG-oFlucの胎児、マゼンタがCAG-Venus/Akalucの胎児。
今後の期待
全身で「光るマウス」の臓器を調べてみると、調べた全ての臓器から発光シグナルを検出できることが分かりました。今後、体を構成するさまざまな種類の「光る細胞」を取り出し、別の個体へ移植する実験に使用すれば、移植された細胞が生体深部でどのように振る舞っているかが、発光イメージングで非侵襲的に可視化することができるようになります。また、異なる色で発光する同種あるいは異種の細胞を移植し2色同時の発光イメージングを行うことで、同種の細胞同士の競合関係や、異種の細胞同士の協調関係といった、これまでのイメージング手法では観察できなかったような、生体内でのダイナミックな関係を明らかにできるかもしれません。
さらに、今回作出したマウス系統はCre-loxPシステムの部位特異的組換え技術を導入したものであるため、生体内で標識できる細胞や組織の対象をCreの発現特異性で決めることができます。従って、今回観察した抑制性神経細胞や膵臓だけでなく、世界中に存在する多種類のCreマウスと組み合わせることで、さまざまな細胞や組織の生体内での振る舞いを発光イメージングでリアルタイムに追跡可能になります。
今回開発された発光イメージングマウス系統は、がんや免疫反応など病的な状態にある生体システムの理解にも貢献すると考えられ、生命科学研究の広い分野で利用される非常に有用なバイオリソースになるものと期待されます。
補足説明
1.発光イメージング(BLI)
ホタルの光に代表される生物発光を用いたイメージング手法。励起光を必要としないイメージング手法のため、生体組織への損傷も少なく長時間の経時的な観察が可能になる。また、シグナル/ノイズ比が高いため、優れた定量性を持つ。BLIはBioluminescent Imagingの略。
2.ルシフェラーゼ
ホタルなどの生物発光において、光を放つ反応を触媒する作用を持つ酵素の総称。Flucはホタル由来のルシフェラーゼで、D-luciferinを酸化する。ホタルの種類によって遺伝子配列が異なり、発光色が異なる。
3.ルシフェリン
ルシフェラーゼにより酸化されて発光する基質の総称。D-luciferinは、ホタルなどの陸生生物の生物発光で使われる発光基質。Flucなどのルシフェラーゼによって酸化されて発光する。
4.ゲノム編集技術
ゲノムDNA上の特定の遺伝子を狙って変化させる技術。遺伝子の変異を導入できるだけでなく、外来DNAを導入(ノックイン)することもできる。
5.Cre-loxPシステム
細胞種選択的に遺伝子発現を操作する遺伝子工学技術の一つ。DNA組換え酵素CreはloxP配列と呼ばれる特定の遺伝子配列を認識して、部位特異的に組換えを起こす。Creの発現する細胞・組織・臓器をコントロールすることで、体内の狙った領域だけに変異を加えることができる。今回は、Neo(薬剤耐性遺伝子)カセットを取り除く変異を加えて、ルシフェラーゼ遺伝子の発現を誘導した。
6.CAGプロモーター
サイトメガロウイルスとニワトリのβ-アクチン遺伝子の遺伝子発現調節領域を人工的につなげた、とても強い遺伝子発現活性を持つプロモーター(遺伝情報の転写を調節するDNA内の領域)。目的のタンパク発現量を最大にすることができる。
7.Creマウス
体の中で特定の細胞・組織・臓器でDNA組換え酵素Creを発現するマウス。世界中でたくさんの種類のCreマウスが作られており、それぞれ体の中での発現の特異性が異なる。
8.抑制性神経細胞
神経細胞のうちGABA(γアミノ酪酸)を伝達物質として放出し、他の神経細胞の活動を抑制する神経細胞。脳の部位によって割合は異なるが、大脳皮質では神経細胞全体の約20%を構成すると言われている。
9.Vgat-Creマウス
抑制性神経細胞で発現する遺伝子(Vgat)のプロモーターを利用して、DNA組換え酵素Creを発現するようにしたマウス。抑制性神経細胞の標識に利用される。
10.血液脳関門
脳内血管と脳内細胞(神経細胞、グリア細胞)間の物質交換を制限する機構。脳に必要な物質を血液中から選択して脳へ供給するとともに、有害な物質の侵入を阻止する。
11.生体内浸透度
投与された薬や化合物の生体内への浸透の度合いの指標。血液脳関門のように浸透を物理的に防ぐケースや、生体内での代謝によって別の物質へと変換されたりするため、薬や化合物は生体内で均等に浸透するわけではない。投与した薬や化合物が効力を発揮するのに十分な濃度に達しているかどうかは、対象としている組織や臓器での生体内浸透度で判断することができる。
12.Pdx1-Creマウス
膵臓などの臓器を形作るのに必須な遺伝子Pdx1のプロモーターを利用して、DNA組換え酵素Creを発現するようにしたマウス。膵臓などの臓器の標識に利用される。
13.交差反応
異なるルシフェラーゼ(今回の場合はoFlucとAkaluc)に対して、それぞれに適合する基質のルシフェリン(D-luciferinとAkaLumine-HCl)の組み合わせを取り替えた場合に観察される反応。交差反応が低いほど、ルシフェラーゼとルシフェリンのペアの特異性が高い。
14.光学的フィルター
光の波長の違いを利用して、特定の波長の光だけを選別するフィルター。
共同研究グループ
理化学研究所
バイオリソース研究センター
実験動物開発室
専任研究員 仲柴 俊昭(ナカシバ・トシアキ)
開発研究員 水野 沙織(ミズノ・サオリ)
室長 吉木 淳(ヨシキ・アツシ)
疾患ゲノム動態解析技術開発チーム(研究当時)
チームリーダー 阿部 訓也(アベ・クニヤ)
(現 理研 バイオリソース研究センター 客員主管研究員)
遺伝子材料開発室
テクニカルスタッフII 中島 謙一(ナカシマ・ケンイチ)
脳科学総合研究センター 細胞機能探索技術研究チーム
チームリーダー 宮脇 敦史(ミヤワキ・アツシ)
客員研究員 岩野 智(イワノ・サトシ)
オリンパス株式会社(研究当時、現 株式会社エビデント)
主任研究員 小江 克典(オゴウ・カツノリ)
主任研究員 杉山 崇(スギヤマ・タカシ)
筑波大学 医学医療系 生命科学動物資源センター
教授 水野 聖哉(ミズノ・セイヤ)
教授 杉山 文博(スギヤマ・フミヒロ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金(課題番号:26890026)および科学技術振興機構(JST)共創の場形成支援プログラム(つくば型デジタルバイオエコノミー社会形成の国際拠点)の助成を受けて行われました。
原論文情報
Toshiaki Nakashiba, Katsunori Ogoh, Satoshi Iwano, Takashi Sugiyama, Saori Mizuno-Iijima, Kenichi Nakashima, Seiya Mizuno, Fumihiro Sugiyama, Atsushi Yoshiki, Atsushi Miyawaki, Kuniya Abe, “Development of two mouse strains conditionally expressing bright luciferases with distinct emission spectra as new tools for in vivo imaging.”, Lab Animal, 10.1038/s41684-023-01238-6
発表者
理化学研究所
バイオリソース研究センター 実験動物開発室
専任研究員 仲柴 俊昭(ナカシバ・トシアキ)
室長 吉木 淳(ヨシキ・アツシ)
疾患ゲノム動態解析技術開発チーム(研究当時)
チームリーダー 阿部 訓也(アベ・クニヤ)
(現 理研 バイオリソース研究センター 客員主管研究員)
脳神経科学研究センター 細胞機能探索技術研究チーム
チームリーダー 宮脇 敦史(ミヤワキ・アツシ)
報道担当
理化学研究所 広報室 報道担当