2023-09-13 京都大学iPS細胞研究所
1. 概要
京都大学大学院 医学研究科 形態形成機構学 萩原正敏 教授、細川元靖 助教(現 愛媛大学大学院医学系研究科)、呼吸器疾患創薬講座 三河隆太 特定助教、呼吸器内科学 平井豊博 教授、iPS細胞研究所 臨床応用研究部門 後藤慎平 教授らは、東京医科大学 阿部信二 教授、東京医科歯科大学 瀬戸口靖弘 特任教授との共同研究において、疾患特異的iPS細胞を用いて遺伝性間質性肺炎の治療薬の候補物質を見出しました。
間質性肺炎は、呼吸機能を担う肺胞上皮細胞が繰り返し傷害を受けることにより、傷の修復を担う線維芽細胞が異常に活性化し、肺胞の壁が固くなってしまうことで呼吸機能が低下する病気と考えられています。間質性肺炎の治療薬はこれまでに限られたものしかなく、病態形成の引き金となる肺胞上皮の障害を標的とした治療薬はこれまでになかったため、この部分に焦点を当てた創薬の研究を進めてきました。iPS細胞は様々な臓器の細胞に分化誘導することができる細胞株として半永久的に保存可能な多能性幹細胞です。患者さんの末梢血からの樹立が可能なため、間質性肺炎の病態解析における患者さん由来の肺胞上皮細胞を無限に作り出すことのできる技術として創薬への応用が期待されています。
研究グループは遺伝性間質性肺炎の原因として知られている肺のサーファクタントタンパク質をコードする遺伝子SFTPC(surfactant protein C )のバリアントが引き起こす細胞表現型を指標として、化合物スクリーニングを行いました。患者さんから樹立したiPS細胞から分化させた肺胞上皮細胞を用いて、治療薬候補化合物を同定しました。さらに肺胞オルガノイドを用いて薬効を評価しました。本研究は間質性肺炎の初期の肺胞上皮障害を標的とする新しい治療薬の開発につながることが期待されます。
本成果は、2023年8月25日に国際学術誌「iScience」にオンライン掲載されました。
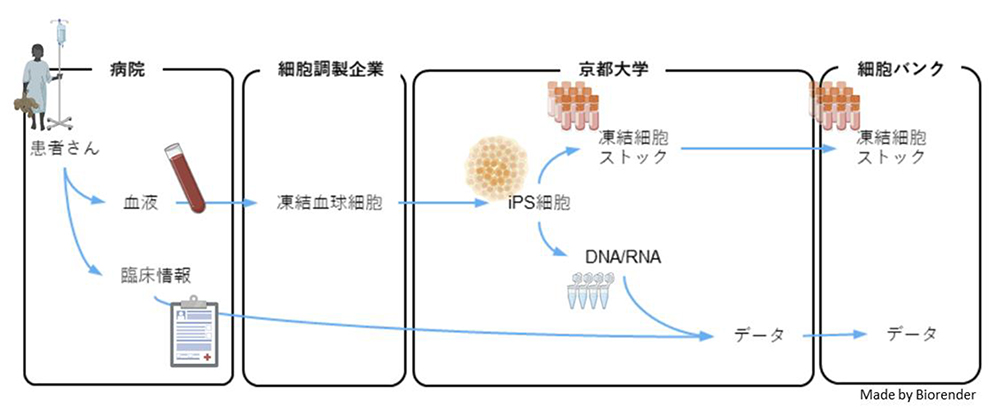
 研究の概略図
研究の概略図
2. 背景
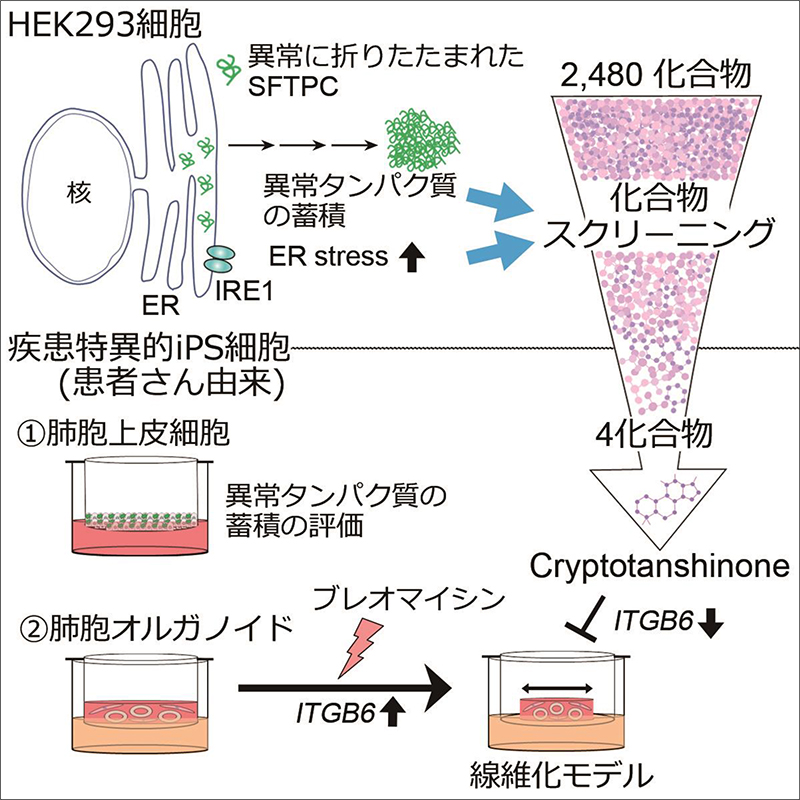
間質性肺炎は、運動時の息切れや空咳といった症状から始まる進行性の病気です。間質性肺炎の発症には、呼吸機能を担う肺胞上皮細胞注1)が繰り返し傷害を受けることによって傷の修復を担う線維芽細胞注2)が異常に活性化し、肺胞の壁が固くなって肺が収縮してしまうことが知られています。間質性肺炎には、線維芽細胞を標的とし病気の進行を抑える薬はありますが、肺胞上皮細胞を標的とした薬はまだありません。そこで、まずは原因遺伝子が同定されている間質性肺炎において、創薬を進め、その知見を基に新規病態解明及び臨床応用可能な薬の取得を目指すことしました。肺のサーファクタント注3)タンパク質をコードするSFTPC遺伝子の変異(バリアント)は間質性肺炎を引き起こすことが知られています。病的なバリアントを持つSFTPCタンパク質が異常に折りたたまれることで、ERストレス注4)やタンパク質凝集体が生じて肺胞上皮細胞を障害すると報告されています(Mulugeta et al., 2015)。そこで、この表現型を指標として、機能既知の化合物ライブラリーを用いて治療薬スクリーニングを行い、患者由来iPS細胞から作成した肺胞上皮細胞や肺胞オルガノイド注5)を使用した薬効評価系を確立しました。
3. 研究手法・成果
まず、病的バリアントとして知られるSFTPCタンパク質に起因するERストレスや異常タンパク質の蓄積を指標としたハイスループットスクリーニングを行いました。次に少数に絞った化合物を患者さんの協力を得て樹立したiPS細胞から分化誘導した肺胞上皮細胞で評価し、さらに肺の線維芽細胞と一緒に培養して作成した肺胞オルガノイドを用いて、先行研究で報告した線維化モデルの手法(Suezawa et al., 2021)により薬効を評価しました。
i. 1次スクリーニング
ERストレスを定量的に評価できるレポーター遺伝子をプラスミドとして人工的に合成し、大きなERストレスを引き起こすことの知られていたSFTPCバリアントLeu188Gln(L188Q)(Lawson et al., 2011)を強制的に発現するプラスミドと共にHEK293細胞に遺伝子導入を行い、SFTPCバリアントに起因するERストレスを減らすことのできる化合物を探索しました。化合物そのものの毒性も同時に評価し、2480化合物から65化合物まで候補を絞り込みました。
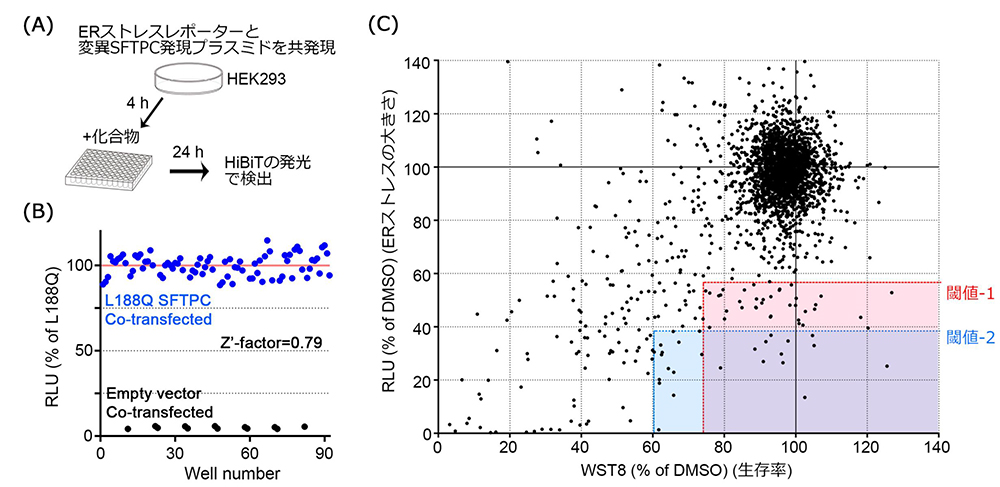
図1:1次スクリーニング
(A) スクリーニング方法の概要
(B) スクリーニング方法の検証(バリデーション)
(C) SFTPCバリアントに起因するERストレスと生存率を指標とした2,480化合物のスクリーニング
ii. 2次スクリーニング
1次スクリーニングで使用したバリアントから、Tyr104His(Y104H)バリアントに変更し、以下の2つの視点で化合物を絞り込みました。1つ目はL188Qとは異なるSFTPCバリアントでもERストレスを減少させることができるか、2つ目はY104Hバリアントを持ったSFTPCが形成するタンパク質凝集体を改善できるかという点です。タンパク質凝集体の評価は多数の化合物を高速にスクリーニングできるように、GFPとSFTPCの融合遺伝子を用いて、タンパク質凝集体を可視化し、高速かつ正確に画像情報から定量を行うことのできる装置(Opera Phenix)で評価を行い、さらに化合物を絞り込みました。
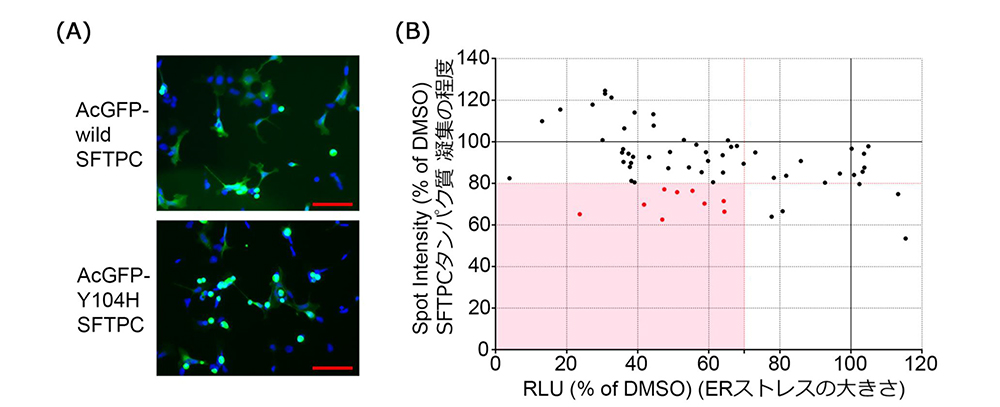 図2:2次スクリーニング
図2:2次スクリーニング
(A) SFTPC-GFP融合遺伝子の発現によるタンパク質凝集体の代表的な写真
(B) iPS細胞と対応するSFTPCのY104Hバリアントに起因するERストレスとタンパク質凝集体に対する化合物の評価
iii. iPS細胞を用いた化合物評価
絞り込んだ化合物がより生理的な条件で効果を示すかを確認するために、Tyr104His(Y104H)バリアントをもつ患者さんから樹立したiPS細胞を肺胞上皮細胞に分化誘導しました。タンパク質凝集体を評価して、Cryptotanshinone(CPT)を同定しました。
さらに、CPTが線維化の表現型を改善できるか確認するために患者さん由来のiPS細胞から肺胞オルガノイドを用いて、線維化のモデル系であるゲル収縮アッセイを行いました。このアッセイは肺胞上皮細胞と線維芽細胞を共培養することで、肺胞上皮が障害を受けると線維芽細胞が活性化して、それにより培養に用いたゲル全体が収縮することを指標にしています。SFTPCの1アミノ酸が置換されるバリアントの一部は成人発症の間質性肺炎をもたらすことがこれまでの研究により明らかとなっており(Ono et al., 2011)、遺伝的素因に加えて、ウイルス感染や薬剤によるの「セカンドヒット」が発症に関与すると考えられています。本研究ではブレオマイシン(BLM)注6)をセカンドヒットとして用いてII型肺胞上皮細胞を障害し、患者さん由来のiPS細胞を使って肺線維症を培養皿内に再現しました。そして、CPTは上皮障害を軽減することで、ゲル収縮を改善することを示しました。しかし、同じ遺伝子バリアントを持ったモデル動物や患者さんの間質性肺炎に対するCPTの薬効を明らかにできていないため、今後も引き続き、様々な視点からの薬効評価やさらなる治療薬候補化合物の同定を進めていく必要があります。患者さん由来のiPS細胞を用いた、薬効評価の試みは疾患モデルの限られた間質性肺炎の治療薬開発に有用であり、優れたヒト由来細胞による疾患モデルとして今後の創薬に役立つことが期待されます。
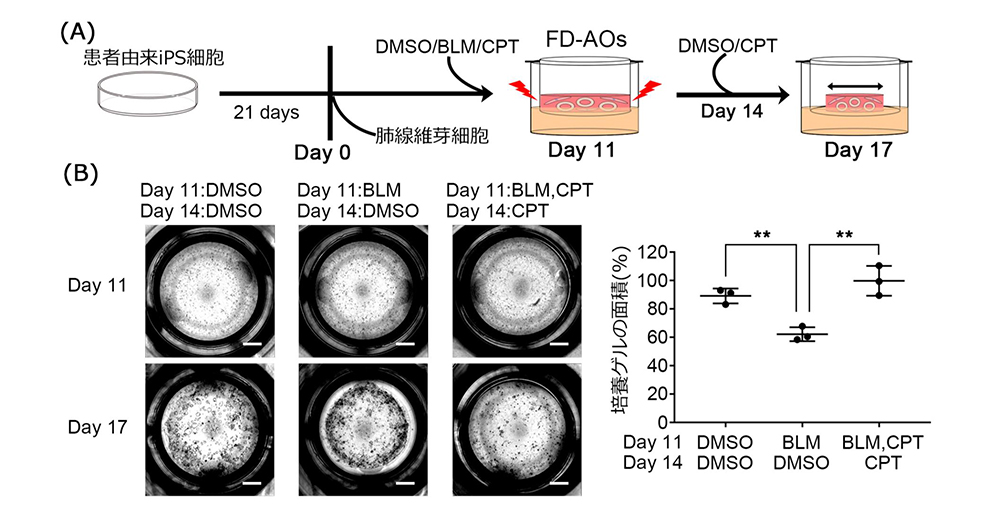 図3:iPS細胞による化合物の薬効評価
図3:iPS細胞による化合物の薬効評価
(A) 実験系の概略図
(B) 肺胞オルガノイドによるゲル収縮アッセイ(線維化モデル)による化合物の薬効評価
4. 波及効果、今後の予定
本研究では培養細胞を用いた化合物スクリーニングから疾患特異的iPS細胞を用いた薬効評価までの一連の化合物評価システムにより、遺伝性間質性肺炎における肺胞上皮細胞の障害を指標とする化合物探索が可能になり、今回の研究成果につながりました。今後は、今回同定されたCPTの薬効を動物モデル等の別の角度からも検証し、間質性肺炎の発症メカニズムをより詳しく解析し、新しい治療手段の開発に役立てていきたいです。
5. 論文名と著者
- 論文名
Cryptotanshinone is a candidate therapeutic agent for interstitial lung disease associated with a BRICHOS-domain mutation of SFTPC
(CryptotanshinoneはSFTPCのBRICHOSドメイン変異に関連する間質性肺炎に対する治療薬候補である) - ジャーナル名
iScience - 著者
Motoyasu Hosokawa, Ryuta Mikawa, Atsuko Hagiwara, Yukiko Okuno, Tomonari Awaya, Yuki Yamamoto, Senye Takahashi, Haruka Yamaki, Mitsujiro Osawa, Yasuhiro Setoguchi, Megumu K. Saito, Shinji Abe, Toyohiro Hirai, Shimpei Gotoh, Masatoshi Hagiwara
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構 再生医療実現拠点ネットワークプログラム
疾患特異的iPS細胞の利活用促進・難病研究加速プログラム
「ヒトiPS細胞を用いた呼吸器難病の病態機序の解明と新規創薬基盤の確立」
幹細胞・再生医学イノベーション創出プログラム
「多能性幹細胞を用いたヒト由来肺組織シミュレーターの創出」 - 日本医療研究開発機構 再生・細胞医療・遺伝子治療実現加速化プログラム
疾患特異的iPS細胞を用いた病態解明・創薬研究課題事業
「疾患特異的iPS細胞を用いた病態機序解析による特発性間質性肺炎の層別化と創薬システムの開発」 - 日本医療研究開発機構 生命科学・創薬研究支援基盤事業(BINDS)
「産学連携により臨床試験を目指すワンストップ創薬支援」 - 日本学術振興会・文部科学省 科学研究費補助金
- 京都大学基金 iPS細胞研究基金
7. 用語説明
注1)肺胞上皮細胞
呼吸時の酸素の取り込みを担う肺胞の表面に存在する細胞。1型肺胞上皮細胞は、扁平な構造をとることで、効率よく酸素を取りこむことができる。2型肺胞上皮細胞は、肺サーファクタントを分泌することで呼吸時の肺胞構造の維持を行う役割と、組織幹細胞(自己増殖能と1型肺胞上皮細胞への分化能を持つ細胞)としての役割がある。
注2)線維芽細胞
様々な臓器において結合組織を構成する細胞の一つ。間質性肺炎においては、異常に活性化した線維芽細胞がコラーゲンを大量に分泌することによって、肺胞の壁が固くなり肺が収縮すると考えられている。
注3)サーファクタント
肺胞の空気に接する側に分泌されている界面活性成分。肺胞は内側に縮んで空気を押し出す方向に力がかかっている。サーファクタントはその力を和らげ、空気を肺胞内に取り込みやすくしている。脂質やタンパク質などから構成されている。
注4)ERストレス(小胞体ストレス)
タンパク質が作られる場である小胞体(ER: Endoplasmic Reticulum)に、正常に作られなかったタンパク質が蓄積することによって引き起こされる現象のこと。パーキンソン病やアルツハイマー病をはじめ、様々な疾患に関与することが知られている。
注5)オルガノイド
培養皿の中で幹細胞からつくられた臓器に似た立体構造体。様々な種類の細胞から構成されており、「ミニ臓器」とも呼ばれる。
注6)ブレオマイシン
ヒトのがん治療に用いられる薬剤。副作用として間質性肺炎を示します。肺組織の幹細胞であるII型肺胞上皮細胞を障害することから、動物や培養細胞で間質性肺炎を再現するための薬剤として用いられます。
<後藤教授のコメント>
これまでに上皮障害を標的とした間質性肺炎の治療薬がなかった理由は、候補化合物を薬効評価するのに適した方法がなかったためと考えています。今回、疾患と同様の機序による化合物評価をハイスループットな方法で確立できたこと、患者さん由来のiPS細胞を用いて薬効を評価できるようになったことは今後の治療薬開発に大きく貢献できると思います。間質性肺炎は様々なタイプに分かれており、遺伝的素因だけでなく、感染や薬剤などの外部からの誘発因子が、ケースバイケースで発症や病態の増悪に関与しています。私たちは今回、その中の一つの病因としてSFTPCというサーファクタントタンパク質のBRICHOSと呼ばれるドメインに生じたバリアントに注目して、スクリーニングシステムを開発して、今回の研究成果に至りました。これまで間質性肺炎の治療薬候補の薬効評価に患者さん由来のiPS細胞の有用性を明らかにした例がありませんでしたので、今回の成果は今後の治療薬開発においても大きなマイルストーンになったと実感しています。CPTを臨床応用するにはまだ慎重に検討していく必要がありますが、今回の成果をもとにさらに解析を続けていきます。
<参考文献>
1. Lawson, W.E., Cheng, D.S., Degryse, A.L., Tanjore, H., Polosukhin, V.V., Xu, X.C., Newcomb, D.C., Jones, B.R., Roldan, J., Lane, K.B., et al. (2011). Endoplasmic reticulum stress enhances fibrotic remodeling in the lungs. Proceedings of the National Academy of Sciences of the United States of America 108, 10562-10567.
2. Mulugeta, S., Nureki, S., and Beers, M.F. (2015). Lost after translation: insights from pulmonary surfactant for understanding the role of alveolar epithelial dysfunction and cellular quality control in fibrotic lung disease. Am J Physiol Lung Cell Mol Physiol 309, L507-525.
3. Ono, S., Tanaka, T., Ishida, M., Kinoshita, A., Fukuoka, J., Takaki, M., Sakamoto, N., Ishimatsu, Y., Kohno, S., Hayashi, T., et al. (2011). Surfactant protein C G100S mutation causes familial pulmonary fibrosis in Japanese kindred. Eur Respir J 38, 861-869.
4. Suezawa, T., Kanagaki, S., Moriguchi, K., Masui, A., Nakao, K., Toyomoto, M., Tamai, K., Mikawa, R., Hirai, T., Murakami, K., et al. (2021). Disease modeling of pulmonary fibrosis using human pluripotent stem cell-derived alveolar organoids. Stem Cell Reports 16, 2973-2987.