2023-12-18 インペリアル・カレッジ・ロンドン(ICL)
◆イギリスのインペリアル・カレッジ・ロンドンのMarco Di Antonio博士率いるチームは、ALSにおける凝集体形成の新しいメカニズムを探求し、異常な形態のRNAがこれに重要な役割を果たす可能性を見出しました。これにより、これらのRNA構造を標的とする新しい薬剤の開発が期待され、関連する神経変性疾患において同様の要因を探索する可能性が示唆されています。研究はNature Communications誌に掲載されました。
<関連情報>
- https://www.imperial.ac.uk/news/250293/unusual-rna-structures-could-targets-als/
- https://www.nature.com/articles/s41467-023-43872-1
ALS/FTDに関連するC9orf72ヘキサヌクレオチド反復拡大は、多分子のG-四重鎖を通してRNA凝縮体を形成する。 The ALS/FTD-related C9orf72 hexanucleotide repeat expansion forms RNA condensates through multimolecular G-quadruplexes
Federica Raguseo,Yiran Wang,Jessica Li,Marija Petrić Howe,Rubika Balendra,Anouk Huyghebaert,Devkee M. Vadukul,Diana A. Tanase,Thomas E. Maher,Layla Malouf,Roger Rubio-Sánchez,Francesco A. Aprile,Yuval Elani,Rickie Patani,Lorenzo Di Michele & Marco Di Antonio
Nature Communications Published:13 December 2023
DOI:https://doi.org/10.1038/s41467-023-43872-1
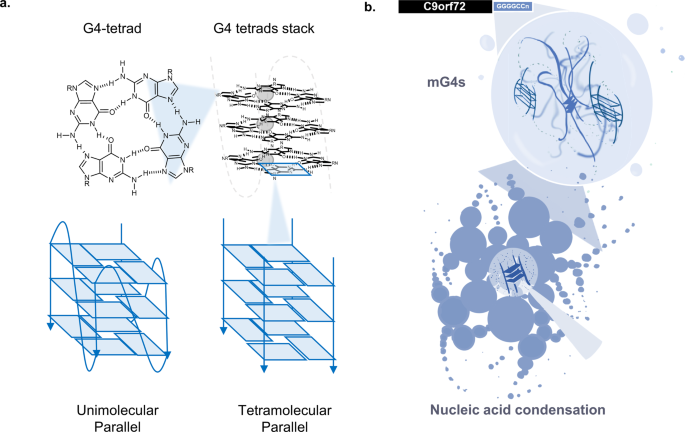
Abstract
Amyotrophic lateral sclerosis (ALS) and frontotemporal dementia (FTD) are neurodegenerative diseases that exist on a clinico-pathogenetic spectrum, designated ALS/FTD. The most common genetic cause of ALS/FTD is expansion of the intronic hexanucleotide repeat (GGGGCC)n in C9orf72. Here, we investigate the formation of nucleic acid secondary structures in these expansion repeats, and their role in generating condensates characteristic of ALS/FTD. We observe significant aggregation of the hexanucleotide sequence (GGGGCC)n, which we associate to the formation of multimolecular G-quadruplexes (mG4s) by using a range of biophysical techniques. Exposing the condensates to G4-unfolding conditions leads to prompt disassembly, highlighting the key role of mG4-formation in the condensation process. We further validate the biological relevance of our findings by detecting an increased prevalence of G4-structures in C9orf72 mutant human motor neurons when compared to healthy motor neurons by staining with a G4-selective fluorescent probe, revealing signal in putative condensates. Our findings strongly suggest that RNA G-rich repetitive sequences can form protein-free condensates sustained by multimolecular G-quadruplexes, highlighting their potential relevance as therapeutic targets for C9orf72 mutation-related ALS/FTD.


