2023-12-25 国立がん研究センター
発表のポイント
- 国内最大規模となる287症例を対象に、腎細胞がんの全ゲノム解析・遺伝子発現解析・エピゲノム解析を行いました。
- 腎細胞がんは、細胞の形態から様々なタイプ(組織型)に分けられます。腎臓がんで症例数の多い3つのタイプのそれぞれで、がんの発生や進行を制御する鍵となる重要な遺伝子を同定しました。
- 全ゲノム解析により、腎細胞がんの組織型ごとに発がん要因が異なることを明らかにしました。
- 解析の結果、腎細胞がんで最も多いタイプの中には、特殊な免疫環境を形成し、術後早期に再発する群があることを突き止めました。
- 今回の腎細胞がんの分子レベルでのより詳細な解析が今後の研究の基礎となり、診断・治療開発や予後の改善に貢献すると期待されます。
概要
国立研究開発法人国立がん研究センター (理事長:中釜 斉、東京都中央区) 研究所(所長:間野博行) がんゲノミクス研究分野分野長 柴田龍弘らの研究チームは、国内最大規模となる日本人の腎細胞がん287症例の全ゲノムとエピゲノムの統合解析を行いました。日本において、腎細胞がんは年々増加傾向にあります。先行研究により、生活習慣病や喫煙が重要な発症リスクであることが知られていますが、発がんリスクを上昇させる分子機序については明らかにされていません。本研究では、その分子機序について大きく3つの成果を得ることができました。
第1に、症例数の多い3つの腎細胞がんのタイプのそれぞれで、がんの発生や進展を制御する重要な転写因子を同定しました。
第2に、タイプごとに発がん要因が異なることを示しました。
第3に、腎細胞がんで約70%を占めるタイプの淡明細胞型腎細胞がんの中には、特殊な免疫環境を形成し、そのために早期再発しやすい群があることを突き止めました。
今回得られた一連の成果は、日本人腎細胞がんの分子レベルの理解を深め、今後の日本における腎細胞がんの治療法開発や予後改善に貢献することが期待されます。
本研究成果は、英国科学雑誌「Nature Communications」に、英国時間2023年12月16日(日本時間2023年12月17日)付で掲載されました。
背景
腎がん(腎細胞がん)の特徴
腎がんは、腎実質の細胞ががん化して悪性腫瘍になった腎細胞がんと、尿が集まる腎盂(じんう)ががん化した腎盂がんに分けられます。腎がんは、これまでの疫学研究で、欧米型食生活や運動不足等に伴う生活習慣病(肥満・高血圧・糖尿病等)や喫煙が重要な発症リスクであることが知られており、日本においても年々増加しています。また、治療においては、過去の知見から、免疫をターゲットにした治療が有効である可能性が知られていました。しかし、近年では、腎がんに対しての有効な免疫チェックポイント阻害薬が登場し、さらに血管新生を抑制する新しい治療薬なども開発されるなど、その治療体系は大きな過渡期を迎えています。
以上の事から、腎がん(腎細胞がん)の発症メカニズムや分子機序、発がんリスクを上昇させる要因の究明が急がれていました。
腎細胞がんのタイプ(組織型)とこれまでのゲノム解析研究
腎細胞がんは、発生の元となる細胞と、その細胞形態像(病理組織像)により、様々な組織型に分類されます。中でも症例数の多い組織型には、淡明細胞型(腎細胞がん全体の約70%)、乳頭状(約20%)、嫌色素性(約5%)があります。先行研究により、これらの組織型ごとに、臨床経過や化学療法などの治療効果が異なることが報告されていますが,それぞれの組織型の分子レベルでの特徴についてはまだ十分に解明されておらず、全ゲノム解析研究などの詳細な研究が求められています。
国外においては、すでに100症例規模の全ゲノム解析研究が行われていますが、日本では人口あたりの患者数が比較的少ないことなどから、十分な解析が行われてきませんでした。よって、日本人症例を対象とした大規模な全ゲノム解析研究、データの蓄積とその解析による病態の解明が望まれています。
研究方法
日本人腎細胞がん287症例(淡明細胞型、乳頭状、嫌色素性)を対象に、全ゲノム解析(注1)、トランスクリプトーム解析(注2)、エピゲノム解析(注3)を行い、得られたデータを利用して統合的な解析を行いました。エピゲノム解析は、ATACシークエンスを72症例、メチル化解析を64症例行いました。
| 全ゲノム解析 | トランスクリプトーム解析 | エピゲノム解析 | |
| ATACシークエンス | メチル化シークエンス | ||
| 128症例 | 287症例 | 72症例(注) | 64症例 |
注:品質の問題で最終的に66症例の解析を行いました。
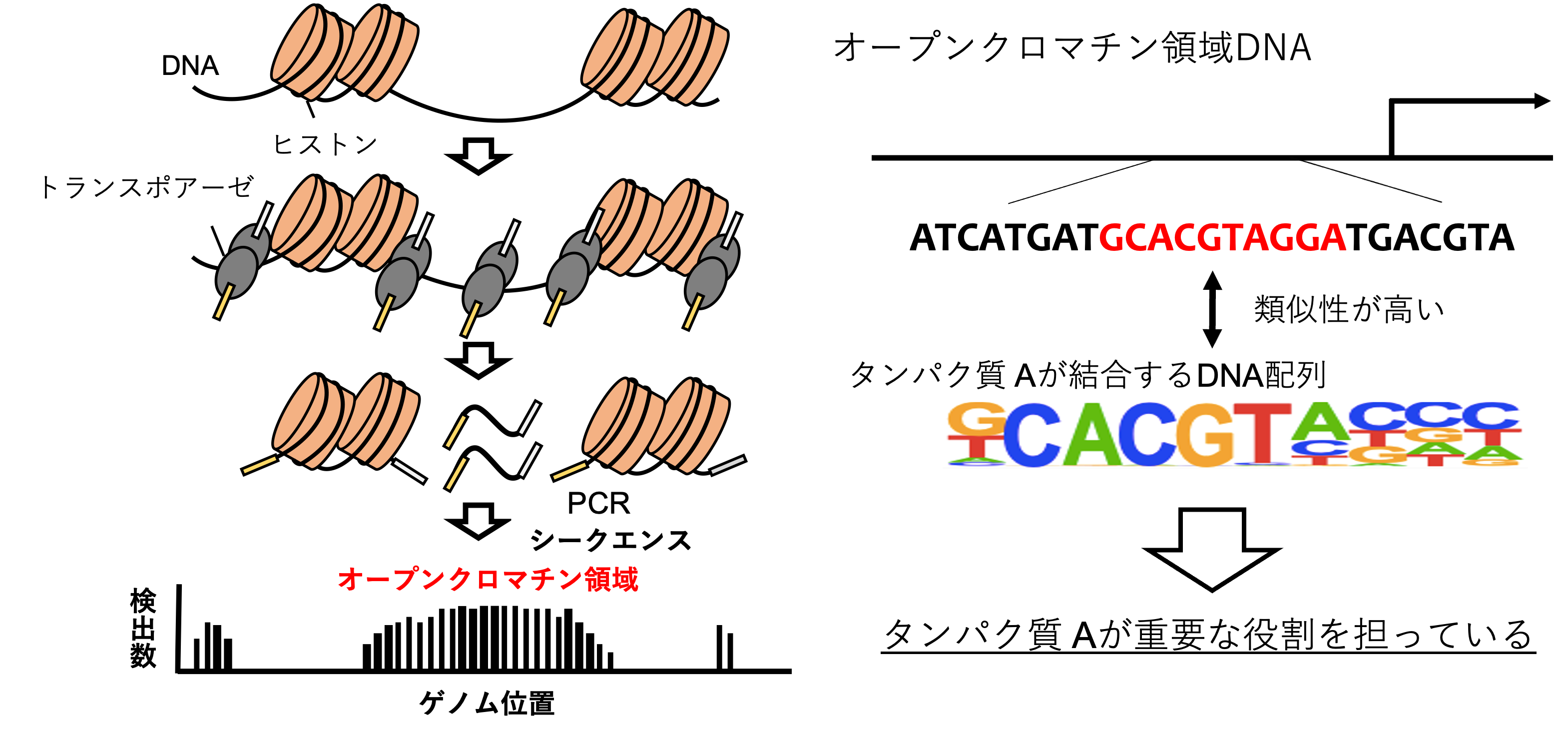
ATACシークエンスとは
エピゲノム解析が進んだことで、ゲノムの異常だけでなくエピゲノムの異常もまた、がんの発生や進展に大きく関与するとわかっています。ATACシークエンスはエピゲノム解析の一つで、次世代シークエンス技術を用いてゲノム上で遺伝子の発現が活発な(転写活性が高い)領域(オープンクロマチン領域)を検出することができます(図1)。検出したオープンクロマチン領域に高頻度に見られる特定のDNA配列(モチーフ配列(注4))を調べることで、どんな遺伝子ががん細胞における遺伝子発現調節に関与しており、がんの発生や進行に重要な役割を担っているのかについて推測することができます。
研究結果
淡明細胞型腎細胞がんはさらに3群に分けられ、うち1群は予後の悪いタイプ
遺伝子の発現を制御する分子は転写因子と呼ばれ、転写因子ごとにDNAのモチーフ配列に結合してその下流にある標的遺伝子の発現を誘導しています。転写因子がDNAに結合しやすくなっている領域はオープンクロマチン領域と呼ばれ、がん細胞におけるオープンクロマチン領域にどんな種類のモチーフ配列が多いのか(特定のモチーフ配列が濃縮しているのか)を調べることで、がん細胞において中心的に働いている転写因子(マスター転写因子)を予測することができます(図1)。今回腎細胞がんにおけるマスター転写因子を調べた結果、淡明細胞型腎細胞がんは、以下の3つのグループに分けられるとわかりました。
- 免疫関連遺伝子を制御しているマスター転写因子の濃縮が見られる群(図2の2)
- 低酸素状態に関連する遺伝子を制御しているマスター転写因子の濃縮が見られる群(図2の3)
- どちらのモチーフの濃縮も見られない群(図2の1)
また、免疫関連遺伝子を制御しているマスター転写因子の濃縮が見られる群(1.の群)の腫瘍組織で詳細な遺伝子発現並びに免疫組織化学的な解析をした結果、宿主免疫からの攻撃を弱める働きのあるPD-1(注5)分子 を発現する免疫細胞の浸潤が多く認められました(図2の下左の病理像2)。2群は他のグループに比べて再発リスクが高く(図2 下右)、免疫環境が弱まっていることがその原因の一つである可能性が考えられます。
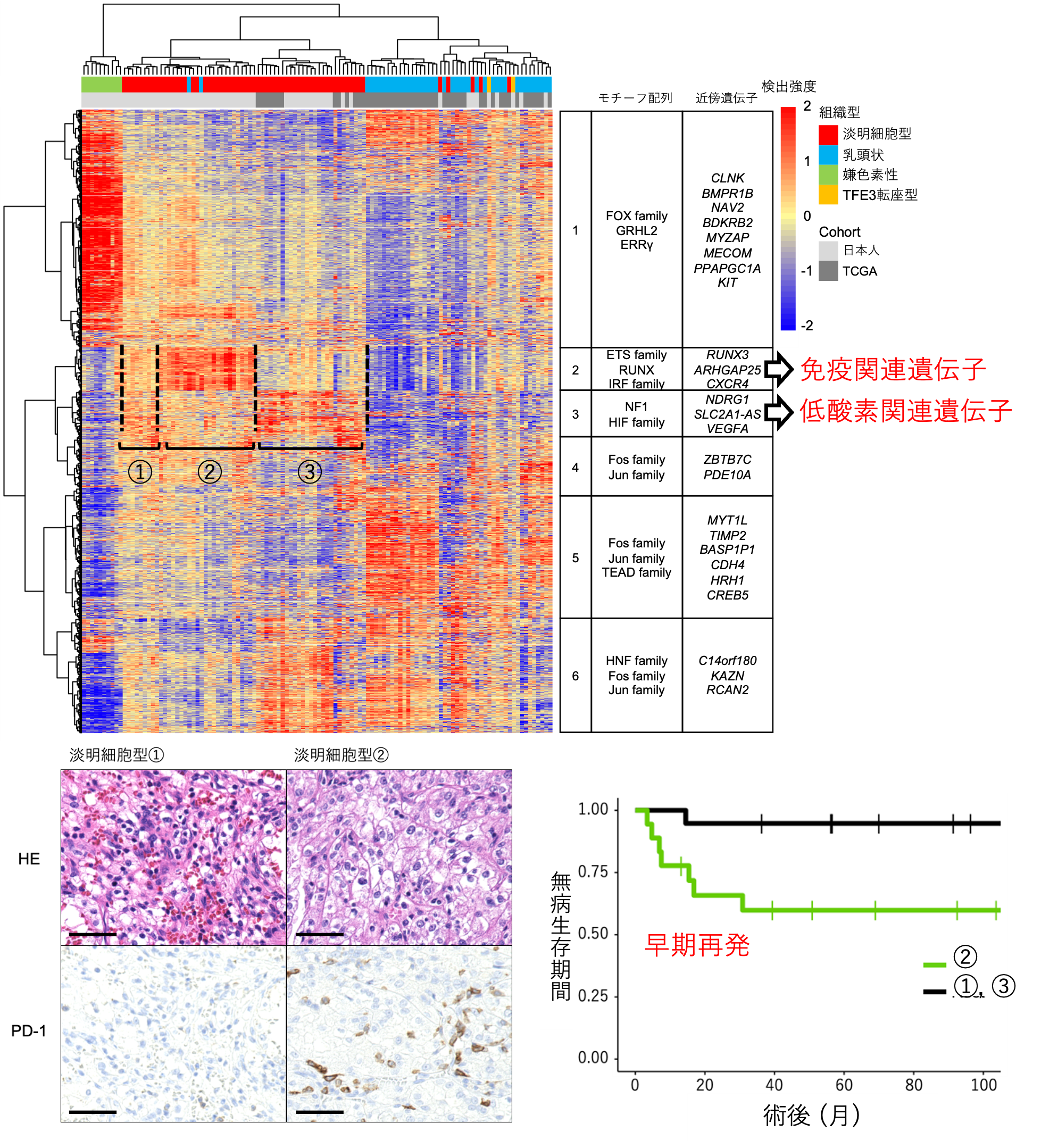
図2. ATACシークエンスで同定された淡明型腎細胞がんの特徴
嫌色素性腎細胞がんで重要だと推定される新規遺伝子を同定
更に他の組織型についてもマスター転写因子を抽出したところ、組織型によってマスター転写因子が全く異なることがわかりました。中でも嫌色素性腎細胞がんではGRHL2, ERRγの2遺伝子が重要であることが初めて解明されました(図3)。今回得られた成果は、各組織型の分子レベルの特徴を理解する上で重要であり、新たな治療戦略の確立につながるものと期待できます。

図3. ATACシークエンスによる各組織型のマスター転写因子の同定
腎細胞がんの組織型ごとに発がん要因が違うことを初めて解明
喫煙や紫外線などの発がん因子は、DNAに特徴的な遺伝子変異のパターン(変異シグネチャー(注6))を引き起こすことが知られています。全ゲノム解析から得られた変異データを基にがん細胞に生じた変異シグネチャーを解析することで、そのがんの発生要因を推定することが可能になります。今回の日本人腎細胞がんの全ゲノム解析により、組織型ごとに変異シグネチャーが異なることが示されました(図4)。例えば、近位尿細管から発生するとされる淡明細胞型と乳頭状腎細胞がんは、遠位ネフロンから発生するとされる嫌色素性腎細胞がんとは異なる変異シグネチャーを示すことから、それぞれ異なった発がん要因によってがん化することが示されました。具体的には、淡明細胞型、乳頭状腎細胞がんではSBS5(原因不明)、SBS107(タバコによる変異パターンと類似)、SBS125(原因不明)、とよばれる変異シグネチャーの寄与が大きく、一方で嫌色素性腎細胞がんではこれらの寄与がほとんど見られないことがわかりました。
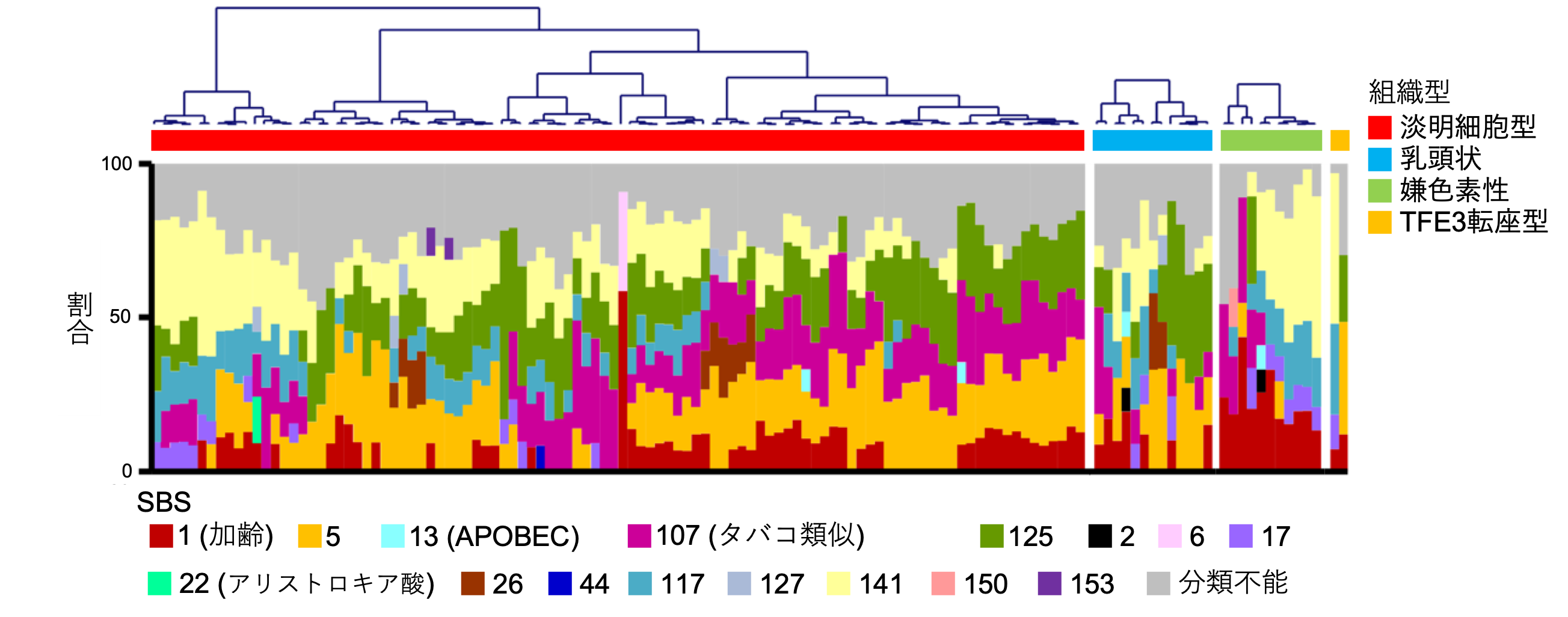
図4. 各組織型における変異シグネチャー解析
展望
日本人における腎細胞がんの症例数は年々増加し、欧米における罹患者数に近づいています。その背景には、肥満や高血圧といった生活習慣病が関連していると推定されていますが、その具体的な分子メカニズムは未解明です。今回の研究では日本人腎細胞がんにおけるゲノム異常のパターン(変異シグネチャー)を初めて明らかにしましたが、生活習慣病との明らかな関連は見られず、どのように腎臓がんの発症につながるのかについてはさらなる研究が必要です。一方で各組織型には特徴的な発がん要因があること、また働いているマスター転写因子が異なっていることなど、新たな分子特徴について明らかにできました。
これまで、諸外国では腎細胞がんの全ゲノム解析研究が盛んに行われてきましたが、日本人における研究は限られており、泌尿器科領域がんにおけるゲノム医療の精度を上げるためには日本人症例のデータの集積が求められています。今回の成果は、日本における腎細胞がんの新たな診断・治療法開発や予後改善に貢献すると期待できます。
発表論文
雑誌名: Nature communications
タイトル:Genetic and epigenetic integrative subtypes of renal cell carcinoma in a Japanese cohort
著者: Akihiko Fukagawa, Natsuko Hama, Yasushi Totoki, Hiromi Nakamura, Yasuhito Arai, Mihoko Saito-Adachi, Akiko Maeshima, Yoshiyuki Matsui, Shinichi Yachida, Tetsuo Ushiku, Tatsuhiro Shibata
掲載日:2023年12月16日(日本時間2023年12月17日)付
DOI:10.1038/s41467-023-44159-1
URL:https://www.nature.com/articles/s41467-023-44159-1(外部サイトにリンクします)
研究費
- 革新的がん医療実用化研究事業(国立研究開発法人日本医療研究開発機構)
国際共同研究に資する大規模日本人がんゲノム・オミックス・臨床データ統合解析とゲノム予防・医療推進 - 国立がん研究センターがん研究開発費(2020-A7)
用語解説
(注1)全ゲノム解析
次世代シークエンサーを使って、がんの全ゲノム情報を解読し、塩基配列の違いや変化を同定すること。タンパク質をコードする領域だけでなく、遺伝子の発現を制御するゲノム領域の変異や様々な構造異常(大きなゲノム配列異常)も検出可能である。
(注2)トランスクリプトーム解析
細胞や組織で発現している遺伝子情報全体をトランスクリプトームと呼ぶ。最近では次世代シークエンス技術を用いたRNAシークエンスによって、発現している遺伝子全体の情報を調べることができる。
(注3)エピゲノム解析
DNAの塩基配列を変えることなく、DNAやDNAに結合する分子の化学的修飾によって遺伝子の発現を決める情報の集まりをエピゲノムと呼ぶ。例えば受精卵から体を形作る多様な細胞が生まれる過程ではDNAの配列には変化がありませんが、DNAの状態が変化することで多様な遺伝子の発現が制御されている。こうしたDNAの状態を調べる解析をエピゲノム解析と呼ぶ。
(注4)モチーフ配列
遺伝子の発現を制御する分子は転写因子と呼ばれ、転写因子ごとにDNAの特定の塩基配列に結合してその下流にある標的遺伝子の発現を誘導している。そうした配列をモチーフ配列と呼ぶ。
(注5)PD-1
突然変異などのゲノム異常によって作られた異常なタンパク質は、宿主免疫細胞からは異物として認識されるため、がん細胞は生存するために免疫細胞からの攻撃を回避する必要がある。PD-1はこうした免疫回避において重要な免疫チェックポイント分子の一つであり、がん細胞が持っているPD-L1と結合することでT細胞の活性化を抑制している。近年このPD-1/PD-L1を抗体によって阻害する治療薬(免疫チェックポイント阻害薬)が、多くのがんの治療に広く用いられている。
(注6)変異シグネチャー
がん細胞のゲノムに発生する様々な変異には、その要因によって異なったパターンを示すことが知られており、そうしたパターンを変異シグネチャーと呼ぶ。これまでヒトのがんにおいては100種類以上のパターンがあることが知られており、そのうち約3分の1はゲノム修復の異常、約3分の1は環境要因によるものであることが判明しているが、残り3分の1は未だ原因不明である。がんゲノムにおける変異シグネチャーを調べることで、そのがんの発生原因を推定することもできる。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター研究所
がんゲノミクス分野 分野長 柴田龍弘
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室