2024-03-20 理化学研究所
理化学研究所(理研)生命機能科学研究センター 動的恒常性研究チームのユ・サガン チームリーダー(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員)、ウーウルジャン・サクズル 研究パートタイマーⅡ(研修生)らの研究チームは、ショウジョウバエ[1]を糖代謝[2]研究の個体モデルとして、細胞内のガラクトース[3]を計測するバイオセンサーを開発しました。
本研究成果は、生物個体における1細胞レベルでのガラクトースの計測を可能にすると同時に、ガラクトースとともに細胞内に流入するグルコース[3]の測定技術や、糖尿病などの代謝疾患に対する新規薬剤スクリーニングなどの研究開発に波及効果があると期待されます。
ガラクトースはグルコースとともにさまざまな生物の栄養源となっています。しかし細胞内のガラクトースを計測する方法が限られていることから、その代謝には不明な点が多く残されています。今回、研究チームは、酵母細胞に元々備わっているガラクトース感知機構を遺伝子レベルでショウジョウバエに組み入れ、ショウジョウバエ個体において1細胞レベルでガラクトースの量を計測するバイオセンサー「GALDAR[4]」を開発しました。GALDARを用いてショウジョウバエのさまざまな組織の糖代謝を解析したところ、腸の恒常性維持に重要な役割を果たす腸幹細胞[5]がガラクトースやグルコースを取り込まないことも発見しました。
本研究は、科学雑誌『PLOS Biology』オンライン版(3月19日付:日本時間3月20日)に掲載されました。
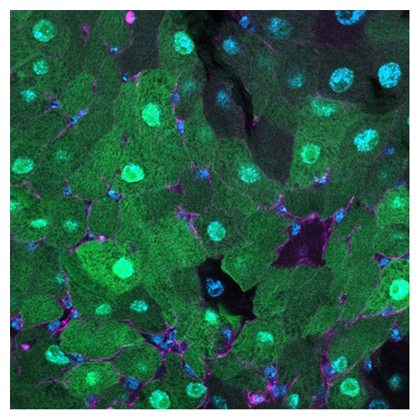
GALDARが検出した1細胞レベルのガラクトースシグナル(緑)
背景
糖の持つエネルギーを消費・蓄積する糖代謝は、生物にとって非常に重要な代謝反応です。糖代謝で最も基本的な単糖はグルコース(ブドウ糖)ですが、ガラクトースやフルクトース(果糖)といった他の単糖も利用されます。ガラクトースは母乳に含まれるラクトース(乳糖)から作られる単糖で、ヒトを含む哺乳類の生育に重要な働きを持ちます。ガラクトースの先天性代謝異常症(ガラクトース血症[6])は新生児に重篤な症状を引き起こす可能性があるため、ガラクトース代謝異常の有無が新生児のマススクリーニングで調べられます。
ガラクトースは、哺乳類以外の細菌や酵母、昆虫といった生物も栄養源として使うことから、医学的にも生物学的にも重要な糖です。その重要性にもかかわらず、細胞内のガラクトースの代謝については、グルコースに比べて十分に理解が進んでいません。その理由は二つあります。一つは、ガラクトースも最終的にはグルコースの代謝経路に入っていくことから、これまで多くの研究でグルコースに焦点が当てられてきました。もう一つは、ガラクトースを細胞内で計測するツールの不足です。
細胞内の分子やイオンの挙動を、蛍光強度などに変換して測定するツールはバイオセンサーと呼ばれます。グルコースのバイオセンサーは世の中に複数種類存在しますが、ガラクトースのバイオセンサーは存在しません。そこで研究チームは、動物個体におけるガラクトースの挙動を検出するためのバイオセンサーの開発に挑みました。
研究手法と成果
研究チームは、ガラクトースのバイオセンサーを作るために、酵母に備わっているガラクトースの感知機構(Galシステム)に着目しました。通常酵母はグルコースを優先的に代謝しますが、ガラクトースを含む培地で生育させると、ガラクトースを代謝する酵素遺伝子の発現が誘導されます。これは、ガラクトースが細胞膜上のトランスポーター[7]を通って酵母細胞の中に入ると、Gal3[8]というタンパク質と結合し、転写因子であるGal4[8]と複合体を形成していた阻害因子Gal80[8]を解離させ、Gal4の抑制状態を解除するためです。Gal4は、標的遺伝子の上流活性化配列(UAS)[9]への結合を介して遺伝子発現を誘導します(図1)。
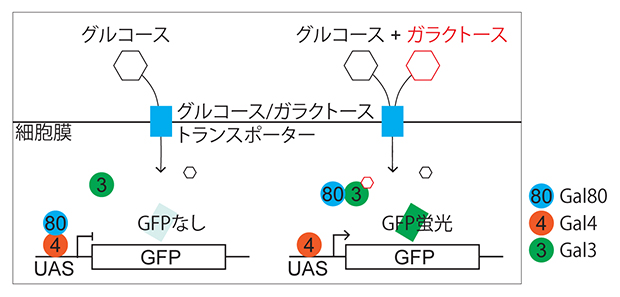
図1 ガラクトースを感知する酵母のGalシステム
ガラクトースがない状況(左)では、Gal80がGal4に結合してGal4の転写活性化能を阻害し、UASの下流で転写される遺伝子(実際の酵母細胞ではガラクトース代謝に関わる遺伝子だが、ここではレポーターとしてGFP遺伝子を挿入している)が発現しない。ガラクトース存在下(右)では、ガラクトースが細胞内にトランスポーターを通って流入し、Gal3に結合することで、Gal80によるGal4の阻害を解除し、UASの下流遺伝子の発現が誘導される。
この酵母のガラクトース感知システムを遺伝子組換え技術を用いてショウジョウバエに導入することで、ショウジョウバエ個体内においてガラクトースを感知するシステムを作り、これをGALDAR1/2と命名しました(1と2の違いは、Gal4やGal3の発現量の調節に関わる設計思想の差で、実質的な違いはありません)。GALDAR1/2を持ったショウジョウバエにガラクトースを食べさせると、GFPという蛍光タンパク質が光る仕組みになっています。実際に、GALDAR1/2を持ったショウジョウバエにガラクトースを食べさせると、設計した通り緑色に光り、GALDAR1/2がショウジョウバエ個体内でガラクトースのバイオセンサーとして機能することが分かりました(図2)。

図2 GALDARを持ったショウジョウバエ
GALDARを持ったショウジョウバエにガラクトースを含まない餌を食べさせるとGALDARは光らない(左)が、ガラクトースを食べさせるとGALDARが緑色に光り始める(右)。この図は暗視野での蛍光観察像であるため、ショウジョウバエ個体の輪郭を線で示した。
研究チームは、GALDAR1/2を用いて、さまざまな組織のガラクトースを測定しました。興味深い発見として、研究チームがこれまで研究してきた腸幹細胞において注1、2)、ガラクトースを取り込まないことが分かりました(図3)。ガラクトースとグルコースは同じトランスポーターを通って細胞膜を通過するため(図1)、腸幹細胞はグルコースも取り込んでいない可能性が考えられます。そこで、特殊な試薬を用いてグルコースの取り込みを計測したところ、やはり腸幹細胞はグルコースを取り込んでいないことが確認できました。これらの結果から、GALDARはガラクトースだけではなく、グルコースの取り込みについても間接的に測定するツールとして有用であることが示唆されました。グルコースの取り込みを計測する試薬の取り扱いは煩雑かつ難しく、GALDARによる簡便な計測は従来法に比べて利点があります。
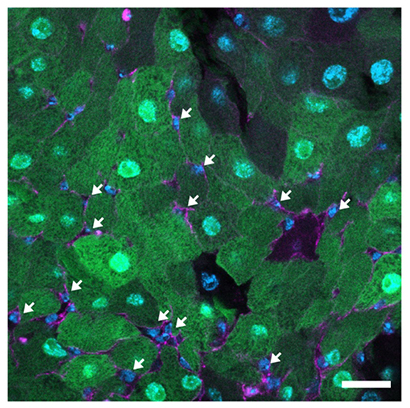
図3 ガラクトースを取り込まない腸幹細胞
腸幹細胞(白い矢印)は、周りの腸細胞が緑色のGALDARシグナルを出しているにもかかわらず、GALDARシグナルが観察されず、ガラクトースを取り込んでいない(緑はGALDARシグナル、青は核、マゼンタは細胞膜)。スケールバーは500μm。
GALDAR1/2は酵母に本来備わっているシステムをそのままショウジョウバエに導入したものであり、簡便な一方でいくつか改善すべき点がありました。ショウジョウバエの遺伝学的研究においては、既にGal4とUASを組み合わせたシステムをさまざまな遺伝子の発現ツールとして使うことが確立しており、バイオセンサーとしてのGALDAR1/2は既存のGal4-UAS発現ツールと両立できません。またGALDAR1/2は、遺伝子の転写・翻訳、蛍光タンパク質の成熟に依存するので、ガラクトースが細胞内に入ってから蛍光シグナルとして出力されるまでのスピードが遅いことも欠点でした。
そこで、研究チームは、Gal4-UASに依存せず、また迅速にガラクトースの濃度を測定できるガラクトースセンサーの開発を試みました。その結果、GALDAR3というGALDAR1/2を改良したバイオセンサーの開発に成功しました。GALDAR3では、蛍光タンパク質GFPはガラクトースにより発現誘導されるのではなく、Gal4と結合しない変異型Gal80との融合タンパク質(Gal80*-GFP)として全ての細胞に発現させておきます。またGal3は、細胞質ではなく核タンパク質として核に局在させます。ガラクトース非存在下では、Gal80*-GFPは細胞内全体に広がっているため、観察してもぼやけた蛍光シグナルとなります。一方ガラクトースが細胞に流入して核内のGal3と結合すると、細胞質と核の間を自由に行き来していたGal80*-GFPがGal3との結合により核内に集積します。結果としてGFPの蛍光シグナルは明瞭な核染色として観察されるため、ガラクトースを取り込んだ細胞を識別できます(図4)。
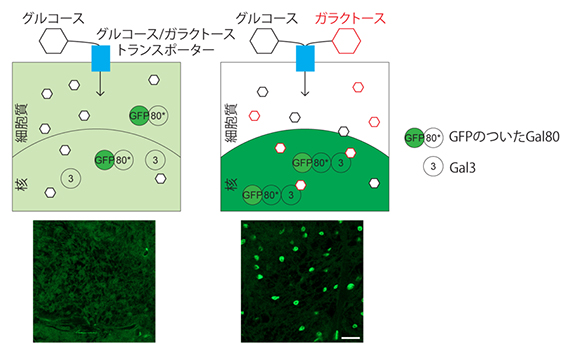
図4 Gal4-UASに依存しないGALDAR3
上)GALDAR3の仕組み。ガラクトースがない状況(左)ではGal80*-GFP融合タンパク質は細胞内に拡散し、細胞質と核内を行き来している。Gal80*はGal4との結合能を失っているため、核内に存在してもGal4-UASに影響しない。ガラクトースの存在下(右)では、Gal80*-GFP融合タンパク質は核内のGal3に結合し、核に集積する。
下)実際のショウジョウバエの組織(脂肪体)におけるGALDAR3シグナル。スケールバーは20μm。
注1)2022年4月26日プレスリリース「暗黒の細胞死の発見」
注2)2024年1月31日プレスリリース「組織幹細胞はなぜ死ににくい」
今後の期待
本研究は、ショウジョウバエを糖代謝研究の個体モデルとして、細胞内ガラクトースの測定系を確立したことに意義があります。GALDARは観察が容易な蛍光を測定指標としており、マウスや哺乳類培養細胞などにも導入可能です。
また、GALDARは細胞内のガラクトース濃度を測るセンサーとして開発したものですが、ガラクトースとグルコースが同じトランスポーターによって細胞内に流入することから、グルコース取り込み量を間接的に測定する手法としても使えることが本研究で示唆されました。ガラクトースやグルコースを細胞内に取り込むトランスポーターは糖尿病治療薬の標的の一つであり、今後、新たな治療薬の開発や探索への活用が期待されます。
補足説明
1.ショウジョウバエ
さまざまな研究分野でよく使用されるモデル生物であり、体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れている。
2.糖代謝
細胞がグルコースを分解する過程でエネルギーを取り出す代謝反応。
3.ガラクトース、グルコース
最も単純な糖分子の一種で、二糖であるラクトースはガラクトースとグルコースが結合したもの。グルコースは糖代謝の最初の反応である解糖系の基質であり、ガラクトースはグルコースに変換された後に解糖系に入る。
4.GALDAR
本研究での命名。ガラクトース(GALactose)とレーダー(raDAR)の二つの単語を合成した造語。
5.腸幹細胞
消化管の上皮は外界から取り込んだ物質に常にさらされ、皮膚と同様に細胞の脱落と再生により維持されている。腸幹細胞は、増殖能と、腸を構成する細胞に分化する能力を併せ持つ成体幹細胞である。ショウジョウバエ成虫の腸組織は安定な細胞で構成されると考えられていたが、近年、哺乳類と同様に幹細胞で維持されることが分かってきた。
6.ガラクトース血症
ガラクトース代謝酵素遺伝子の変異が原因の先天性代謝異常症の一つ。肝臓でガラクトースを代謝することができず、血中のガラクトース濃度が異常に高い値となる。
7.トランスポーター
細胞の膜に存在するタンパク質で、糖などの代謝物を細胞の外から中に運ぶ役割を持つ。ガラクトースとグルコースは構造が似ているため、同一のトランスポーターが両方を細胞に流入させる。
8.Gal3、Gal4、Gal80
酵母のガラクトース代謝を制御するタンパク質群。Gal3はガラクトース結合タンパク質、Gal4は転写活性化因子、Gal80は転写抑制因子として機能する。
9.上流活性化配列(UAS)
遺伝子の上流側(5’側)に存在し、その遺伝子の転写を活性化する機能を持つDNA配列。例えば酵母ゲノムでは、ガラクトキナーゼ遺伝子(GAL1)とUDP-グルコース-4-エピメラーゼ遺伝子(GAL10)が、同じGal4-UASに向かって逆向きに並んでおり、二つの遺伝子発現が同時に活性化されるようになっている。UASはupstream activating sequenceの略。
研究チーム
理化学研究所 生命機能科学研究センター 動的恒常性研究チーム
チームリーダー ユ・サガン(Sa Kan Yoo)
(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員)
研究パートタイマーⅡ ウーウルジャン・サクズル(Ugurcan Sakizli)
(研修生、神戸大学大学院 医学研究科)
テクニカルスタッフⅠ 高野 智美(タカノ・トモミ)
(理研 開拓研究本部 Yoo生理遺伝学研究室 特別技術員)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、開拓研究)で実施し、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「老化の遺伝学的・非遺伝学的分子基盤の解明(研究代表者:兪史幹)」、日本学術振興会(JSPS)科学研究費助成事業若手研究(A)「個体レベルでの物理的損傷に対する応答・修復メカニズムの解明(研究代表者:兪史幹)」、同基盤研究(B)「老化中の恒常性破綻機構の解明(研究代表者:兪史幹)」、科学技術振興機構(JST)創発的研究支援事業「エレボーシスを切り口とした腸恒常性維持機構の解明」による助成を受けて行われました。
原論文情報
Uğurcan Sakizli, Tomomi Takano, Sa Kan Yoo, “GALDAR: a genetically encoded galactose sensor for visualizing sugar metabolism in vivo”, PLOS Biology, 10.1371/journal.pbio.3002549
発表者
理化学研究所
生命機能科学研究センター 動的恒常性研究チーム
チームリーダー ユ・サガン(Sa Kan Yoo)
(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員)
研究パートタイマーⅡ ウーウルジャン・サクズル(Ugurcan Sakizli)
(研修生)
報道担当
理化学研究所 広報室 報道担当