2024-03-26 京都大学iPS細胞研究所
ポイント
- ACVR2B-Fc融合タンパク質注1)を安定発現するiMSC注2)(iMSCACVR2B-Fc)を作製した。
- アクチビンAおよびBMP-9を添加することでFOP細胞が起こすBMPシグナルの異常活性化は、iMSCACVR2B-Fcの培養上清を添加することで抑制された。
- FOPモデルマウスの異所性骨化は、iMSCACVR2B-Fcを移植することで抑制された。
1. 要旨
Pan Gao研究員、池谷真准教授(CiRA臨床応用研究部門)らの研究グループは、進行性骨化性線維異形成症(Fibrodysplasia ossificans progressiva: FOP)の増悪因子である骨形成タンパク質(Bone Morphogenetic protein, BMP)リガンド注3)およびアクチビンの機能を阻害することができるタンパク質であるACVR2B-Fcを、iPS細胞から作製した間葉系幹細胞(iMSCs)に発現させ、さらにこの細胞をモデルマウスに移植することで、FOP病態を一部改善することができるという結果を得ました。
FOPは、BMPリガンドのI型受容体注4)の1つであるACVR1に点突然変異注5)が生じることによって起こる希少難病注6)です。この点突然変異により、リガンド結合を伴わない下流シグナルの活性化と、リガンド結合を伴う異常活性化が起こります。よって、リガンド結合を伴う異常活性化を抑制することは、FOPの病態の進行を阻害する有効な手段の1つとなり得ます。今回の研究では、FOP変異型ACVR1に結合し、下流シグナルを異常活性化するリガンドであるアクチビンAおよびBMP-9リガンドの機能を阻害することができるタンパク質であるACVR2B-Fcを、iPS細胞から作製した間葉系幹細胞(iMSCs)に発現させ、その細胞そのものと培養上清を研究に使用しました。結果として、限定的ではありますが、培養上清がアクチビンやBMP-9によるシグナル異常活性化を阻害できるということ、そしてACVR2B-Fcを発現するiMSCsが異所性骨化を抑制するということを、細胞を使った実験系とモデルマウスを使った実験系の両方で示しました。
今回の方法による異所性骨化の抑制効果は、今後のFOP治療開発に新たな視点を提供すること可能性が期待されます。
この研究成果は2024年3月18日に「Stem Cell Research & Therapy」で公開されました。
2. 研究の背景
FOPとは、筋肉組織など本来骨ができない組織中に異所性に骨が生じる遺伝性の希少難病です。原因遺伝子として、BMPのI型受容体であるACVR1という遺伝子の点突然変異が同定されています。
これまでの研究で、BMPリガンドおよびそのファミリー分子注7)であるアクチビンがFOP変異型ACVR1に結合し、BMPシグナルを異常に強く伝達することが分かっていました(CiRAニュース2015年12月1日)。また、II型受容体注4)であるACVR2A、またはACVR2Bの細胞外ドメイン注8)のみを免疫グロブリンのFc領域注1)と融合させたタンパク質であるACVR2A-Fc融合タンパク質、またはACVR2B-Fc融合タンパク質は、アクチビンや複数種類のBMPリガンドが受容体複合体注4)に結合することを阻害する能力があることが分かっていました。
今回、研究グループは、健常人から作製したiPS細胞から誘導したiMSCにACVR2B-Fc融合タンパク質を強制発現させました。そして、その細胞(iMSCACVR2B-Fc)に異所性骨化を抑える効果があることをFOP患者さん由来iPS細胞とFOPモデルマウスの両方で確認しました。
3. 研究結果
1)ACVR2B-Fc融合タンパク質を発現するiMSCの作製
ピューロマイシン耐性遺伝子とACVR2B-FcをiMSCに導入しました(iMSCACVR2B-Fc)(Fig.1A)。コントロール細胞として、EGFPとピューロマイシン耐性遺伝子をiMSCに導入した細胞(iMSCControl)を作製しました。それぞれ1 µg/mlのピューロマイシン注9)で7日間処理することで、遺伝子が導入されていない細胞と分離しました。iMSCACVR2B-FcでのみACVR2B-Fcタンパク質が発現していることを、ウェスタンブロッティング注10により確認しました(Fig.1B)。
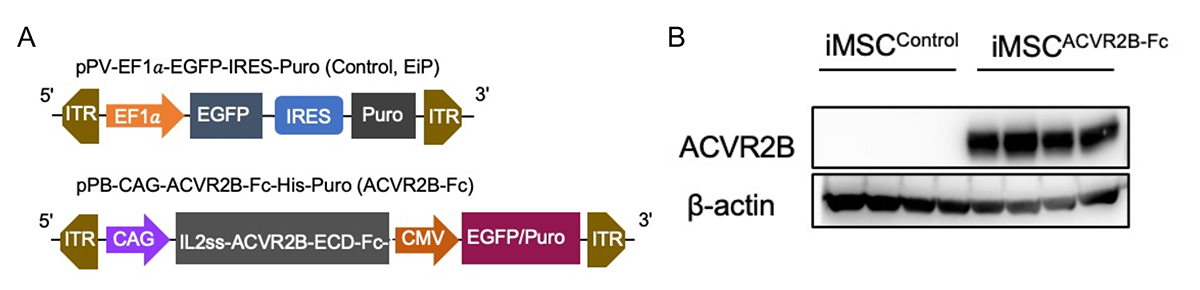
Fig.1 ACVR2B-Fc融合タンパク質発現ベクターの構造とウェスタンブロッティングによる発現確認
A. コントロールベクター(pPV-EF1a-EGFP-IRES-Puro)とACVR2B-Fc融合タンパク質発現ベクター(pPB-CAG-ACVR2B-Fc-His-Puro)の構造の模式図。
B. ACVR2B抗体によるウェスタンブロッティングを行い、培養上清中にACVR2B-Fcタンパク質が分泌されていることを確認した。
2)iMSCACVR2B-Fcの培養上清は、アクチビンおよびBMP-9によるFOP-iMSCのBMPシグナル異常活性化を阻害した
研究グループはFOP患者さん由来iPS細胞と、その細胞の変異遺伝子を修復したiPS細胞を作製しており、またこれらの細胞からそれぞれiMSCを作製していました(FOP-iMSCおよびresFOP-iMSC)(CiRAニュース 2015年3月13日)。このFOP-iMSCおよびresFOP-iMSCに、BMPシグナルの活性化を検出できるベクター(BRE-Lucレポーターベクター)を導入し、そこにアクチビンAを添加して、FOP-iMSCではBMPシグナルが活性化すること、およびresFOP-iMSCではBMPシグナルが活性化しないことを確認しました(Fig.2A)。さらに、iMSCACVR2B-Fcの培養上清を加えることで、アクチビンAで活性化されたFOP-iMSCのBMPシグナルが抑制されることを確認しました。同様の実験をBMPリガンドの1つであるBMP-9でも実施し、こちらではBMP-9添加によりFOP-iMSCとresFOP-iMSCの両方でBMPシグナルが活性化すること、およびiMSCACVR2B-Fcの培養上清を加えることで活性化したBMPシグナルが抑制されることを確認しました(Fig.2B)。
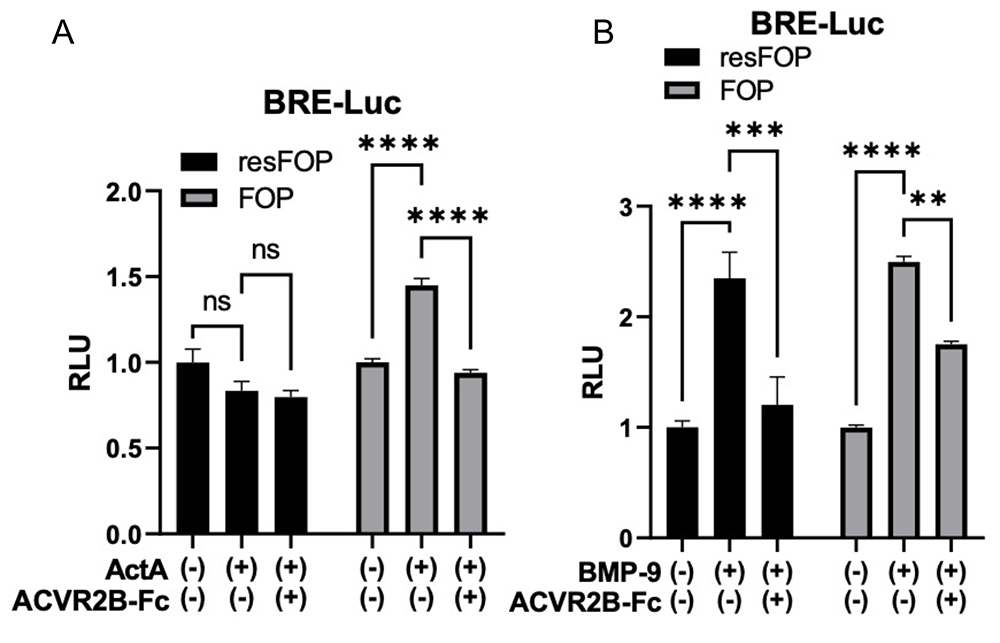
Fig.2 iMSCACVR2B-Fcの培養上清はアクチビンおよびBMP-9によるBMPシグナルの活性化を抑制した
FOP-iMSCとresFOP-iMSCにBMPシグナル活性化を検出できるルシフェラーゼレポーターベクター(BRE-Luc)を遺伝子導入し、さらにアクチビンA(ActA)、BMP-9(BMP-9)、iMSCACVR2B-Fcの培養上清(ACVR2B-Fc)を加え、その後ルシフェラーゼ活性を検出した。アクチビンAによって誘導されるFOP-iMSCにおけるBMP異常活性化がiMSCACVR2B-Fcの培養上清により抑制されること(A)、およびBMP-9によって誘導されるresFOP-iMSCとFOP-iMSCにおけるBMP活性化がiMSCACVR2B-Fcの培養上清により抑制されること(B)が確認された。
3)iMSCACVR2B-Fcの投与によりFOPマウスモデルの異所性骨化が抑制された
生体での機能を調べるため、研究グループがこれまでの研究で作製していたFOPモデルマウス(CiRAニュース 2017年8月1日)に、iMSCACVR2B-Fcを投与する実験を行いました。0日目からFOP変異型ACVR1を全身に発現させ、1週間後にカルディオトキシン(CTX)注11)を右腓腹筋に注射して筋肉を損傷させ異所性骨化を誘導しました(Fig.3A)。 8日目から、1.5×106個のiMSCACVR2B-FcおよびiMSCControlをカルディオトキシン注射部位(Local)または腹腔内 (i.p.) に、5日ごとに投与しました。 28日目に全身麻酔下で X 線およびµCTスキャンで異所性骨化の形成を観察しました。結果として、iMSCACVR2B-Fcの投与は、基礎培地(αMEM)または iMSCControlの局所注射と比較して、異所性骨化が抑制されました (Fig.3B, C)。また、運動機能を比較すると、iMSCAVR2B-Fcを局所投与されたマウスは、トレッドミル注12)で最も長い距離を走りました (Fig.3D)。しかし、ロタロッド注13)ではグループ間に差はありませんでした(Fig.3E)。
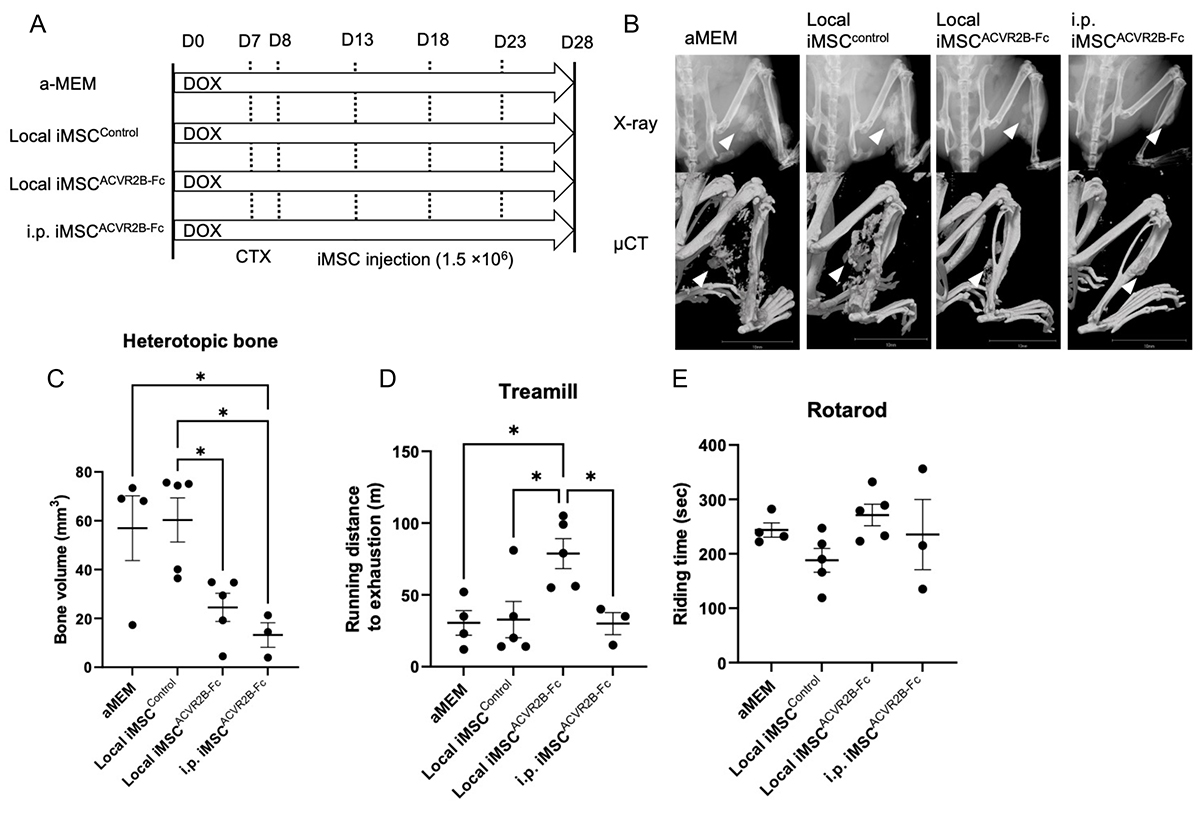
Fig.3 iMSCACVR2B-Fc投与はFOPマウスモデルの異所性骨化を抑制する
A. 投与スケジュール。B. X線写真とµCT写真。C. µCT解析から得られた骨量の比較。D. トレッドミルによる運動機能の比較。E. ロタロッドによる運動機能の比較。
4)iMSCACVR2B-Fcの投与により外科的除去後の再骨化をわずかに抑制した
FOP患者に対する異所性骨除去などの外科的介入は、手術部位だけでなく全身性に病態が進行するため禁忌とされています。今回研究者らは、外科的除去後の再骨化に対するiMSCACVR2B-Fcの抑制効果を、FOPモデルマウスを使って調べました(Fig.4A)。実験開始から21日目に誘導された異所性骨の量をµCTで記録し、可能な限り外科的に切除した後、手術直後の残留異所性骨の量をµCTで記録しました(Fig.4B, C)。次にマウスを1)基礎培地投与群(αMEM)、2)iMSCControl投与群、および3)iMSCACVR2B-Fc投与群の3グループに無作為に分け、22日目からそれぞれを腹腔内に投与(i.p.)しました。細胞は3×106細胞を使用し、4日ごとに3回注射しました。35日目に、すべてのマウスの異所性骨量をµCTとX線により評価したところ、iMSCControlを投与したマウスは、基礎培地を投与したグループと同様の再骨化を示したのに対し、iMSCACVR2B-Fcを投与したマウスでは、他の2グループのマウスと比較して再骨化の量がわずかに減少していましたが、この差は統計的に有意ではありませんでした。
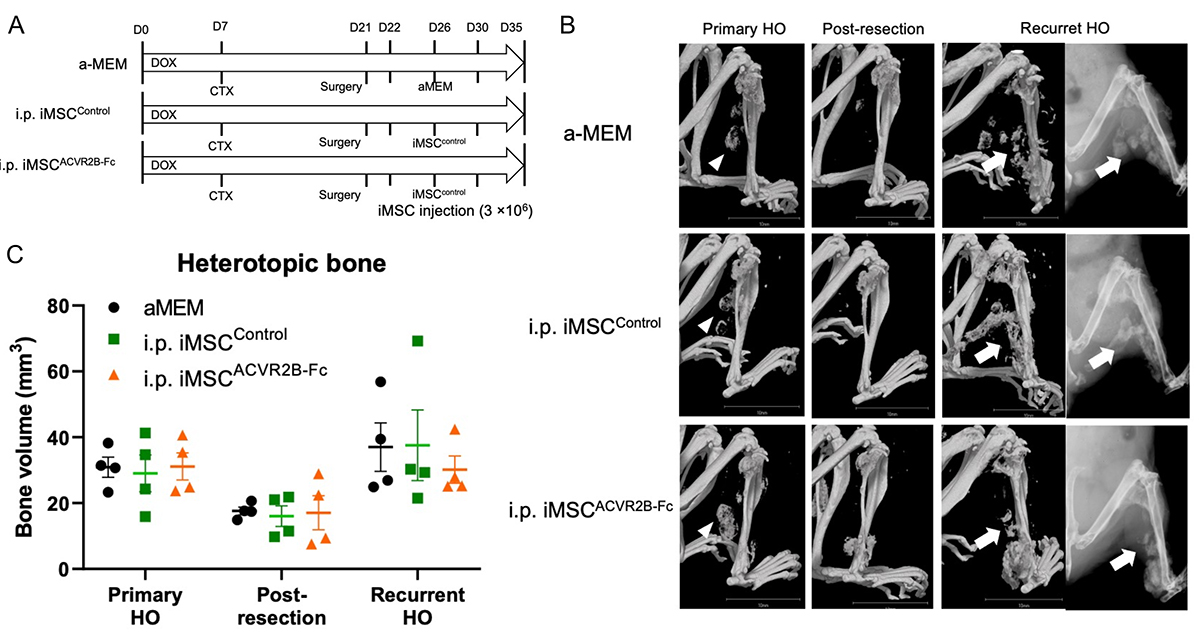
Fig.4 iMSCACVR2B-Fc投与はFOPマウスモデルの再骨化をわずかに抑制する
A. 投与スケジュール。B. X線写真とµCT写真。C. µCT解析から得られた骨量の比較。
4. まとめ
研究者らは今回、ACVR2B-Fcを発現するiMSCを作製し、培養上清中に分泌されたACVR2B-FcがアクチビンAおよびBMP-9で異常活性化されたBMPシグナルを抑制できることを示しました。さらにモデルマウスを使い、ACVR2B-Fc発現iMSCに異所性骨化の抑制効果があることを示しました。異所性骨の抑制効果、運動機能、移植されたiMSCの生存率などにまだ向上の余地があり、さらなる改善が求められますが、本研究で得られた知見は、ACVR2B-Fc融合タンパク質がFOPの治療薬候補であり、この治療タンパク質の送達方法としてiMSCが有効であることを示しています。
5. 論文名と著者
- 論文名
iMSC-mediated delivery of ACVR2B-Fc fusion protein reduces heterotopic ossification in a mouse model of fibrodysplasia ossificans progressiva - ジャーナル名
Stem Cell Research & Therapy - 著者
Pan Gao1,2, Yoshiko Inada1, Akitsu Hotta1, Hidetoshi Sakurai1, Makoto Ikeya1*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 四川大学華西口腔医学院
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)
- 「再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点」(JP15bm0104001)
- 「再生医療実現拠点ネットワークプログラム 再生・細胞医療・遺伝子治療研究開発課題」(JP22bm1123006)
- 「再生・細胞医療・遺伝子治療実現加速化プログラム 再生・細胞医療・遺伝子治療研究中核拠点」(23bm1323001h0001)
- 京都大学教育研究振興財団
- 公益財団法人ひょうご科学技術協会(#5024)
- iPS細胞研究基金
- 中国国家留学基金(202008510007)
7. 用語説明
注1)Fc融合タンパク質
抗体の定常領域の一部であるFc領域と、機能をもった別のタンパク質の一部を融合したタンパク質。融合することにより、血液中で分解される速度が遅くなることが期待される。
注2)iMSCs
間葉系幹細胞は、成体内に存在する幹細胞の一種で、骨や軟骨、脂肪などに分化する能力がある。これをiPS細胞から誘導したものがiPS細胞由来間葉系幹細胞(iMSC)。
注3)リガンド
受容体と複合体を形成して、シグナルを伝える物質。
注4)受容体
細胞外からやってくる様々なシグナルを受け取って、選択的に細胞内に伝えるタンパク質。BMPの受容体はI型受容体、II型受容体があり、それぞれ2分子ずつの4分子と、BMPリガンドが結合して受容体複合体を形成し、シグナルを細胞内に伝える。
注5)点突然変異
遺伝物質であるDNAのヌクレオチド塩基(A、T、G、C)のうち、一箇所だけ別の塩基に置き換わってしまう変異のこと。
注6)希少難病
治療法が確立されていない病気(難病)の中でも、特に患者さんの数が少ない病気。
注7)ファミリー分子
似た構造をもち、進化の過程で共通のタンパク質から派生して生まれたと考えられるタンパク質をまとめたグループのこと。
注8)細胞外ドメイン
タンパク質は機能を持ったドメインと呼ばれるまとまりが複数集まって構成されている。中でも、細胞膜の外側に存在しているドメインを細胞外ドメインと呼ぶ。BMPやアクチビンなどの細胞外から来た情報を受け取る機能がある。
注9)ピューロマイシン
抗生物質の一種。タンパク質の合成を阻害して細胞の働きを止めてしまう。細胞に目的の遺伝子を導入する際に、ピューロマイシン耐性遺伝子を一緒に導入することで、目的遺伝子を持った細胞のみを選び出す事ができる。
注10)ウェスタンブロッティング
たくさんのタンパク質が混ざった状態のサンプルから、タンパク質を分離した後に、抗体を使って特定のタンパク質を検出する方法。
注11)カルディオトキシン
コブラ毒の主成分。骨格筋を脱分極させることで、壊死を引き起こす。
注12)トレッドミル
ルームランナーのように、ベルトが動くことで走行を測る装置。
注13)ロタロッド
回転する棒の上にマウスをのせて徐々に速度を上げ、マウスが落下するまでの時間を測定する装置。協調運動を測定することができる。