2024-05-28 東京医科歯科大学,京都大学,慶應義塾大学,理化学研究所
ポイント
- 長らく全容が明らかでなかった免疫細胞の転写産物(RNA)の全長構造を、長鎖RNAシーケンス解析※1により網羅的に解明し、データベース(TRAILS) ※2を構築しました。
- トランスポゾン※3挿入に由来する転写産物の発見により、ヒトゲノム進化と免疫の多様性の理解が大きく前進しました。
- TRAILSを活用した解析により、自己免疫疾患※4やアルツハイマー病などの免疫が関与する多因子疾患の病態解明と新規治療法開発への道が拓けました。
東京医科歯科大学難治疾患研究所バイオデータ科学研究部門ゲノム機能多様性分野の高地雄太教授・稲毛純特別研究員-PDと、京都大学大学院薬学研究科の石濱泰教授と、慶應義塾大学医学部内科学(リウマチ・膠原病)教室の金子祐子教授と、理化学研究所生命医科学研究センターの鈴木亜香里上級研究員、石垣和慶チームリーダー、山本一彦センター長との共同研究グループは、転写産物の多様性が複雑疾患の発症に関与するメカニズムの解明のために、長鎖RNAシーケンス技術を用いてヒト免疫細胞に特化した転写産物のデータベース(TRAILS)を開発しました。TRAILSを活用した解析によって、自己免疫疾患などの新規発症メカニズムが明らかとなりました。その研究成果は、国際科学誌Nature Communicationsに、2024年5月28日にオンライン版で発表されました。
研究の背景
ヒトの体内には、多様な働きを持つ免疫細胞が存在します。これらの免疫細胞は、体を病気から守るために重要な役割を担っていますが、時として自分自身の細胞を攻撃してしまい、自己免疫疾患を引き起こすこともあります。免疫細胞の働きを理解することは、自己免疫疾患をはじめとするさまざまな病気の原因解明や治療法の開発につながります。しかし、免疫細胞の種類は非常に多く、それぞれの働きを詳細に調べるには、遺伝子の発現を一つ一つ解析する必要があります。特に、一つの遺伝子から複数の異なる転写産物(RNA)が作られる現象に着目することが重要ですが、技術的な限界からこれまで十分な解析が行われていませんでした。
研究成果の概要
本研究で、研究グループは29種類のヒト免疫細胞を対象に、最新の長鎖RNAシーケンス技術を用いて、遺伝子の転写産物を隅々まで調べ上げました。その結果、これまで知られていなかった多数の新しい転写産物を発見し、「TRAnscriptomic resource of Immune celLS:TRAILS」と名付けたデータベースを作成しました(図1)。TRAILSには、16万近い転写産物が含まれていますが、その半分以上はこれまで知られていなかった新しい転写産物が含まれていました。
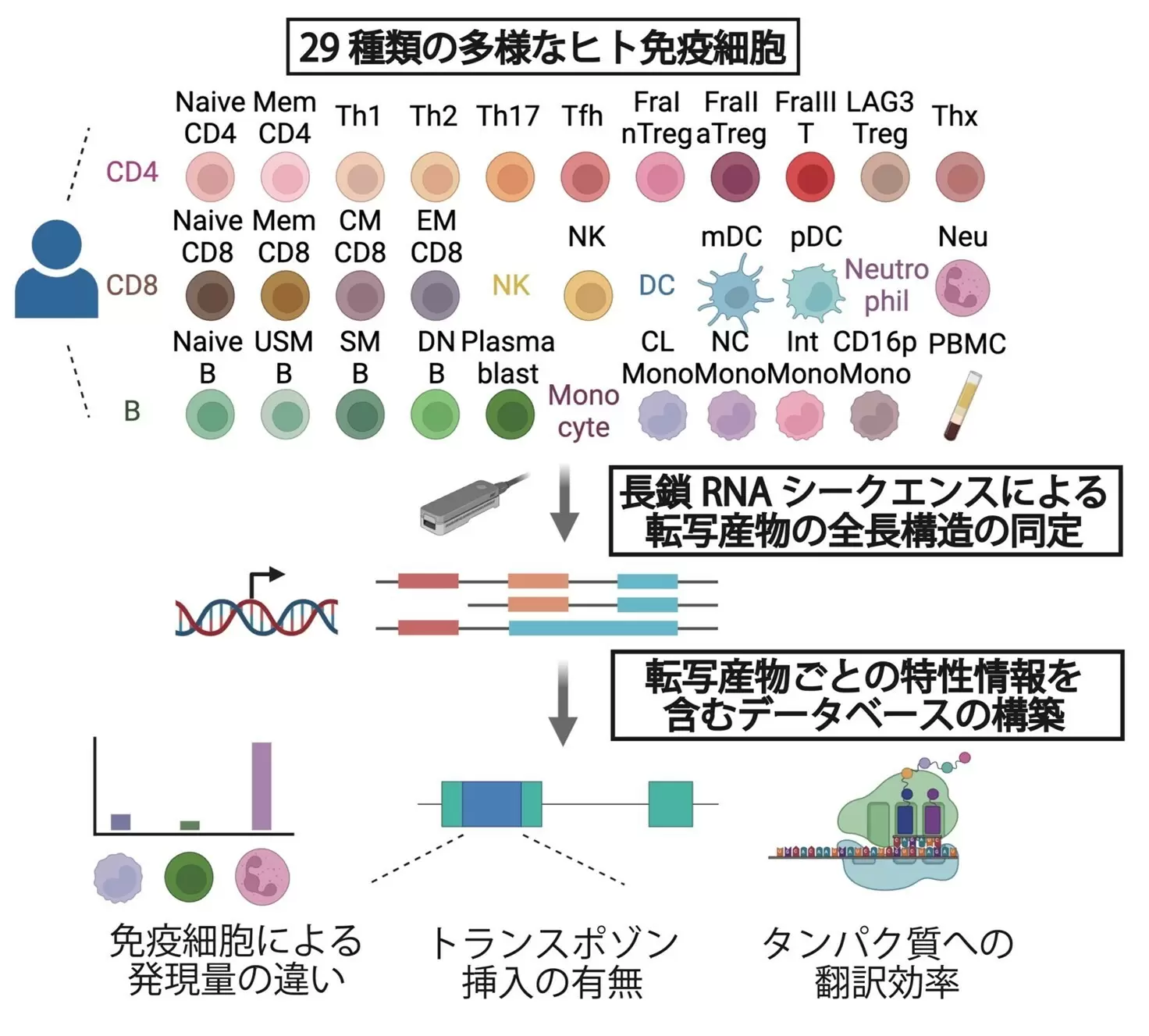
図1. 長鎖RNAシーケンス技術による、ヒト免疫細胞に特化した転写産物データベース(TRAILS)の構築
興味深いことに、これらの新しい転写産物の多くは、ゲノムの中を動き回る「トランスポゾン」という配列の挿入が関わっていました。トランスポゾンは、免疫に関連する遺伝子に特に多く見られ、免疫システムの進化に重要な役割を果たしてきたと考えられます。トランスポゾンの挿入によって、遺伝子の構造が変化し、新しい転写産物が生み出されるのです。このように、トランスポゾンは、ヒトゲノムの多様性を生み出す原動力の一つであり、特に免疫システムの進化に大きく貢献してきたことが明らかになりました。
また、本研究では、転写産物の種類が免疫細胞によって大きく異なることも分かりました。例えば、ある免疫細胞では、ある遺伝子の特定の転写産物が多く発現しているのに対し、別の免疫細胞では、同じ遺伝子の別の転写産物が優勢だったのです。こうした違いは、それぞれの免疫細胞が特有の働きを持つことを可能にしていると考えられます。
共同研究グループは、転写産物の発現パターンの違いを生み出すメカニズムについても調べました。その結果、遺伝子の3’非翻訳領域(3’UTR)という領域の選択的な使い分けが、転写産物の発現制御に重要な役割を果たしていることが分かりました。3’UTRは、遺伝子の発現量を調節する領域で、免疫細胞の種類によって異なる3’UTRが使われることで、転写産物の発現パターンが変化するのです。このことから、免疫細胞の多様性は、遺伝子の転写後調節メカニズムによって巧妙に制御されていることが明らかになりました。
さらに、研究グループは、TRAILSを使って、関節リウマチなどの自己免疫疾患やアルツハイマー病に関係する転写産物を探し出すことにも成功しました(図2)。例えば、関節リウマチでは、SIGLEC10という遺伝子のうち、特定の転写産物の発現バランスが崩れていることが分かりました。また、アルツハイマー病に関連する遺伝子では、病気の原因になり得る新しい転写産物が見つかりました。こうした発見は、TRAILSが複雑な病気のメカニズム解明に役立つことを示しています。また、遺伝子の多様性と病気の関係をさらに詳しく調べるために、TRAILSに含まれる転写産物の情報と、ゲノムの遺伝的な変異(多型)の情報を組み合わせて解析しました。その結果、多型によって転写産物の発現パターンが変化し、病気のリスクが高まる例が見つかりました。このような解析は、病気の原因となる遺伝的な仕組みを理解するための強力な手がかりとなります。
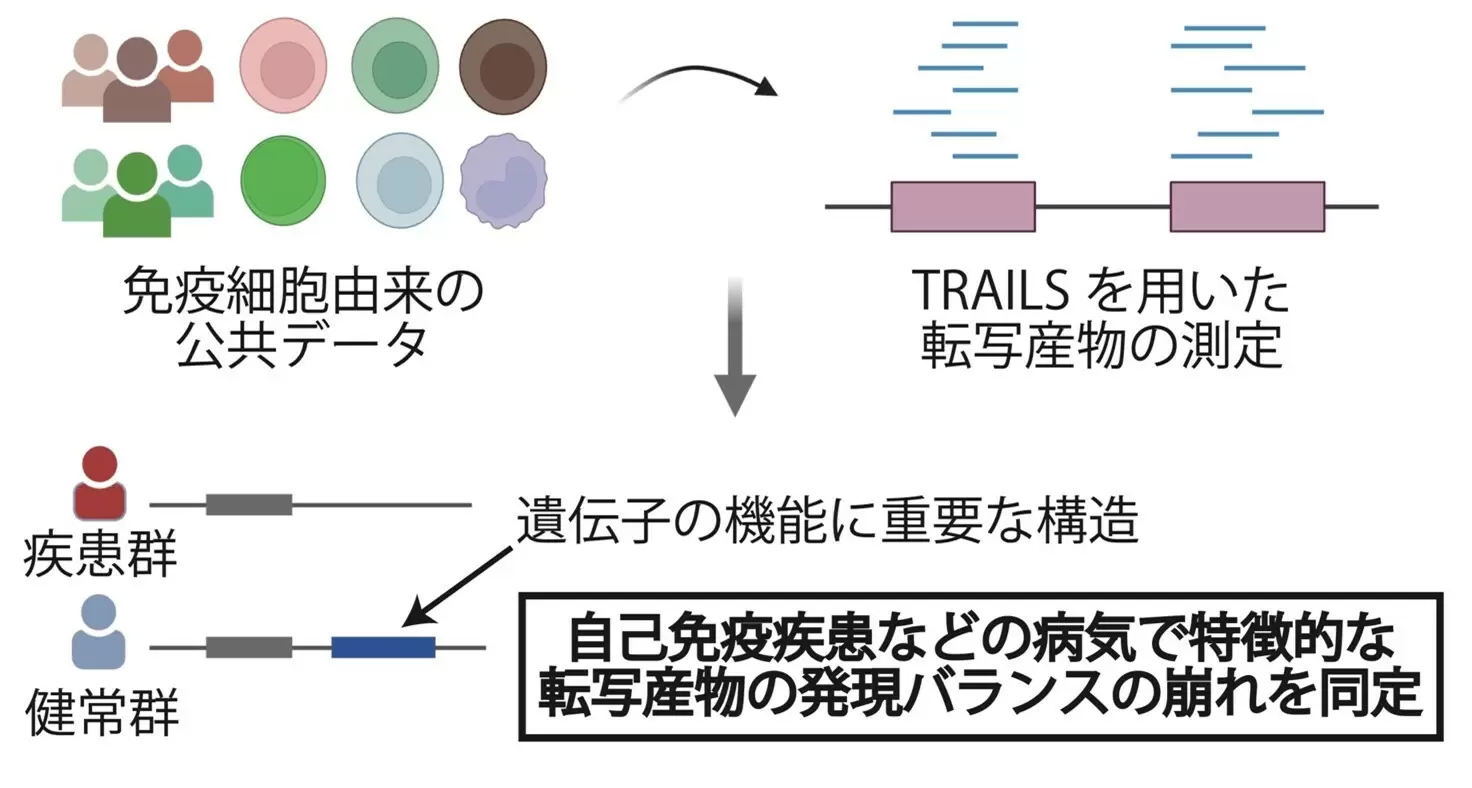
図2. TRAILSを活用したヒト免疫細胞由来の公共データの解析による疾患関連転写産物の同定
研究成果の意義
本研究は、ヒトの免疫システムを構成する細胞の多様性を、遺伝子の転写産物レベルで初めて明らかにした画期的な成果です。TRAILSは、免疫細胞の働きを理解するための貴重な情報源となるだけでなく、ヒトのゲノムの進化における「トランスポゾン」の役割や、免疫細胞の特殊な機能に関わる転写産物の働きなど、生物学的に重要な発見をもたらしました。また、自己免疫疾患などの複雑な病気の原因解明にも役立つと期待されます。本研究で構築されたデータベースは、ヒト免疫細胞から得られた他のデータにも応用できる汎用性の高いものであり、基礎研究から医療応用まで、幅広い分野で活用されると期待されます。
用語解説
※1 長鎖RNAシーケンス:RNA分子の長い領域の塩基配列を決定する技術。従来の方法よりも長い配列を読むことができる。
※2 TRAILS:本研究で構築された、ヒト免疫細胞の発現遺伝子の全長構造を収録したデータベース。
※3 トランスポゾン:ゲノム中を転移する DNA配列。ゲノムの構造や機能に大きな影響を与える。
※4 自己免疫疾患:免疫システムが自分自身の細胞や組織を攻撃してしまう疾患。関節リウマチや全身性エリテマトーデスなどが含まれる。
論文情報
掲載誌: Nature Communications
論文タイトル: Long-read sequencing for 29 immune cell subsets reveals disease-linked isoforms
DOI: https://doi.org/10.1038/s41467-024-48615-4
研究者プロフィール
稲毛 純 (イナモ ジュン) Inamo Jun
東京医科歯科大学 難治疾患研究所
ゲノム機能多様性分野 非常勤講師(当時:特別研究員PD)
University of Colorado, Division of Rheumatology and Center for Health AI School of Medicine, Postdoctoral Fellow
慶應義塾大学医学部
内科学(リウマチ・膠原病)教室 特任助教
・研究領域
ゲノム医学、膠原病内科学
高地 雄太 (コウチ ユウタ) Kochi Yuta
東京医科歯科大学 難治疾患研究所
ゲノム機能多様性分野 教授
・研究領域
ゲノム医学、膠原病内科学
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所
ゲノム機能多様性分野
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
京都大学 渉外・産官学連携部広報課国際広報室
慶應義塾大学信濃町キャンパス総務課:飯塚・奈良・岸
理化学研究所 広報室 報道担当