2024-05-08 理化学研究所,トロント大学ドネリーセンター,スイス熱帯公衆衛生研究所
理化学研究所(理研)環境資源科学研究センター 化合物リソース開発研究ユニットの長田 裕之 ユニットリーダー(創薬ケミカルバンク基盤ユニット 基盤ユニットリーダー)、渡邉 信元 嘱託職員、創薬ケミカルバンク基盤ユニットの平野 弘之 研究パートタイマーⅠ、トロント大学ドネリーセンターのアンドリュー・フレーザー 教授、テイラー・ディヴィー 大学院生、ゼニア・セラット 博士研究員、スイス熱帯公衆衛生研究所のジェニファー・カイザー 准教授らの国際共同研究グループは、新しい作用メカニズムを有する駆虫薬の候補となる化合物を新たに発見しました。
本研究成果は、世界で10億人以上の感染者がいる土壌伝染性蠕虫(ぜんちゅう)(STH)[1]に対する新しい駆虫薬の開発に貢献することが期待できます。
今回、国際共同研究グループは、トロント大学で開発した線虫[2]を利用したハイスループット線虫嫌気条件移動アッセイ[3]によって、理研天然化合物ライブラリー(NPDepoライブラリー)[4]を探索することで、線虫の嫌気性代謝を阻害する新しい化合物を見いだし、さらにその作用メカニズムを明らかにしました。見いだされた化合物は実際に寄生虫成体を殺滅する効果を有しました。この物質を駆虫薬として実用化することを目指し研究を進めています。
本研究は、科学雑誌『Nature communications』オンライン版(5月8日付:日本時間5月8日)に掲載されました。
背景
土壌伝染性蠕虫(STH)は、世界に10億人以上の感染者がいる寄生虫です。現在、有効な駆虫薬は少なく、その数少ない駆虫薬に対しても耐性株が増加しています。従って、新しい駆虫薬の開発が急務となっています。効果的な駆虫薬は、宿主の動物に害を与えることなく、宿主の中にいるSTHを駆除しなければなりません。すなわち、どのようにしてSTHを特異的に標的とする化合物を見いだすかが効果的な駆虫薬開発の重要なポイントです。
STHは宿主に感染した後、宿主の腸内にすみ着きます。腸内は低酸素であり、この低酸素環境に適応するためにSTHは宿主にはない特異な経路を利用します。この経路を阻害する薬剤は、宿主には影響を与えずにSTHを殺すことができるので、駆虫薬として機能します。本研究ではそのような化合物を見いだすためにフレーザー教授が開発した独自の探索法によって、理研天然化合物ライブラリーを探しました。
研究手法と成果
STHは宿主の腸内の低酸素状態で生存するために、ミトコンドリアの電子伝達系[5]を特殊な方法で利用します。高酸素状態では、他の動物同様ユビキノン(UQ)[6]を用いて電子の伝達を行います(図1左)が、低酸素状態ではユビキノンに似たロドキノン(RQ)[7]と複合体Ⅱまでの経路を用いて電子を伝達します(図1右)。
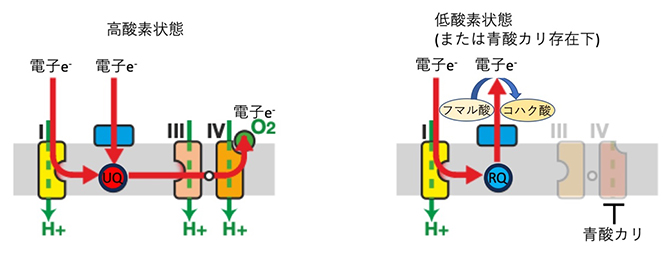
図1 酸素濃度によって経路が変わる寄生虫の電子伝達系
(左)寄生虫を含む多くの動物のミトコンドリアでの電子伝達系は、高酸素状態では複合体Ⅰから電子がユビキノン(UQ)に渡され、その後酸素O2の還元へと進む。(右)低酸素状態あるいは青酸カリなどの複合体Ⅳの阻害下では電子伝達系が進まない。寄生虫ではユビキノンの代わりに類縁物質ロドキノン(RQ)が電子を受け取り、そのままフマル酸を還元することで電子伝達系を完了する。この経路は宿主動物には存在しない経路なので駆虫薬の良い標的となる。
この経路(ロドキノン経路)は宿主動物にはない経路で、駆虫薬の標的として最適です。フレーザー教授らは、モデル生物として実験室で利用されている線虫(図2左)にも、この経路が存在することを利用して、線虫を用いたロドキノン経路特異的阻害剤探索系を開発しました。線虫に青酸カリを投与しても、低酸素状態と同様に活動は止めますが、ロドキノン経路によって線虫は生存し続け、青酸カリを除去すると運動を再開します。しかし、青酸カリと同時にロドキノン経路阻害物質が存在すると、線虫は死亡し、青酸カリ除去後も活動しません(図3右)。
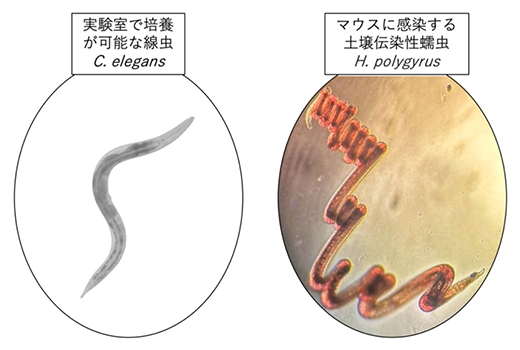
図2 本研究で用いた線虫類
(左)モデル動物として実験室内で利用される線虫Caenorhabditis elegans。(右)マウスの腸に寄生する線虫Heligmosomoides polygyrus。
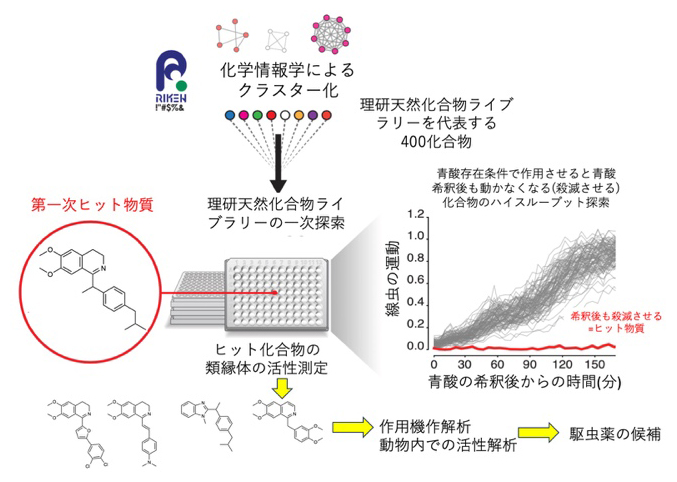
図3 理研天然化合物ライブラリーからの駆虫薬候補の発見
ライブラリーの化合物を用いて線虫を処理した後、15時間青酸カリで処理しその後青酸カリを除く。化合物での処理無しの場合には線虫は青酸カリ存在下でもロドキノン経路を利用して生存し続け、青酸カリ除去後には再び動き始める。しかしロドキノン経路を阻害する物質の存在下では線虫は死んでしまい、青酸カリを除いてももはや動かない。この方法で極めて短時間に多くの化合物からロドキノン経路阻害物質を単離できた。この化合物の類縁体からさらに強い活性を有する物質を選び出し、それらが実際にロドキノン経路の中で複合体Ⅰを阻害することも確認した。得られた物質は駆虫薬の良い候補である。
青酸カリと同時に化合物ライブラリーの多くの化合物を探索するには、それぞれの線虫を顕微鏡下で観察する必要があります。フレーザー 教授らは、テレセントリックな光学系[8]を持つ顕微鏡を用いた観察系を独自に開発することで、多くの化合物探索を瞬時に定量的に行えるシステムも開発しました。
この方法を用いて、NPDepoライブラリーの400の代表化合物を探索することで、国際共同研究グループは青酸カリ処理特異的に線虫を殺滅させる化合物を見いだしました(図3)。さらにこの物質のNPDepoライブラリー内の類縁化合物や他のライブラリーの類縁体群を探索し、より活性の高い化合物を得ました。これらの化合物は予想通り線虫のミトコンドリア内電子伝達系で複合体Ⅰを阻害することが明らかになりました。
活性の強かった4化合物についてマウスに寄生するSTHであるHeligmosomoides polygyrus(図2右)に対する効果を解析したところ、完全に治すことはできなかったもののマウス内のSTHを最大40%以上殺滅させる効果があることが分かりました。
今後の期待
今回得られた新しい作用メカニズムを持つ駆虫薬候補からさらに強い活性を有する化合物への誘導体展開を行うことで、近い将来、駆虫薬として実用化されると期待されます。
新しく開発された線虫の動きを指標としたハイスループット系による駆虫薬候補の探索系は、他のいろいろな条件を与えることでさまざまな作用メカニズムを持つ化合物の探索へ応用でき、さらなる新しい駆虫薬の開発に寄与すると考えられます。
今回の化合物の発見は、多くの天然化合物群を有するNPDepoライブラリーの有用性を示すものです。また、その代表的な化合物400化合物の探索から目的とする活性を有する化合物にたどり着けた今回の研究は、NPDepoライブラリーが推奨するこのような探索方法の有効性を実証しました。これからも、このライブラリーから新しい有益な物質が比較的短い探索で見いだされると期待されます。
本研究成果は、国際連合が定めた17項目の「持続可能な開発目標(SDGs)[9]」のうち、「3.すべての人に健康と福祉を」に貢献するものです。
補足説明
1.土壌伝染性蠕虫(ぜんちゅう)(STH)
腸内寄生虫の一種。感染した人間・動物が土壌や水源を糞便(ふんべん)中の寄生虫卵で汚染し、それが付着した植物、水を摂取したり、幼虫が経皮(皮膚から)侵入することで、他の人間・動物に感染する。STHはSoil-Transmitted Helminthsの略。
2.線虫
線形動物門に属する体長1ミリメートルほどの土壌動物。学名Caeorhabditis elegans。体が無色透明であることから、生きたまま細胞の中を顕微鏡で観察できることや、動物では初めて全ゲノム配列が解読されたこと、発生時の細胞分裂パターン(細胞系譜)が全て分かっていること、遺伝学的な実験手法、遺伝子機能の操作が容易であることなどから、モデル生物として広く利用されている。
3.ハイスループット線虫嫌気条件移動アッセイ
低酸素状態での特殊な電子伝達系を阻害する化合物を高速に探索するために、線虫の移動を利用したアッセイ方法。線虫に青酸カリを半日程度投与して低酸素状態と同様の状態にしても線虫は特殊な電子伝達系を有するので死なず青酸カリ除去後には移動を再開できる。線虫の移動により、線虫の生死を瞬時に判別ができる。青酸カリと同時にテスト化合物を与えそれらの除去後に移動を再開できなくなった場合、その化合物が低酸素状態での特殊な電子伝達系の阻害物質であると見いだすことができる。
4.理研天然化合物ライブラリー(NPDepoライブラリー)
微生物・植物由来の天然化合物および合成化合物を収集し、化合物ライブラリーとして配布している。所蔵する2万以上の化合物を化学情報学的にクラスター化し、それぞれのクラスターを代表する400化合物を使って全体の探索が可能である。NPDepoはNatural Product Depositoryの略。
5.ミトコンドリアの電子伝達系
解糖系およびTCA回路で作られるNADHやFADH2が、ミトコンドリア内膜のタンパク質や補酵素間での電子のやり取りで酸化される過程。
6.ユビキノン(UQ)
ユビキノンはキノンの誘導体であり、長いイソプレン側鎖を有するため膜中に保持される化合物。ミトコンドリア電子伝達系で複合体ⅠとⅢの電子の仲介を果たす。
7.ロドキノン(RQ)
ユビキノンの6位のメトキシ基がアミノ基に置換された化合物。低酸素状態での呼吸鎖電子伝達系における電子伝達体である。
8.テレセントリックな光学系
視野にある物体の距離や位置に関係なく、同じ倍率を提供する光学系。96穴のプレートの全ての穴が同じ大きさに見えるため、同時に全ての穴の線虫の動きを定量的に記録することができる。
9.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。
国際共同研究グループ
理化学研究所 環境資源科学研究センター
化合物リソース開発研究ユニット
ユニットリーダー 長田 裕之(オサダ・ヒロユキ)
(創薬ケミカルバンク基盤ユニット 基盤ユニットリーダー)
嘱託職員 渡邉 信元(ワタナベ・ノブモト)
創薬ケミカルバンク基盤ユニット
研究パートタイマーⅠ 平野 弘之(ヒラノ・ヒロユキ)
トロント大学ドネリーセンター(カナダ)
教授 アンドリュー・フレーザー(Andrew G. Fraser)
教授 イゴール・シュタギラー(Igor Štagljar)
博士研究員 ゼニア・セラット(Xènia Serrat)
大学院生 テイラー・ディヴィー(Taylor Davie)
大学院生 ジェイミー・スナイダー(Jamie Snider)
スイス熱帯公衆衛生研究所
准教授 ジェニファー・カイザー(Jennifer Keiser)
大学院生 レア・イムホフ(Lea Imhof)
協力研究機関
バーゼル大学(スイス)
研究支援
本研究は、日本学術振興会(JSPS)学術変革領域研究(A)「深層学習を用いた化合物潜在空間の構築および人工分子構造のデザイン(研究代表者:榊原 康文、研究課題番号23H04885)」による助成を受けて行われました。フレーザー教授は日本学術振興会(JSPS)令和5年度外国人招へい研究者として、2024年4月29日まで来日していました。
原論文情報
Taylor Davie, Xènia Serrat, Lea Imhof, Jamie Snider, Igor Štagljar, Jennifer Keiser, Hiroyuki Hirano, Nobumoto Watanabe, Hiroyuki Osada and Andrew G Fraser, “Identification of a family of species-selective complex I inhibitors as potential anthelmintics”, Nature communications, 10.1038/s41467-024-47331-3
発表者
理化学研究所
環境資源科学研究センター 化合物リソース開発研究ユニット
ユニットリーダー 長田 裕之(オサダ・ヒロユキ)
(創薬ケミカルバンク基盤ユニット 基盤ユニットリーダー)
嘱託職員 渡邉 信元(ワタナベ・ノブモト)
創薬ケミカルバンク基盤ユニット
研究パートタイマーⅠ 平野 弘之(ヒラノ・ヒロユキ)
トロント大学ドネリーセンター(カナダ)
教授 アンドリュー・フレーザー(Andrew G. Fraser)
博士研究員 ゼニア・セラット(Xènia Serrat)
大学院生 テイラー・ディヴィー(Taylor Davie)
スイス熱帯公衆衛生研究所
准教授 ジェニファー・カイザー(Jennifer Keiser)
報道担当
理化学研究所 広報室 報道担当