2024-06-07 東京大学
発表のポイント
- 細胞内で起こるタンパク質間相互作用を超高解像度で可視化する技術を開発しました。
- タンパク質間相互作用が起こっている”位置”を一分子レベルで特定し、その”個数”を計測することに成功しました。
- さまざまな生命現象を分子レベルで解明する研究への応用が期待されます。
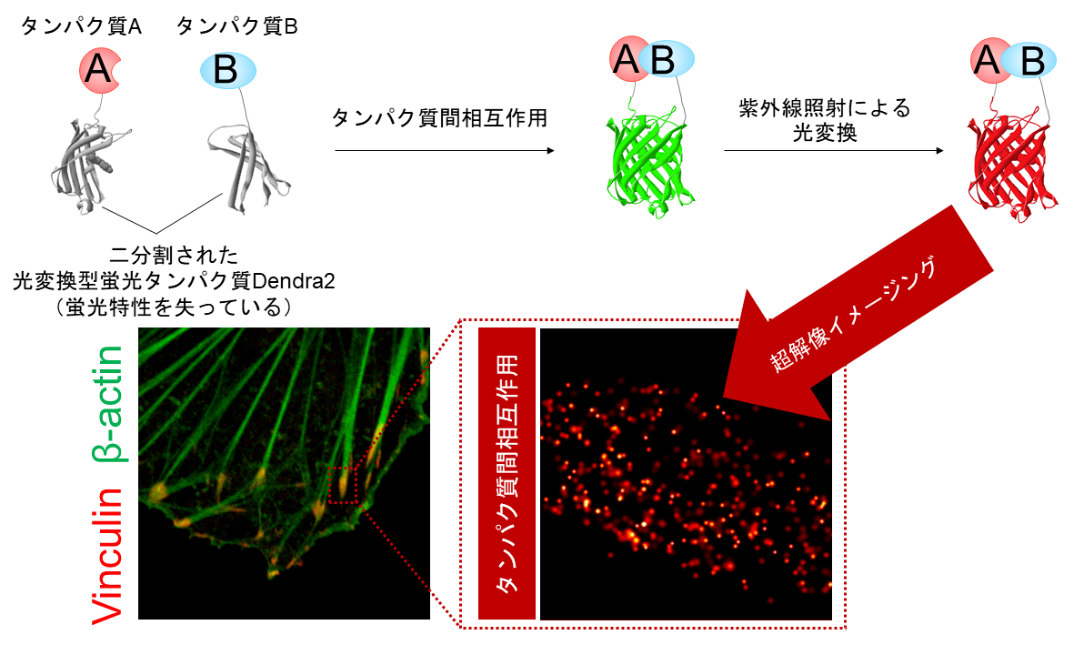
本研究で開発したタンパク質間相互作用を超高解像度で可視化する技術
概要
東京大学大学院総合文化研究科の青野侑基特任研究員、一宮航大学院生(研究当時)、吉田まゆみ大学院生(研究当時)、佐藤守俊教授、および神奈川県立産業技術総合研究所の中嶋隆浩常勤研究員(兼務:東京大学大学院総合文化研究科広域科学専攻 特任研究員)らによる研究グループは、細胞内でタンパク質間相互作用が起こっている位置とその数を一分子レベルの超高解像度でイメージングする技術を開発しました。従来の超解像イメージング技術では、個々のタンパク質分子がどのように分布しているかを可視化することはできましたが、生命現象を理解する上で重要なタンパク質の相互作用が細胞内のどこで・どの程度起こっているのかまではわからず、生命現象を解明する上で大きな制約となっていました。
本研究グループは、光変換型蛍光タンパク質「Dendra2」に着目し、遺伝子工学的手法を用いてDendra2の様々な二分割体を作製しました。この中から、分割体に連結したタンパク質のペアが相互作用したときだけ、その蛍光特性が回復する分割体を見出し、タンパク質間相互作用を超解像イメージングするための分割型蛍光タンパク質「split-Dendra2」として開発することに成功しました。Split-Dendra2を用いることで、従来の技術では観察できなかった細胞内のタンパク質間相互作用を一分子レベルの超高解像度で可視化して、その位置や数を計測することに成功しました。
この新しい技術により、生命現象を分子レベルで解明する解き明かす生命科学のさらなる発展に大きく貢献することが期待されます。
本成果は、米国科学誌「ACS Chemical Biology」(電子版:米国時間6月4日)に掲載されました。
発表内容
研究の背景
さまざまな生命現象はタンパク質の相互作用によって制御されています。ヒトの場合、細胞内では実に2万種類以上という膨大な数のタンパク質がひしめき合っています。これらのタンパク質の多くは、互いに相互作用することでその機能を発揮します。この「タンパク質間相互作用」は、生命現象の根幹をなすものであり、創薬のターゲットとしても注目されています。
近年、超解像イメージング(注1)と呼ばれる技術が登場し、細胞内のタンパク質分子ひとつひとつがどのように分布しているかを観察できるようになりました。しかし、既存の超解像イメージング技術では、相互作用している分子と相互作用していない分子を判別することは困難でした。これは相互作用している少数の分子が、相互作用していない多数の分子の中に埋もれてしまうことに起因します。この問題を解決するために、相互作用している分子だけをハイライトして超解像イメージングする技術の開発が切望されていました。
研究内容
本研究グループは、光変換型蛍光タンパク質であるDendra2(注2)を二分割し、そのN末端断片とC末端断片に、タンパク質Aとタンパク質Bをそれぞれ連結しました(図11)。分割したDendra2は蛍光特性を失っているので、タンパク質Aとタンパク質Bが相互作用しない場合は、蛍光は観察されません。一方で、タンパク質Aとタンパク質Bが相互作用する場合は、Dendra2の分割体は接近し結合します。このときDendra2の分割体は蛍光特性を回復することがわかりました。これによって、タンパク質間相互作用が起こったタンパク質のペアだけをハイライトし、超解像イメージングすることが可能になりました。このように開発したDendra2の分割体を「split-Dendra2」と名付けました。
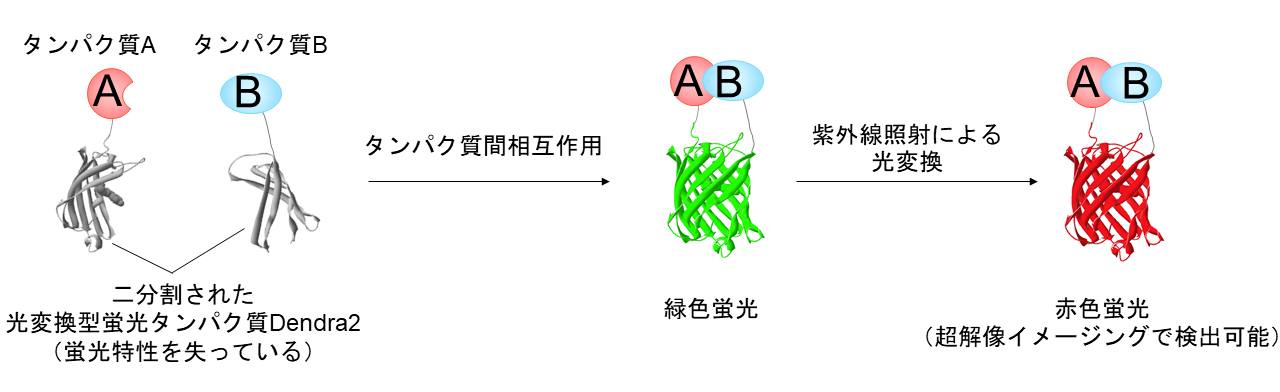
図1 本研究で開発した技術の原理光変換型蛍光タンパク質を二分割し、そのN末端断片とC末端断片に、タンパク質Aとタンパク質Bをそれぞれ連結しました。分割したDendra2は蛍光特性を失っており、タンパク質A-B間の相互作用しない場合は、蛍光は観察されません。タンパク質AとBが相互作用する場合は、Dendra2の分割体は接近し結合します。このとき、split-Dendra2は緑色蛍光を回復し、光変換可能な状態になります。さらに、紫外線照射によって、緑色蛍光から赤色蛍光へと光変換することができ、この赤色蛍光を超解像イメージングで検出します。
本研究グループは、split-Dendra2を用いることで、クラスリン被膜ピットと呼ばれる細胞内の小さな構造体(直径100~200 nm)で起こるタンパク質間相互作用を超解像イメージングできることを示しました(図2)。一方、先行研究で報告されている光変換型蛍光タンパク質の分割体(split-EOS3.2、split-mIris(150)、split-PAmCherry)も試しましたが、クラスリン被膜ピットでのタンパク質間相互作用をほとんど観察することができませんでした。このように、split-Dendra2を用いることで、細胞内の構造体で起こるタンパク質間相互作用の場所と数を一分子レベルの精度で計測できることを実証しました。
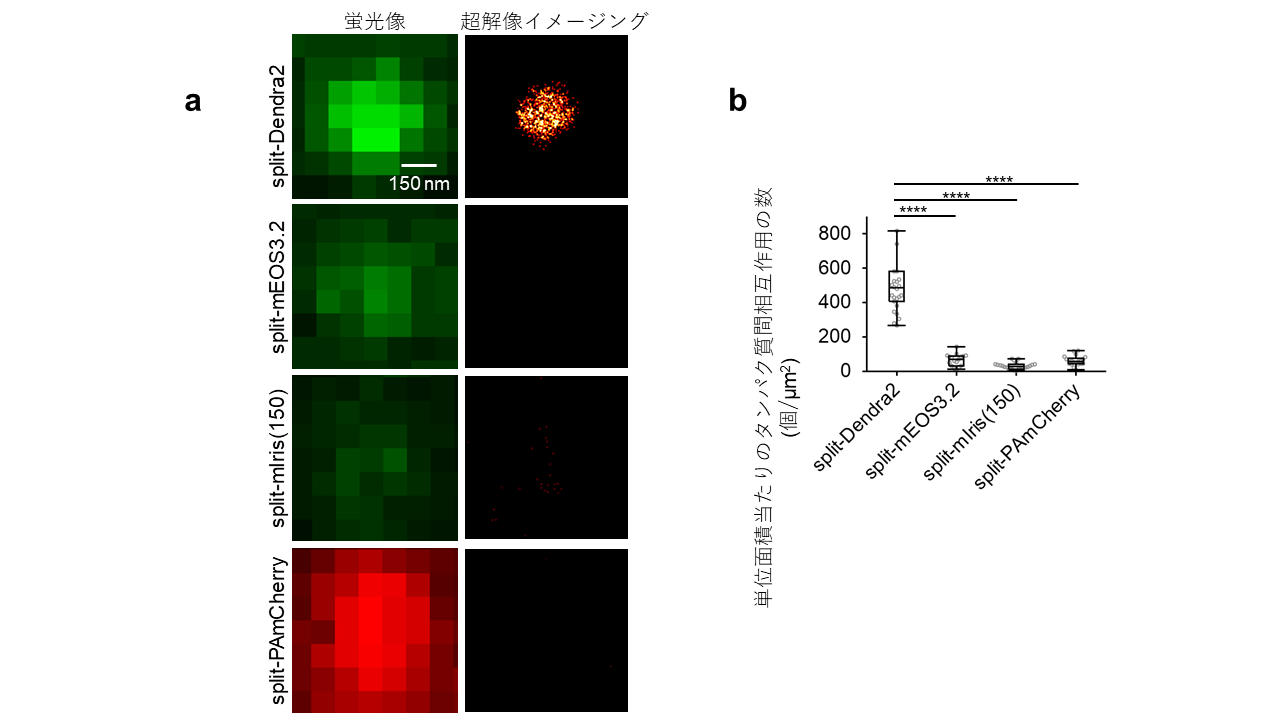
図2 クラスリン被膜ピットで起こるタンパク質間相互作用の超解像イメージング
- 本研究で開発したsplit-Dendra2はクラスリン被膜ピットで起こるタンパク質間相互作用の超解像イメージングを可能にします。一方で、先行研究で報告されている光変換型蛍光タンパク質の分割体(split-EOS3.2、split-mIris(150)、split-PAmCherry)では、タンパク質間相互作用をほとんど観察することができませんでした。画像中のスケールバーは150 nmを表しています。
- 図2aの画像データをもとに、計測したタンパク質間相互作用の数を数値データで示しています。図注の「****」は統計的な有意差があることを示しています。
さらに本研究グループは、細胞接着斑(注3)と呼ばれる細胞内の構造体において、split-Dendra2を用いたタンパク質間相互作用の超解像イメージングを行いました。細胞接着斑は、細胞の形態維持や運動を司る構造体として知られています。細胞接着斑を構成するβ-actin と他の3つのタンパク質(α-actinin、vinculin、FAK)の相互作用の解像イメージングを行ったところ、それぞれの相互作用の数は、「β-actinとα-actininの相互作用」>「β-actinとvinculinの相互作用」>「β-actinとFAKの相互作用」の順となることを見出しました(図3)。
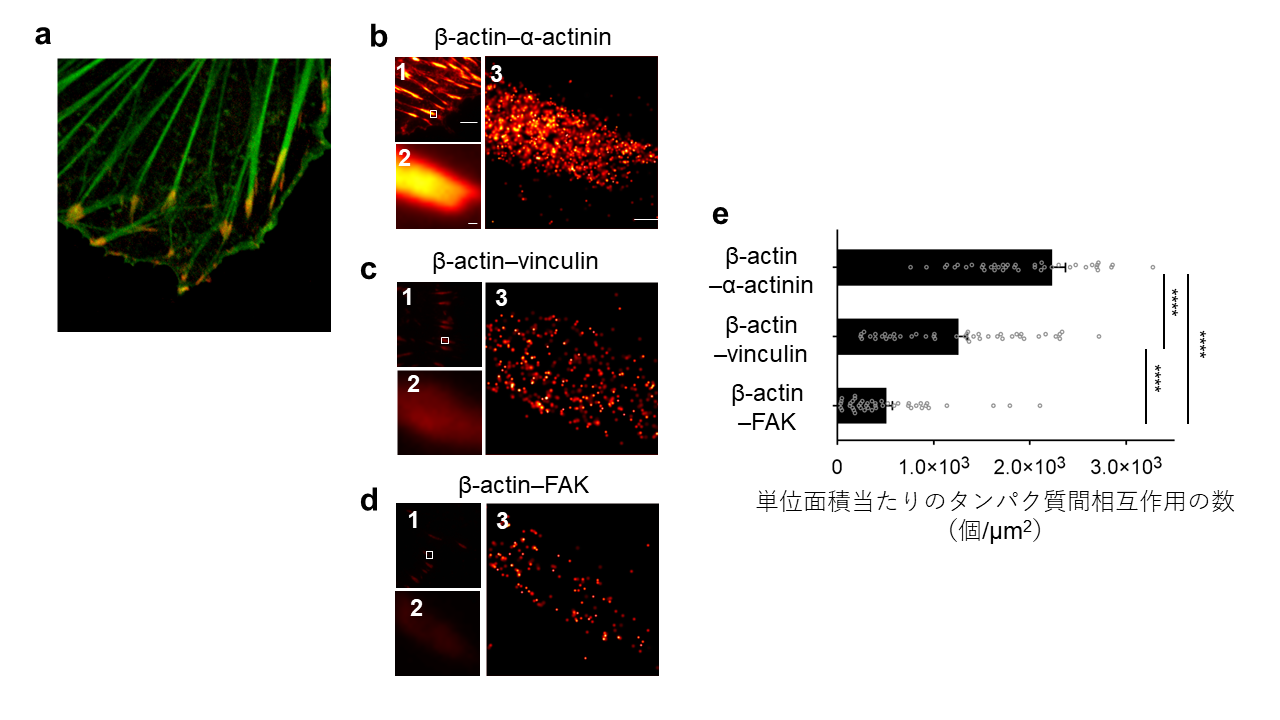
図3 細胞接着斑で起こるタンパク質間相互作用の超解像イメージング
- β-actin(緑)とα-actinin(赤)の蛍光画像。赤色蛍光と緑色蛍光が重なり、黄色く見えるところが細胞接着班を示しています。
- β-actinとα-actininの相互作用
- β-actinとvinculinと相互作用
- β-actinとFAKの相互作用
- 図3b-dの超解像画像データをもとに、計測したタンパク質間相互作用の数を数値データで示しています。図注の「****」は統計的な有意差があることを示しています。
図3b-dの画像中の3つのパネルは1.split-Dendra2を用いて、タンパク質間相互作用を検出した際の通常の蛍光像。2.パネル1に示した白枠を拡大したもの。3.パネル2の超解像イメージングを示しています。各画像のスケールバーは、パネル1では2 µm、パネル2、3では200 nmを表しています。
上述のように、本研究グループは、タンパク質間相互作用の超解像イメージングを実現する新たな技術としてsplit-Dendra2を開発しました。タンパク質間相互作用が細胞内のどこで・どの程度起こっているのかを明らかにすることは、生命現象を理解する上で極めて重要です。本研究によって、生命現象を分子レベルで解明する生命科学のさらなる発展に貢献することが期待されます。これに加え、タンパク質間相互作用をターゲットとした創薬や病気の診断などへの展開も期待されます。
発表者・研究者等情報
東京大学大学院総合文化研究科広域科学専攻
青野 侑基 特任研究員
一宮 航 博士課程(研究当時)
吉田 まゆみ 修士課程(研究当時)
佐藤 守俊 教授
神奈川県立産業技術総合研究所
中嶋 隆浩 常勤研究員(兼務:東京大学大学院総合文化研究科広域科学専攻 特任研究員)
論文情報
雑誌名:ACS Chemical Biology(オンライン版)
題名:A highly efficient fluorescent probe to visualize protein interaction at the super-resolution
著者名:Yuki Aono、 Takahiro Nakajima、 Wataru Ichimiya、 Mayumi Yoshida and Moritoshi Sato*(*責任著者)
DOI:10.1021/acschembio.4c00075
URL:https://doi.org/10.1021/acschembio.4c00075
研究助成
本研究成果は、独立行政法人日本学術振興会(JSPS)の科学研究費助成事業(研究代表者:佐藤守俊、課題番号:21H04702)、および、神奈川県立産業技術総合研究所(KISTEC)の有望シーズ展開事業(プロジェクトリーダー:佐藤守俊)の一貫として得られました。
用語説明
(注1) 超解像イメージング
蛍光タンパク質の実際の大きさは、数ナノメートルですが、これを蛍光顕微鏡で観察すると、光の回折によって数百ナノメートルにまで広がってしまいます。GFPのような通常の蛍光タンパク質を使用した蛍光イメージングでは、密集した分子がそれぞれ同時に光り、大きく広がった輝点同士が重なり合ってしまうため、個々の分子を分離することができませんでした。超解像イメージングでは、蛍光の色や明るさを切り替えられる特殊な蛍光タンパク質を使うことで、密集する分子のごく一部をまばらに光らせ、広がった輝点を分離することができます。そして、まばらに光る一分子の画像を大量に取得し、それぞれの輝点の中心座標を求めることで個々の分子の分布を一分子レベルで明らかにすることができます。
(注2) 光変換型蛍光タンパク質Dendra2
特定の光を照射することで蛍光の色を変えられる蛍光タンパク質です。Dendra2は通常緑色の蛍光を発しますが、紫外線を照射することで赤色の蛍光に切り替えることができます。照射する紫外線の強度を微弱にすると、この色の変化はごく一部の分子で確率的に起こり、密集する分子をまばらに光らせることができます。赤い蛍光に切り替えた分子は、強い励起光を照射し続けられることでその蛍光を消失させることができます。このサイクルを何度も繰り返すことで、超解像イメージングの実現に必要な、まばらに光る一分子画像を取得することができます。
(注3) 細胞接着斑
細胞の接着や運動といった機能に重要な細胞内の構造体で、多種多様なタンパク質によって構成されています。従来の超解像イメージングでは、細胞接着斑に密集するタンパク質が、どのように分布しているかは明らかにされていましたが、タンパク質間相互作用がどこで、どの程度起こっているかを一分子レベルの超高解像度で観察することはできませんでした。