2024-06-24 国立がん研究センター,神奈川県立がんセンター,リンクメッド株式会社,量子科学技術研究開発機構
発表のポイント
- 代表的な希少がん・難治性がんである、悪性神経膠腫・中枢神経系悪性リンパ腫、転移性脳腫瘍などの悪性脳腫瘍の患者さんを対象に、日本で開発された新規放射性治療薬 64Cu-diacetyl-bis(N4-methylthiosemicarbazone) (64Cu-Atsm)の第1相医師主導臨床試験(Star-64試験、試験番号Ncch1711)を完了し、その結果を米国臨床腫瘍学会(American Society of Clinical Oncology: Asco2024)で報告しました。
- 本試験の結果、安全性においては64Cu-Atsmの投与に起因する重篤な毒性兆候は観察されず、悪性脳腫瘍の患者さんに対する64Cu-Atsmの投与法として、99 Mbq/kgの7日ごとに4回の投与が推奨されると結論できました。
- 有効性においては64Cu-Atsmを投与した患者さん18人のうち14人(77.8%)が6か月以上、12人(66.7%)に1年以上生存されました。膠芽腫(こうがしゅ)注1の患者さんにおいては、9人のうち5人(55.6%)で1年以上生存されました。膠芽腫の患者さんは再発すると、一般的に1年以上生存される患者さんは30~40%であり、有効な治療効果が期待される可能性があると考えられました。
- 本試験の結果を受けて、悪性脳腫瘍の中でも最も治療の難しい再発・難治性の悪性神経膠腫の患者さんを対象に、64Cu-Atsmの治療によって、これまでの標準治療と比較して、生存期間を延長するかどうか検証するためのランダム化比較第3相医師主導治験(Step-64試験、試験番号Ncch2301)を本年6月から開始しました。Step-64試験は、脳腫瘍に対する日本発の放射線治療薬として64Cu-Atsmの承認を目指す試験となります。
- 本試験は、国立がん研究センター中央病院 臨床研究支援部門が支援し、国立研究開発法人日本医療研究開発機構(Amed)の研究費をもとに、第1相から第3相に進んだ初めての医師主導治験です。
概要
国立研究開発法人国立がん研究センター(理事長:中釜斉、東京都中央区)中央病院(病院長:瀬戸泰之)と神奈川県立病院機構 神奈川県立がんセンター(総長:古瀬純司、神奈川県横浜市)、リンクメッド株式会社(代表取締役社長:吉井幸恵、東京都中央区)、国立研究開発法人量子科学技術研究開発機構(理事長:小安重夫、千葉県千葉市)は、悪性脳腫瘍に対する新しい治療法として日本で開発された新規放射性治療薬剤 64Cu-Atsmの第1相医師主導治験を、初めて人へ投与するファースト・イン・ヒューマン試験として、標準治療終了後に再発した悪性脳腫瘍(悪性神経膠腫、原発性中枢神経系悪性リンパ腫、転移性脳腫瘍、悪性髄膜腫)の患者さんに対し2018年より実施し、同薬剤の安全性と有効性を評価しました。
本医師主導治験では、20人の患者さんを登録、19人の患者さんに64Cu-Atsm の用量を増やしながら投与を行い、その安全性を評価しました。その結果、64Cu-Atsmの投与に際して懸念される毒性兆候の発現頻度や重篤度が大きく高まることはみられず、悪性脳腫瘍の患者さんに対する64Cu-Atsmの投与法として、99 Mbq/kgの7日ごとに4回の投与が推奨されると結論しました。
また、64Cu-Atsmを投与した患者さん18人のうち14人(77.8%)に6か月以上、12人(66.7%)に1年以上の生存期間が確認されました。また、悪性脳腫瘍の中でも最も治療が難しいとされる膠芽腫(神経膠腫)の患者さんの場合、再発すると1年後に生存している割合は一般的に30~40%程度ですが、64Cu-Atsmを投与した膠芽腫の患者さん9人のうち5人(55.6%)に1年以上の生存期間が確認されました。これらのことから、64Cu-Atsmが悪性脳腫瘍に対して有効な治療効果が期待される可能性が示唆され、2024年6月1日の米国臨床腫瘍学会(Asco2024)で報告し、大きな注目を集めました。
研究チームは、第1相臨床試験の結果を踏まえ64Cu-Atsmの有効性をさらに検証するため、現在の既存の治療と生存期間等を比較する第3相医師主導治験(ランダム化比較試験)を2024年6月より開始しました。対象は、膠芽腫を含む、再発・難治性の悪性神経膠腫の患者さんです。
本試験で64Cu-Atsm の既存の治療に対する優位性が示された場合は、新たな標準治療として治療選択肢が増え、また日本初の国産放射性治療薬となることが期待されます。また、第1相臨床試験から第3相臨床試験へ進める薬剤は一般的には10~20%程度と言われるなか、アカデミアが開発した日本発の新規放射性薬剤で、国立研究開発法人日本医療研究開発機構(Amed)の支援をうけて第3相臨床試験まで進んだことは、今後の日本における様々ながんに対する治療薬の開発において開発環境と放射性薬の評価のあり方が整備され、多くの副産物や知的資産の蓄積を通じて本邦における新規放射性薬の開発力向上に資すると考えられます。
なお、本医師主導治験の第1相臨床試験は、国立研究開発法人日本医療研究開発機構(Amed)の革新的医療シーズ実用化研究事業並びに革新的がん医療実用化研究事業の支援を、また第3相臨床試験は、同機構の臨床試験・治験推進研究事業の支援を受けています。
背景
悪性脳腫瘍とその治療抵抗性について
脳から発生する原発性脳腫瘍は国内の年間発生数が約3万人で、そのうち約7,000人程度が悪性脳腫瘍(がん)です。脳腫瘍は分類が複雑ですが、悪性脳腫瘍の中でも、最も多い膠芽腫や星細胞腫などは悪性神経膠腫(グリオーマ)と呼ばれます。膠芽腫の年間発生数は約2,100人で、5年生存割合は約15%程度と、最も治療が難しいとされるがんのひとつです。膠芽腫を含む悪性脳腫瘍は代表的な希少がんかつ難治性がんで、治療開発が十分とは言えません。
悪性脳腫瘍の治療においては、既存の治療法(外科手術、放射線治療、化学療法等)で十分な効果が得られず再発した場合の治療法は確立していません。これは、悪性腫瘍は活発に増殖するため血管新生が追い付かず、酸素の供給が乏しい低酸素環境になるため、既存治療法の効果が弱まってしまうことが一つの重要な要因になっています。
放射性治療薬64Cu-Atsmについて
がん細胞は低酸素下でも生き延びることが特徴で、治療抵抗性の原因となってきました。国立がん研究センターと国立研究開発法人量子科学技術研究開発機構は、低酸素環境下の腫瘍細胞に高集積し、高い治療効果が期待できる放射性治療薬64Cu-Atsm[ 64Cu-diacetyl-bis(N4-methylthiosemicarbazone)の略]を共同開発し、非臨床試験に続き第1相臨床試験で検証を進めてきました。64Cu-Atsm: カッパーロクジュウヨンエーティーエスエム と読みます。
放射性核種64Cu は、既存の放射性治療薬(131I や 90Y、177Lu)で放出されるベータ線の他に、がん細胞 DNA を効果的に損傷する特殊な電子(オージェ電子)を放出するため、がん細胞に対し高い殺傷効果が期待できます(下図)。64Cu-Atsm 治療はこの新しいメカニズムで、低酸素化した治療抵抗性腫瘍を攻撃する治療法で、既存治療法で十分な効果が得られず再発した悪性脳腫瘍の治療において効果を発揮することが期待されます。
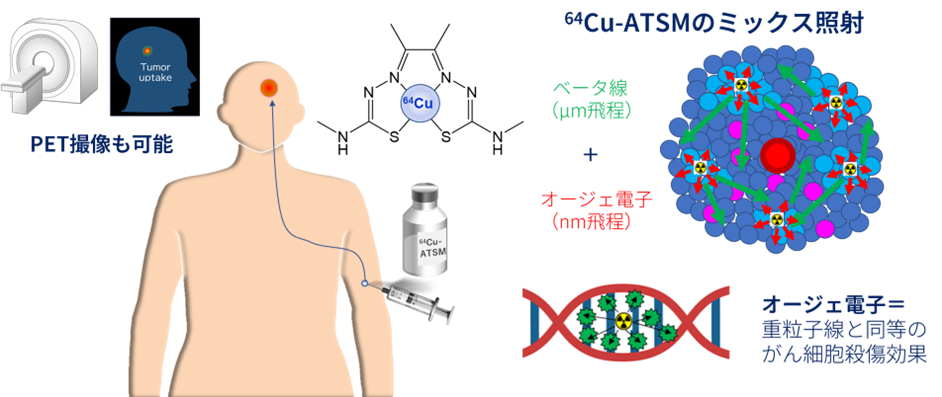
64Cu-Atsmで用いられている 64Cuは、銅の放射性同位体の一種で、ベータ線、オージェ電子並びにポジトロン(陽電子)を放出し、12.7時間で放射能が半分に減ります。ベータ線は、一般に最大飛程がミリメートルオーダーで従来の放射性治療薬に使用されます。オージェ電子は、一般に最大飛程がナノメートルオーダーと短いため薬剤のまわりに高いエネルギーを付与することにより、がん細胞DNAを効果的に損傷することができるため、がん細胞に対しアルファ線や重粒子線と同等の高い殺傷効果が期待できます。1個のがん細胞の大きさは、20マイクロメーター程度なので、薬剤が取り込まれがん細胞から発するベータ線やオージェ電子が、がん細胞周囲の正常細胞への影響は極めて少ないと考えられます。
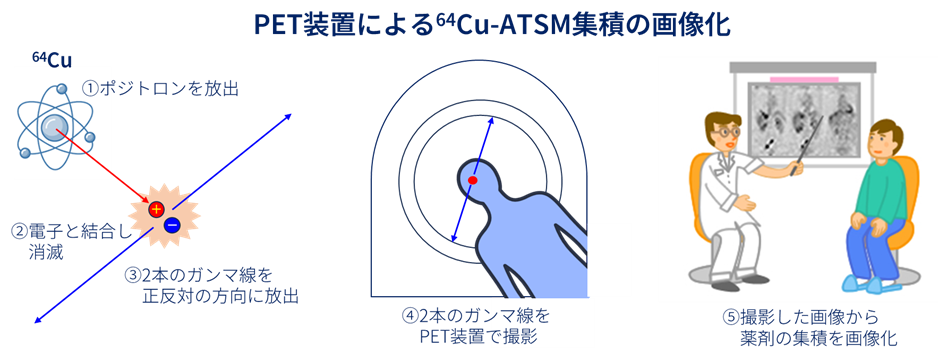
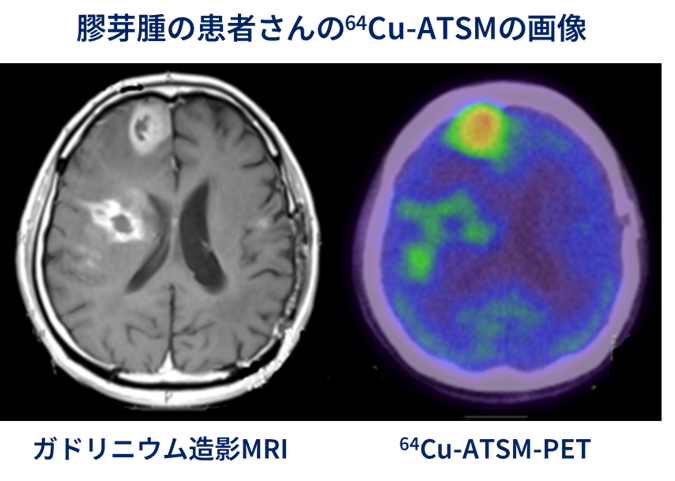
ポジトロンとは、負電荷を持つ電子の反対の粒子で、正電荷を持っています。ポジトロンと電子は互いに引き寄せられ、結合して消滅します。このときに、2 本のガンマ線を正反対の方向に放出します。この 2 本のガンマ線を陽電子放射断層撮影診断(PET)装置で検出することにより、薬剤の集積を画像化することができます(下図)。64Cu-Atsmは、PETで腫瘍への集積を見ながら治療ができるという極めてユニークな性質を有する薬剤です。
研究成果
第1相臨床試験(Star-64試験)の結果について
【試験名】
悪性脳腫瘍に対する治療用放射性薬剤64Cu-Atsmの至適投与量、投与方法を明らかにする安全性試験(試験番号:Ncch1711)
【試験期間】
2018年10月31日~2023年6月29日
【目的】
本試験は、多施設共同、単群、非盲検、用量漸増第1相試験であり、標準治療終了後の再発した悪性脳腫瘍患者さんを対象に、64Cu-Atsmの安全性評価を行い、最大耐用量及び第2相試験以降の推奨用量を決定することを目的としました。
【方法及び結果】
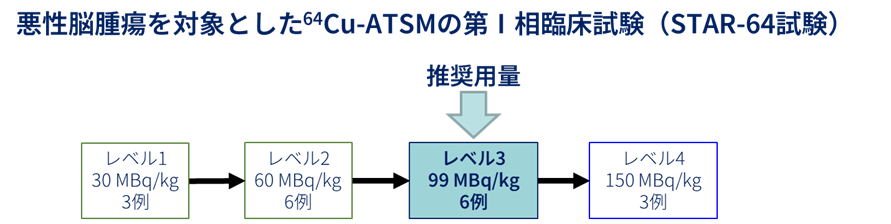
標準治療終了後に再発した悪性脳腫瘍(神経膠腫、中枢神経系原発悪性リンパ腫、転移性脳腫瘍、悪性髄膜腫)の患者さんのうち、予め定められた選択基準を満たし、除外基準にあたらない患者さんを登録し、64Cu-Atsmを体重1kgあたり1回30、60、99又は150 Mbqを静脈内にワンショットで投与、7日間隔で最大4回投与し、用量を制限する毒性兆候の発現割合を調べました。
その結果、64Cu-Atsmの投与に際し用量を制限する毒性兆候として一時的なリンパ球数の減少が観察されましたが、その発現頻度や重篤度は大きく懸念されるものではありませんでした。またリンパ球数の減少の他には64Cu-Atsmの投与に起因する重篤な毒性兆候は観察されず、新たに留意すべき事象も無いと考えられ、悪性脳腫瘍の患者さんに対する64Cu-Atsmの用量(注)として、99 Mbq/kgの7日ごと最大4回の投与が推奨されると結論できました。
また、64Cu-Atsmを投与した後にPET検査を行い、脳腫瘍の病変に対し64Cu-Atsmが集積していることを確認できました。さらに、有効性の評価対象となった患者さん18人のうち、14人について6か月以上、12人については1年以上の生存が確認されました。悪性脳腫瘍の中でも最も治療の難しい膠芽腫の患者さんは、再発すると1年後に生存している割合は30-40%程度です。今回再発した膠芽腫の患者さん9人に対して治療をおこない、1年以上生存された患者さんの生存割合は5人(55.6%)でした。これらのことから、64Cu-Atsmの投与により効果が得られる可能性が示唆されました。
(注) 64Cu-Atsmの用量は、第I相試験で99 Mbq/kgと決定しましたが、投与量は、99 Mbq/kg±5%とプロトコールで決めていましたので、第3相試験では、100 Mbq/kgとします。
【治験責任医師】
栗原 宏明(神奈川県立がんセンター 放射線診断・Ivr科 部長)
成田 善孝(国立がん研究センター中央病院 脳脊髄腫瘍科 科長)
【臨床研究実施計画・研究概要公開システム】
Jrct番号:Jrct 2091220362
本治験の詳細は、以下よりご確認ください
URL: https://jrct.mhlw.go.jp/latest-detail/Jrct2091220362
【参加施設】
国立がん研究センター中央病院
神奈川県立がんセンター
【学会情報】
学会名: 米国臨床腫瘍学会 American Society of Clinical Oncology (Asco)
会期、場所: 2024年5月31日~6月4日、シカゴにて
演題名: Pヘクタールse I clinical trial of 64Cu-Atsm for malignant brain tumors
演題番号: 2052
【研究費】
国立研究開発法人日本医療研究開発機構(Amed)
革新的医療シーズ実用化研究事業(平成29年度~平成31年度)
「日本発放射性薬剤64Cu-Atsm を用いた悪性脳腫瘍に対する 革新的治療法の開発研究」
研究代表者 国立がん研究センター中央病院 放射線診断科(当時) 栗原宏明
革新的がん医療実用化研究事業(令和2年度~令和4年度)
「難治性悪性脳腫瘍に対する日本発放射性薬剤64Cu-Atsmによる新治療法開発-早期承認を目指す第1相拡大コホート試験の実施」
研究代表者 神奈川県立がんセンター 放射線診断・Ivr科 栗原宏明
【治験薬提供者】
国立研究開発法人量子科学技術研究開発機構(以下、「Qst」)
国立がん研究センター中央病院 製造管理部門
今後の予定
第1相臨床試験の結果を受けて、膠芽腫を含む、再発・難治性の悪性神経膠腫の患者さんを対象に、64Cu-Atsmの治療による生存期間の延長効果を標準治療と比較検証するための第3相ランダム化医師主導治験(Step-64試験、試験番号Ncch2301)を2024年6月に開始しました。
【試験名】
再発悪性神経膠腫に対する治療用放射性薬剤64Cu-Atsmの有効性を検証するランダム化比較医師主導治験(試験番号:Ncch2301)
【目的】
再発・難治性悪性神経膠腫を対象に、64Cu-Atsmによる治療の全生存期間における優越性を、主治医の考える最良の既存治療(Best physician’s choice: Bpc)との非盲検ランダム化比較試験にて検証します。
【予定期間】
2024年6月から2029年3月
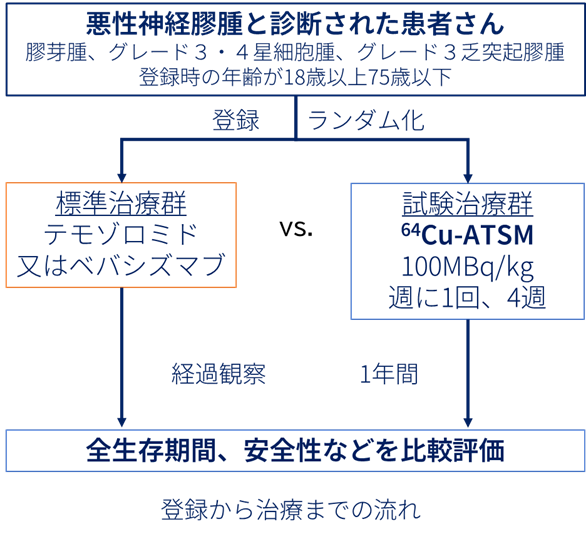
【方法】
病理診断により悪性・難治性神経膠腫(膠芽腫または、グレード3・4星細胞腫、グレード3乏突起膠腫)と診断された56人の患者さんを登録し、無作為化割付という方法により28人ずつ、64Cu-Atsm(試験治療群)あるいはBpc(標準治療群)のいずれの治療を受けて頂くかを決定します。試験治療群では64Cu-Atsm 100Mbq/kgを1週間に1回、最大4回まで静脈に投与します。標準治療群では、現在日本で再発神経膠腫に対して保険適用されているテモゾロミド又はベバシズマブから、担当医師が治療法を決定します。投与方法は、それぞれの薬の添付文書に従います。登録日から6週間ごとに画像検査を行い、1年間経過を観察、治療による全生存期間、無増悪生存期間、奏効率などの効果並びに安全性を比較します。
【対象となる患者さん】
本治験に参加できる条件および参加いただけない条件は以下のとおりです。
(参加できる主な条件)
- 病理診断により悪性神経膠腫(膠芽腫または、グレード3・4星細胞腫、グレード3乏突起膠腫)と診断されている
- 初発時および再発・増悪時のいずれにおいても、小脳・脳幹、下垂体、視神経、嗅神経のいずれにも腫瘍がなく、髄腔内播種もない
- 悪性神経膠腫の標準治療がすでに行われている。
- がん性髄膜炎、放射線治療や手術が必要な脊髄転移がない
- 18歳以上、75歳以下である
- 全身状態が良好で、日常生活に支障がない
- 血液検査(血球数、肝機能、腎機能など)や尿検査の値が一定の基準をみたしている
- この治験の参加に関して、患者さん本人から文書で同意が得られている
(参加いただけない主な条件)
- 登録前2年以内に他の悪性腫瘍の既往がある
- 治療が必要な感染症の合併がある
- 間質性肺炎又は肺線維症を合併または既往を有している
- 造影剤アレルギー等で造影MRIが実施できない
- 妊娠中または妊娠している可能性がある、もしくは授乳中である
- 3か月以内に症状のある脳梗塞もしくは心筋梗塞の既往がある
- その他、本治験への参加が困難であると担当医師により判断された
【予定登録患者数】
標準治療群と試験治療群それぞれ28名ずつ、合計56人の登録を予定しています。
【エンドポイント(評価項目)と臨床的仮説】
1.主要評価項目
全生存期間(overall survival:OS)
2.副次的評価項目
両群における以下の項目を評価します。
無増悪生存期間(再発までの期間)、奏効割合、有害事象(副作用)の発現割合、患者さんの神経学的・全身状態の非悪化割合
3.臨床的仮説
標準治療群(テモゾロミドまたはベバシズマブ)の1年生存割合を30%と仮定し、64Cu-Atsm群の1年生存割合が20%上回るかどうかを検証します(優越性試験デザイン)。
【治験実施施設】
国立がん研究センター中央病院
神奈川県立がんセンター
【治験責任医師】
成田善孝(国立がん研究センター中央病院 脳脊髄腫瘍科 科長)
栗原宏明(神奈川県立がんセンター 放射線診断・Ivr科 部長)
【研究費】
国立研究開発法人日本医療研究開発機構(Amed)
臨床試験・治験推進研究事業(令和5年度~令和8年度)
「再発・難治性悪性神経膠腫に対する治療用放射性薬剤64Cu-Atsmの有効性を検証する研究開発」
研究代表者 国立がん研究センター中央病院 脳脊髄腫瘍科 成田善孝
【治験薬提供者】
リンクメッド株式会社
リンクメッド株式会社は、Qstの研究成果の実用化を目指すQst認定ベンチャーとして、2022年7月4日に設立されました。同社は、Qstより64Cu-Atsmの開発を引き継いでおり、一日も早い実用化を目指します。
用語解説
注1 膠芽腫について
悪性脳腫瘍の中で最も多い脳腫瘍ですが、人口10万人あたりの年間発生数は2人程度ですが、高齢者に多い傾向にありますが、小児から成人まで幅広く発生します。標準治療は手術で摘出後に、放射線化学療法を行いますが、保険適用されている治療薬は、テモゾロミドとベバシズマブで、再発後の治療薬の開発が急務です。初発膠芽腫の2年生存割合は約40%程度と、膠芽腫は代表的な希少がんであり、難治性がんです。神経膠腫には膠芽腫のほかに、星細胞腫や乏突起膠腫があり、悪性度(グレード)が2-4に分類されます。膠芽腫や悪性度がグレード3・4の神経膠腫は、あわせて悪性神経膠腫と呼ばれます。
治験(臨床試験)について
治験とは、新薬について国の承認を得ることを目的として行う臨床試験のことです。臨床試験には、開発段階に応じ、第1相臨床試験(薬の安全性と投与量を調べることを目的とする試験)、第2相臨床試験(第1相で決定された投与量を用いて薬の有効性と安全性を確認する試験)、第3相臨床試験(第1相、第2相の結果を踏まえ、より多くの患者さんに参加していただく大規模試験)があります。抗がん剤の第1相臨床試験では、少数の患者さんで投与量を段階的に増やしていき、薬の安全性や推奨される投与量、投与方法などを調べます。第3相臨床試験では、より多くの患者さんを対象として現在行われている標準的な治療薬と治験薬の効果と安全性を比較して、優れているかどうかや劣っていないかどうかを検討します。一般的に第1相試験から第3相試験への移行は10~20%程度と言われています。
お問い合わせ先
治験について
国立研究開発法人国立がん研究センター中央病院
臨床研究支援部門 研究企画推進部 臨床研究支援室
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
地方独立行政法人 神奈川県立病院機構 神奈川県立がんセンター
総務企画課
リンクメッド株式会社
管理部
国立研究開発法人量子科学技術研究開発機構
国際・広報部 国際・広報課