2024-07-02 国立がん研究センター
発表のポイント
- 肺がんの多くを占める肺腺がんではEGFR、ALKなどの遺伝子の活性化変異に対する分子標的治療の登場により治療成績が向上しましたが、約30%の患者さんでは有効な治療薬の標的となる遺伝子変異が見つかっておらず、新たな治療標的を検出する革新的な解析方法が求められています。
- 分子標的治療の対象となる遺伝子変異が見つからない174例の肺腺がんについて、先駆的な全ゲノムシークエンス技術の統合解析を行いました。特に、今回行われたロボティクス技術を用いた大規模なクロマチン免疫沈降シークエンス解析は世界的にも先例のないものです。
- その結果、肺腺がんには、HER2(ERBB2)など治療標的として有望な遺伝子が存在することやこれまで判明していなかった新たな遺伝子が多く存在することを確認しました。
- 本研究方法は、新たな治療標的を見つけるための基盤となるもので、今後のがん個別化医療の発展をもたらすと期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜斉、東京都中央区)研究所(所長:間野博行)医療AI研究開発分野の金子修三ユニット長、浜本隆二分野長、中央病院(病院長:瀬戸泰之)、理化学研究所からなる研究チームは、治療標的となる遺伝子変異が見つからないため分子標的治療を行えない肺腺がん患者さんでの有効な治療法を見つけるため、全ゲノムシークエンス注1を用いた新たな解析手法を開発しました。また、この解析方法により、治療標的として有力なHER2注2をはじめとした既知のドライバー遺伝子注3やこれまで分かっていなかった新たな遺伝子が多く存在することを確認しました。さらに、このような遺伝子が過剰発現すると再発リスクが高まることを明らかにしました。
肺腺がんは、肺がんの中でも特に多く見られるがんで、EGFR、KRAS、ALKといった遺伝子変異に合わせた分子標的治療が多く行われます。しかし、全ての肺腺がんでこれらの変異が見つかるわけではなく、肺腺がんの約30%程度の患者さんでは治療薬の標的となる遺伝子変異が確認されません。
近年の全ゲノム配列決定技術の進歩により、遺伝子発現を乱すことが分かっており、遺伝子変異や構造変異を網羅的に解析することができる全ゲノムシークエンスを用いた病態の全容解明に期待が集まっていました。
研究チームが新たに開発した解析手法は、「スーパーエンハンサー注4」と呼ばれる特定の遺伝子発現を強力に促進するゲノム領域と、その構造変異を、全ゲノムシークエンスにより統合的に解析する方法で、さまざまながんの個別化医療の進展に寄与し、新たな治療標的や予後予測因子を見つけるための基盤となることが期待されます。
この研究成果は、国際学術雑誌「Molecular Cancer」オンライン版(6月11日付)に掲載されました。
背景
肺腺がんでは、EGFR、KRAS、ALKといった遺伝子の変異がよく見られます。これらはドライバー変異注5と呼ばれ、検査で遺伝子変異が見つかった場合は、その遺伝子変異を治療標的とした分子標的治療が選択されます。しかし、肺腺がんの約30%では有効な治療薬の標的となる変異が確認されていませんでした。このような臨床的に有効な遺伝子異常を持たない肺腺がんは、ドライバー遺伝子変異/転座陰性症例注6とも呼ばれ、肺腺がんのサブタイプを指します。分子標的治療薬での治療ができないため、新たな治療標的の検出方法や個別化医療の展開が求められています。
一方で、全ゲノムシークエンス技術の進歩により、新規の肺がん関連遺伝子変異や複雑なゲノム構造異常の調査が可能になりました。ゲノム構造異常は、コピー数変異(CNA)注7を引き起こし、遺伝子融合注8を生成し、ゲノム構造の破壊を通じて遺伝子発現を乱すなど、重要な事象として浮上しています。そのため、遺伝子変異や構造変異を網羅的に解析することができる全ゲノムシークエンスに基づいた構造異常の役割を特定することが求められていました。
研究成果
1.スーパーエンハンサー形成とゲノム構造異常によって引き起こされるドライバー変異の同定
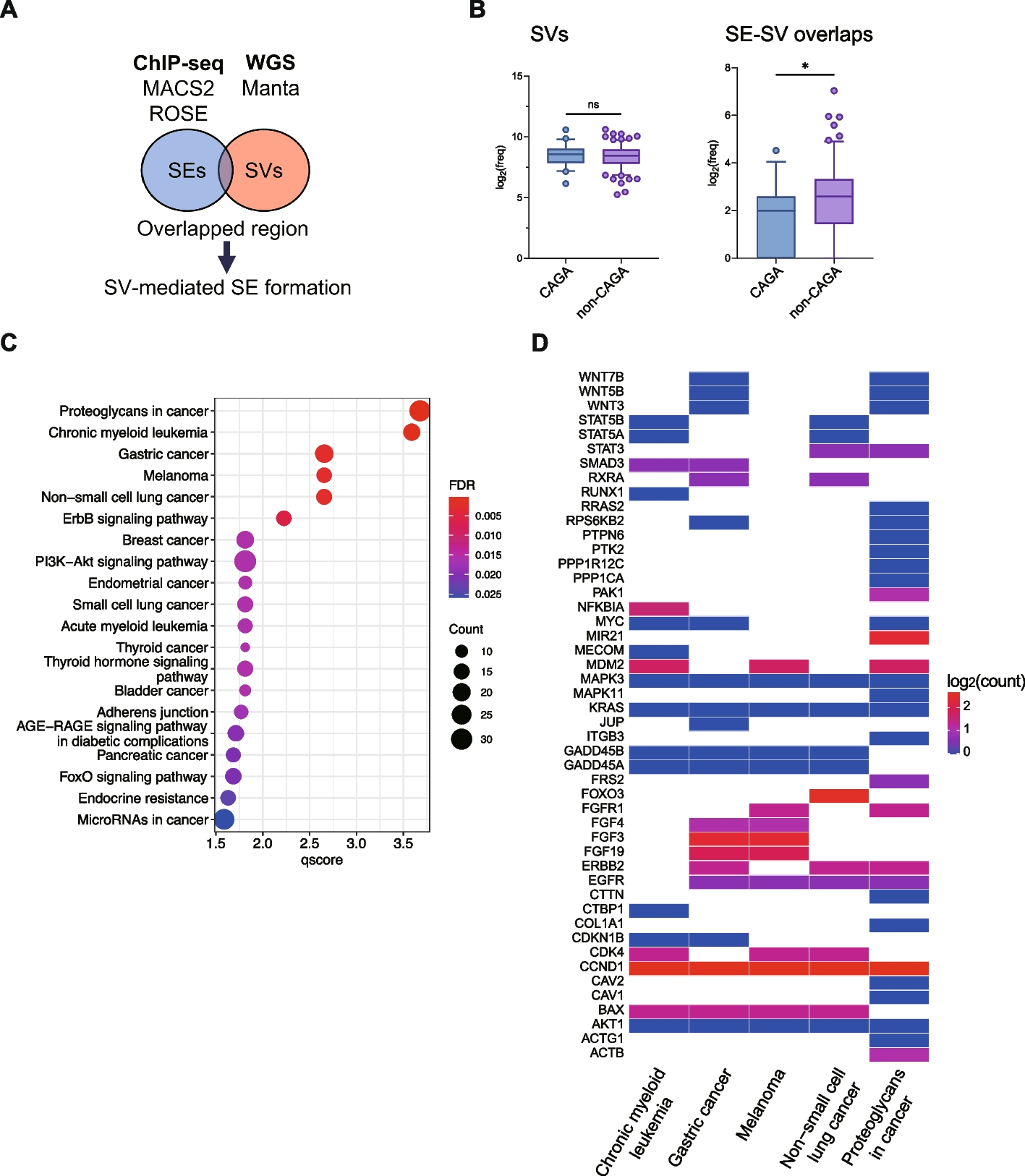
治療標的が確認されていない肺腺がん174例のサンプルを用いて、H3K27Ac注9と呼ばれるヒストン修飾に着目したクロマチン免疫沈降シークエンス(ChIP-seq)解析注10を行うことでスーパーエンハンサー領域を同定し、全ゲノムシークエンスとの統合解析を行いました。この研究では、スーパーエンハンサーとゲノム構造異常との相互作用が遺伝子発現の調節にどのように関与しているかを解析しました。その結果、これらの要素が共存しているゲノム領域は限られており、全体の約1%に過ぎませんでしたが、ドライバー遺伝子変異/転座陰性である肺腺がん症例の約40%でそのような領域が観察されました。特に、HER2やEGFRといった既知の肺がん関連遺伝子は、スーパーエンハンサーとゲノム構造異常が重複することによって、その発現が増加していることが確認されました。また、FRS2、CAV2、FGF3、FGF4、FGF19などの遺伝子も肺がんの原因遺伝子として機能する可能性が示唆されました(図1)。
図1:スーパーエンハンサーとゲノム構造変異の重複が見られる遺伝子群
ドライバー遺伝子変異/転座陰性である肺腺がんにおいて、
非小細胞肺がんのみならず、がん関連の多くのパスウェイに該当する遺伝子がリストされている。

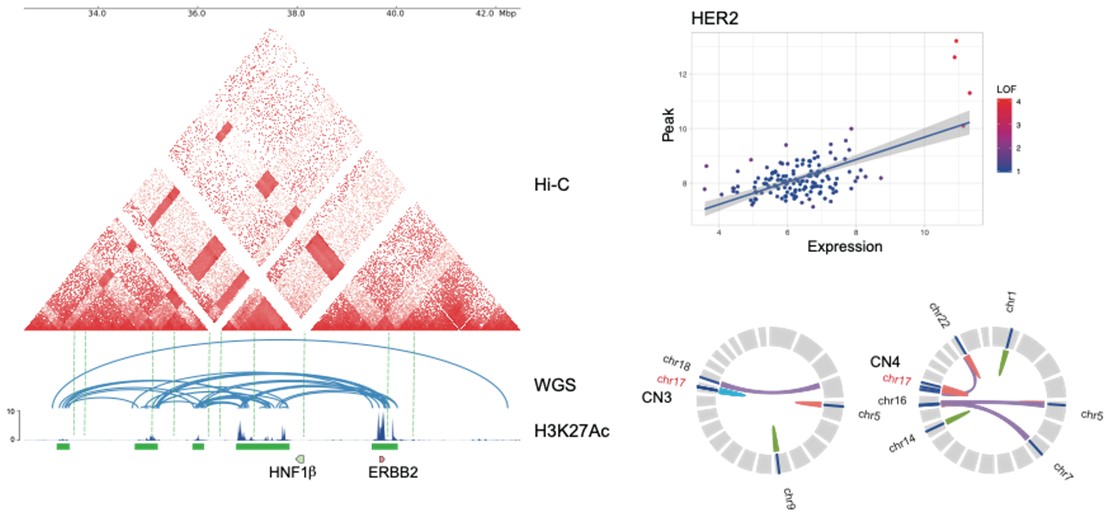
次に、培養細胞におけるCRISPR-Cas9注11を用いて、全ゲノムシークエンス、Hi-C解析注12、そしてロングリードシークエンス注13で特定されたゲノム構造異常の地点であるHER2遺伝子領域周辺で染色体逆位を誘導しました。この操作によりHER2の発現が増加することも観察され、これが遺伝子の発現調節におけるゲノム構造変化の重要性を示しました。さらに、スーパーエンハンサー領域と遺伝子発現とのリンク分析注14から抽出された過剰発現遺伝子を持つ肺腺がんの症例では、これらを持たない肺腺がんの症例と比較して、再発リスクが有意に高まることが示されました。これらの結果は、ChIP-seqと全ゲノムシークエンスの統合解析が、肺腺がんの術後を予測する上で臨床的に重要な因子を提供することを示唆しています(図2)。これらの分析により、特定の遺伝子群が肺腺がんの進行や治療応答にどのように影響を与えるかの理解が深まります。
2.ロボティクス技術を駆使した大規模ChIP-seq解析
今回の研究において、ロボティクス技術を活用したChIP-seq解析を導入しました。ChIP-seq解析は煩雑な実験手順を要するため、特に臨床検体を用いた大規模な実施が困難でした。この問題を克服するために、ヒューマノイドロボット(ヒト型ロボット)を用いて、人間の手を介さない自動化処理を進め、多検体同時処理を行いました。ロボット筐体にはLabDroid「まほろ」注15を採用し、自動化されたプログラムで柔軟な動きが可能な双腕を備えています。これにより、人間の実験操作をそのまま模倣することができます。このため、あらかじめ定義された動作の組み合わせを使用することで、再現性を持つ大規模な医学研究に使用することができます。
図2:全ゲノムシークエンス、ChIP-seq、Hi-Cを用いた統合解析
HER2遺伝子の周辺領域におけるスーパーエンハンサーの形成や構造変異を、
全ゲノムシークエンス、ChIP-seq、およびHi-C解析を用いて統合的に解析することで、
HER2の遺伝子発現におけるエピジェネティクスとゲノム構造の相互作用が明らかにすることが可能(左)。
HER2遺伝子におけるスーパーエンハンサーと遺伝子発現とのリンク分析(右上)。
個々の肺腺がん症例におけるスーパーエンハンサーの形成と構造変異の俯瞰図(右下)。
展望
本研究により、エピジェネティクスとゲノム構造の関係を解明するための新しい解析手法が確立されました。これにより、特にドライバー遺伝子変異/転座陰性である肺腺がん症例における新しい治療標的の発見が期待されます。また、ロボティクス技術を活用した自動化プロセスにより、大規模かつ高精度なデータ取得が可能となり、今後の個別化医療の進展に寄与することが期待されます。これらの成果は、がん治療の新しいアプローチを提供し、患者の予後改善に繋がることが期待されます。
発表論文
雑誌名
Molecular Cancer
タイトル
Mechanism of ERBB2 gene overexpression by the formation of super-enhancer with genomic structural abnormalities in lung adenocarcinoma without clinically actionable genetic alterations
著者
Syuzo Kaneko (* Corresponding Author), Ken Takasawa, Ken Asada, Kouya Shiraishi, Noriko Ikawa, Hidenori Machino, Norio Shinkai, Maiko Matsuda, Mari Masuda, Shungo Adachi, Satoshi Takahashi, Kazuma Kobayashi, Nobuji Kouno, Amina Bolatkan, Masaaki Komatsu, Masayoshi Yamada, Mototaka Miyake, Hirokazu Watanabe, Akiko Tateishi, Takaaki Mizuno, Yu Okubo, Masami Mukai, Tatsuya Yoshida, Yukihiro Yoshida, Hidehito Horinouchi, Shun-Ichi Watanabe, Yuichiro Ohe, Yasushi Yatabe, Vassiliki Saloura, Takashi Kohno, Ryuji Hamamoto (* Corresponding Author)
掲載日
2024年6月11日付(オンライン・プレ・リリース)
DOI
10.1186/s12943-024-02035-6
研究費
- 科学技術振興機構(JST)・AIPプロジェクト(AIP-PRISM)「人工知能技術を活用した革新的ながん創薬システムの開発」(研究代表者名: 浜本 隆二)
- 日本医療研究開発機構(AMED)・革新的がん医療実用化研究事業「機械学習/深層学習技術を活用したpan-negative肺がん症例のバイオマーカー探索と臨床的有用性の検証」(研究代表者名: 浜本 隆二)
- 日本学術振興会・科学研究費助成事業 基盤研究(B)(一般)「臨床応用を志向した自律型エピジェネティクス解析の確立」(研究代表者名:金子 修三)
- 高松宮妃癌研究基金・研究助成「多層的エピゲノム解析に基づいた精密がん医療予測モデルの確立」(研究代表者名: 金子 修三)
発表者
- 国立がん研究センター
研究所 医療AI研究開発分野:金子修三(筆頭著者、責任著者)、井川典子、
小林和馬、河野伸次、浜本隆二(責任著者)
ゲノム生物学研究分野:白石航也、松田麻衣子、河野隆志
プロテオーム解析部門:増田万里、足達俊吾
中央病院 呼吸器内科:立石晶子、水野孝昭、吉田達哉、堀之内秀仁、大江裕一郎
呼吸器外科:大久保祐、吉田幸弘、渡辺俊一
放射線診断科:三宅基隆、渡辺裕一
病理診断科:谷田部恭
医療情報部:向井まさみ
内視鏡科:山田真善
- 理化学研究所革新知能統合研究センター
がん探索医療研究チーム:高澤建、浅田健、町野英徳、新海典夫、高橋慧、Bolatkan Amina、小松正明、浜本隆二(併任)
- 米国国立がん研究所
Saloura Vassiliki
用語解説
注1 全ゲノムシークエンス
全ゲノムシークエンス(Whole Genome Sequencing, WGS)は、生物の全DNA配列を解読する技術です。これにより、遺伝子変異や構造変異を網羅的に解析することができます。
注2 HER2
HER2(Human Epidermal Growth Factor Receptor 2)は、細胞の増殖と分化に関与する受容体型チロシンキナーゼです。特に乳がんや肺がんにおいて過剰発現が見られ、治療のターゲットとなることが多いです。ERBB2とも呼ばれます。
注3 ドライバー遺伝子
ドライバー遺伝子は、がんの発生と進行に直接関与する遺伝子で、その変異はがん細胞の成長と生存に必要です。これらの遺伝子は治療標的として重要です。
注4 スーパーエンハンサー
スーパーエンハンサーは、通常のエンハンサーに比べて強力な転写活性を持つDNA領域で、遺伝子発現の調節において重要な役割を果たします。特に発がん遺伝子や細胞の分化に関与する遺伝子の発現に強く関与しています。
注5 ドライバー変異
ドライバー変異は、ドライバー遺伝子に生じた変異で、がんの発生や進行を引き起こす役割を持ちます。これに対して、パッセンジャー変異はがんの発生に直接関与しません。
注6 ドライバー遺伝子変異/転座陰性症例
ドライバー遺伝子変異/転座陰性症例はPan-negative症例とも呼ばれ、臨床的に有効な遺伝子異常(CAGA: Clinically Actionable Genetic Alteration)を持たない肺腺がんのサブタイプを指します。CAGAとは異なる特徴を持ち、従来の治療法が適用できないため、異なる治療法が必要となる場合があります。このため、ドライバー遺伝子変異/転座陰性である肺腺がん症例に対しては、新たな治療標的の発見や個別化医療の展開が求められています。
注7 コピー数変異(CNA)
コピー数変異(Copy Number Alteration, CNA)は、ゲノムの特定の領域で遺伝子のコピー数が増減する現象です。がんなどの疾患でよく見られ、遺伝子の過剰発現や欠失を引き起こします。
注8 遺伝子融合
遺伝子融合は、二つの異なる遺伝子が一つに結合することで、新たな遺伝子産物を生成する現象です。これにより、異常なタンパク質が生成されることがあり、がんの発生に関与することがあります。
注9 H3K27Ac
H3K27Acは、ヒストンH3の27番目のリジン残基がアセチル化された修飾です。この修飾は、アクティブなエンハンサー領域を示し、遺伝子の転写活性を示すマーカーとして使用されます。
注10 ChIP-seq
ChIP-seq(Chromatin Immunoprecipitation Sequencing)は、クロマチン免疫沈降法と次世代シーケンシングを組み合わせた手法で、DNAと結合しているタンパク質の結合部位を全ゲノムスケールで解析する技術です。
注11 CRISPR-Cas9
CRISPR-Cas9は、特定のDNA配列を切断することができる遺伝子編集技術です。この技術を用いることで、遺伝子の修正や機能解析が可能となります。
注12 Hi-C解析
Hi-C解析は、ゲノムの3次元構造を解析する手法で、DNAの遠隔相互作用をマッピングすることができます。これにより、遺伝子発現調節や構造異常の理解が進みます。
注13 ロングリードシークエンス
ロングリードシークエンスは、長いDNAフラグメントをシーケンシングする技術で、複雑なゲノム領域の解析に有利です。これにより、構造変異や繰り返し領域の詳細な解析が可能となります。
注14 スーパーエンハンサー領域と遺伝子発現とのリンク分析
スーパーエンハンサー領域と遺伝子発現とのリンク分析は、スーパーエンハンサーが特定の遺伝子の発現にどのように影響するかを解析する手法です。これにより、エピジェネティクスの役割を解明します。
注15 LabDroid「まほろ」
LabDroid「まほろ」は、産業用ロボットで、複雑な実験操作を自動化するために開発されました。双腕を持ち、人間の実験操作を模倣し、高精度で再現性のある結果を提供します。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター
研究所 医療AI研究開発分野
ユニット長 金子 修三
分野長 浜本 隆二
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室