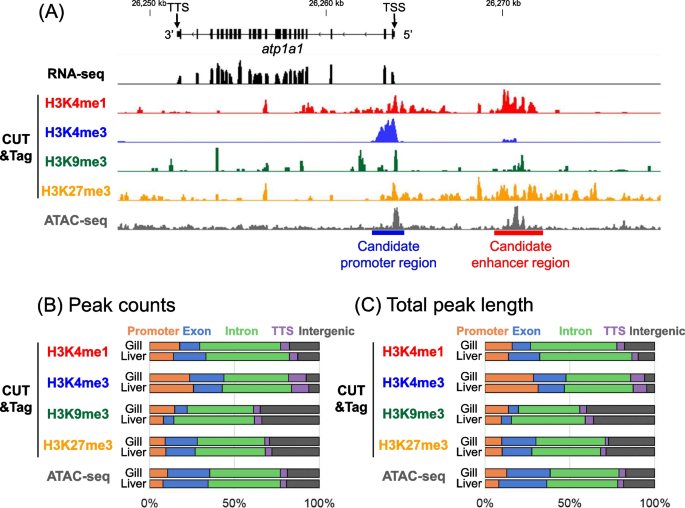
2024-07-12 京都大学iPS細胞研究所
ポイント
- マイクロ流体デバイスを用いて、間質流を再現しながらヒトiPS/ES細胞を分化誘導できるシステムを構築した。
- 本システムで構築した小腸モデル(マイクロ小腸システム)は、粘液層や上皮層、間質層などから構成されており、小腸の多層構造を再現できる。
1. 要旨
出口清香特定助教、高山和雄講師(CiRA増殖分化機構研究部門)らの研究グループは、マイクロ流体デバイス注1)を用いて間質流注2)を再現することで、ヒト多能性幹細胞(iPS/ES細胞)注3)から、小腸における多層構造を持つモデルを開発することに成功しました。
ヒトiPS/ES細胞から小腸上皮細胞を分化誘導する試みが過去に多数行われてきましたが、小腸の構造的および機能的な特性を再現することは依然として困難でした。研究グループは、胚発生中において血流から駆動される間質流が小腸の分化誘導に必須の因子であると考え、間質流をin vitro 注4)で再現することで成熟した小腸モデルの構築を目指しました。マイクロ流体デバイス内で培地を灌流(かんりゅう)注5)することで間質流を再現し、ヒトiPS/ES細胞から小腸上皮細胞や間質細胞などの小腸を構成する多種類の細胞を同時に分化誘導することで、マイクロ小腸システムを開発しました。間質流の作用により小腸上皮細胞は成熟化し、粘液分泌および柔毛様構造の形成が確認されました。小腸上皮細胞を支える間質層は、上皮層の下層に整列しており、小腸組織様の多層構造が形成されました。機能的および構造的に成熟したマイクロ小腸システムは、創薬研究や疾患研究への応用が期待されます。
この研究成果は2024年7月12日午前0時(米国東部時間7月11日午前11時)に「Cell Stem Cell」で公開されました。
2. 研究の背景
ヒト多能性幹細胞(iPS細胞やES細胞)から体細胞を分化誘導するためには、胚発生における細胞環境をin vitroで模倣することが重要です。ヒトiPS/ES細胞から小腸への分化誘導においても、様々な増殖因子の組み合わせが検討され、成熟化が試みられてきました。しかし、依然として小腸の複雑な構造および機能を再現することは困難でした。
小腸は、粘液層と上皮層、間質層が層状に整列した構造を有しています。これまで開発されてきたin vitro小腸モデルの多くは小腸上皮細胞が並ぶ上皮層のみから構成されており、小腸上皮細胞を支える間質層は存在しませんでした。また、過去の小腸モデルに含まれる小腸上皮細胞は未熟であり、小腸上皮細胞から分泌される粘液の層の形成も十分にみられませんでした。
間質流とは、血管から染み出した血漿(けっしょう)成分が間質液となって形成する、間質中の体液の緩やかな流れです。発生過程では、小腸の基底側に動脈が接続しており、小腸を構成する細胞は間質流に晒されています。そのため研究グループは、間質流が小腸発生に重要な刺激ではないかと考えました。本研究では、発生過程での間質流をin vitroで模倣することで、ヒトiPS/ES細胞から小腸モデルの構築を試みました。
3. 研究結果
1. マイクロ流体デバイスを用いた間質流の再現
間質流をin vitroで再現するため、3.0 μmの微細孔を持つ多孔質膜で上下に仕切られた流路を持つマイクロ流体デバイスを用いました(図1A)。マイクロ流体デバイス内を流れる液体の数値シミュレーションを行ったところ、下部流路の培地を灌流することで、培地が多孔質膜の微細孔を通って下部流路から上部流路に垂直方向に染み出すことがわかりました(図1B)。さらに、下部流路の培地の灌流速度を最適化することで、生体内の緩やかな体液流である間質流と同等の速度および方向の流れを再現できました。
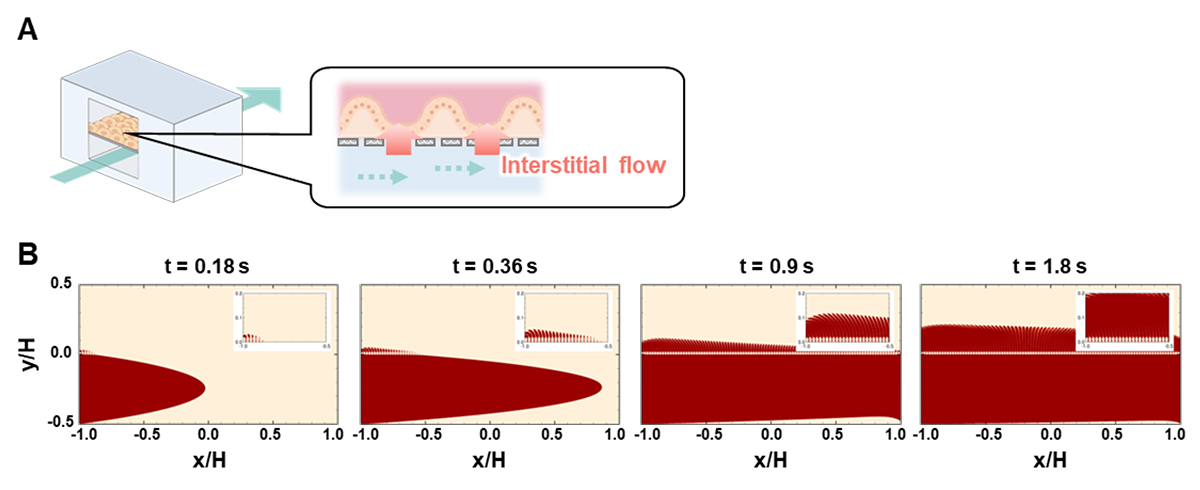 図1 マイクロ流体デバイスを用いた間質流の再現
図1 マイクロ流体デバイスを用いた間質流の再現
(A)本研究で用いたマイクロ流体デバイスおよび間質流のイラスト。(B)マイクロ流体デバイスの下部流路に培地灌流を行った際の、マイクロ流体デバイス内の流体の数値シミュレーションの結果。赤い部分が流した液体を示す。下部流路(y/Hがマイナスの値の部分)に左から右へと灌流している。上部流路には垂直方向の流れが存在している。
2. マイクロ小腸システムの構築
マイクロ流体デバイスの上部流路にヒトiPS/ES細胞を播種(はしゅ)注6)し、下部流路の培地を低速灌流しながら小腸への分化誘導を行うことで、小腸モデル「マイクロ小腸システム」を作製しました。組織学的解析により、間質流を作用しながらヒトiPS/ES細胞を分化誘導することで、絨毛(じゅうもう)様に隆起した三次元構造を有する上皮層が構築できました(図2A)。上皮層の下層には間質層が整列し、多層構造を成すことがわかりました。また、電子顕微鏡解析により、間質流を作用したマイクロ小腸システムでは、表面に微絨毛を持つ円柱状の均一な小腸上皮細胞が観察されました(図2B: Flow)。このように形態的に成熟した小腸上皮細胞は、静止培養を行った群(図2B: Static)では観察できませんでした。
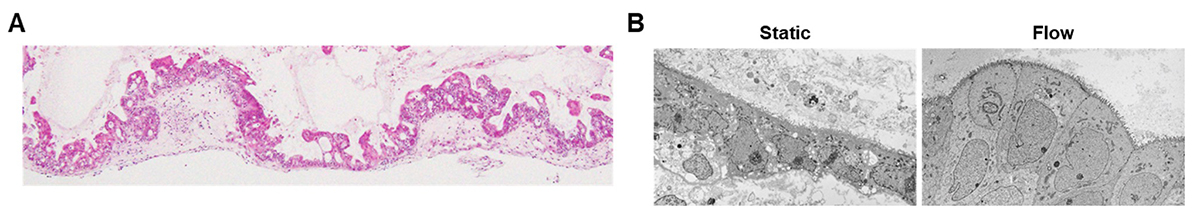 図2 マイクロ小腸システムの組織学的解析
図2 マイクロ小腸システムの組織学的解析
(A)間質流を作用しながらヒトiPS/ES細胞を分化誘導したマイクロ小腸システムのH&E染色像。(B)電子顕微鏡解析の結果。Static: 間質流なし、Flow: 間質流あり。
3. 間質流がマイクロ小腸システムの小腸上皮細胞分化に及ぼす影響の解明
小腸は吸収上皮細胞や杯細胞(mucin 2: MUC2)、パネート細胞(lysozyme: LYZ)等の複数種類の上皮細胞から構成されています。また、小腸上皮細胞のマーカーであるvillin 1(VIL1)が頂端側に局在するなどの極性が見られます。こうした多様な小腸上皮細胞がマイクロ小腸システムにも存在するかどうかを調べるために、小腸上皮細胞の代表的なマーカータンパク質の発現を調べました(図3A)。間質流の存在下では、小腸上皮細胞マーカー(VIL1)がより強く観察されました。VIL1は特にマイクロ小腸システムの頂端側に局在しており、極性を持った細胞が構築できたことがわかりました。杯細胞やパネート細胞も間質流の存在下で数多く確認されました。さらに、in situ ハイブリダイゼーション法注7)により、間質流を作用したマイクロ小腸システムにおいて吸収上皮細胞マーカー(solute carrier family 26 member 2: SLC26A2)や幹細胞マーカー(leucine rich repeat containing G protein-coupled receptor 5: LGR5)、bestrophin 4(BEST4)を発現する細胞を確認しました(図3B)。さらに、間質流を作用したマイクロ小腸システムでは、杯細胞から分泌される粘液層の主成分であるムチンが蓄積していました(図3C)。これらの結果は、間質流が小腸としての成熟化を促進したことを示唆しています。
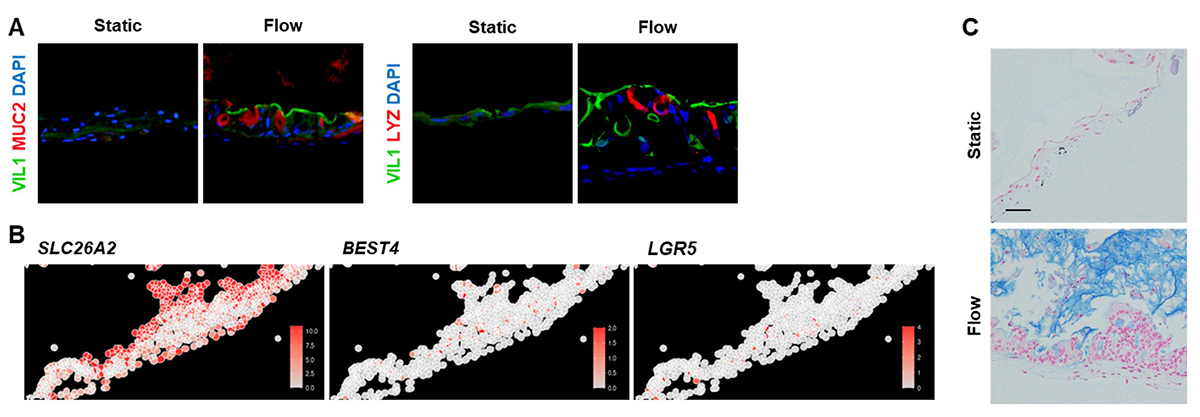
図3 マイクロ小腸システムにおける小腸上皮細胞の成熟化
(A)マイクロ小腸システムにおける小腸上皮細胞マーカーの蛍光染色の結果。VIL1: 小腸上皮細胞、MUC2: 杯細胞、LYZ: パネート細胞、DAPI: 細胞核。(B)間質流を作用したマイクロ小腸システムにおけるin situ ハイブリダイゼーションの結果。(C)マイクロ小腸システムにおけるアルシアンブルー染色。粘液が青色に染色された。Static: 間質流なし。Flow: 間質流あり。
4. 間質流がマイクロ小腸システムの線維芽細胞に及ぼす影響の解明
小腸における上皮細胞の維持および分化は、間質細胞の一種である線維芽細胞注8)によって支持されています。そこで、マイクロ小腸システムにおける線維芽細胞の特徴を調べました。線維芽細胞マーカーであるvimentin(VIM)は、間質流に応答して基底側へ局在しました(図4A)。静止培養を行ったモデルでは、線維芽細胞は配向せず、ランダムに配置していました。これら線維芽細胞が分泌する細胞外マトリックスの一種であるコラーゲン線維も、基底側に局在していました(図4B)。これらの結果より、小腸上皮細胞を支える線維芽細胞の局在が間質流によって変化したことがわかりました。
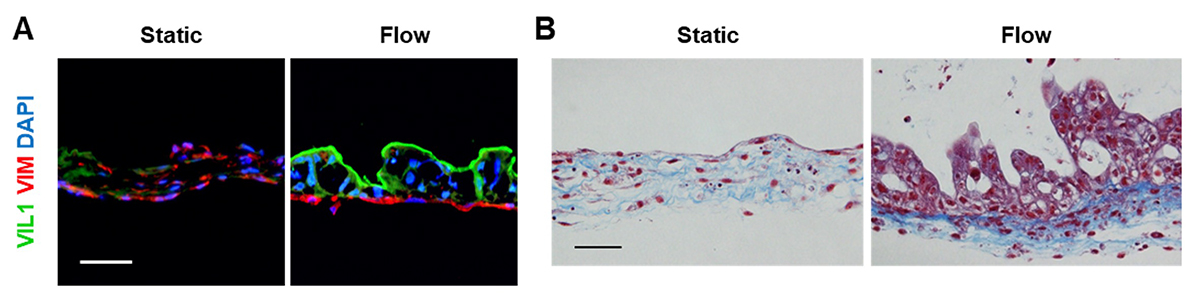
図4 マイクロ小腸システムにおける線維芽細胞の局在
(A)マイクロ小腸システムにおける蛍光染色の結果。VIL1: 吸収上皮細胞、VIM: 線維芽細胞、DAPI: 細胞核。(B)マイクロ小腸システムにおけるマッソントリクローム染色の結果。コラーゲン線維が青色に、細胞質が赤色に染色された。Static: 間質流なし。Flow: 間質流あり。
5. 薬物動態研究および感染症研究へのマイクロ小腸システムの応用
開発したマイクロ小腸システムの応用可能性を確認するため、薬物代謝実験およびウイルス感染実験を行いました。マイクロ小腸システムを用いて、小腸で高発現する薬物代謝酵素cytochrome P450 family 3 subfamily A member 4(CYP3A4)の活性を測定しました。その結果、間質流を作用したマイクロ小腸システムは、高いCYP3A4活性を有することがわかりました(図5A)。また、ヒトコロナウイルスの一種であるhuman coronavirus 229E(HCoV-229E)は、alanyl aminopeptidase, membrane(ANPEP)というタンパク質を感染受容体として小腸に感染します。マイクロ小腸システムにおけるANPEPの発現パターンを確認したところ、間質流を作用したモデルでは、生体小腸と同様に、小腸上皮細胞の頂端側に局在していました(図5B)。実際に感染実験を行ったところ、感染受容体を発現する頂端側からウイルスを作用した方が、受容体を発現しない基底側から作用するよりも、HCoV-229Eが効率よく感染しました(図5C)。以上の検討により、マイクロ小腸システムは小腸の薬物動態試験や感染症研究に応用可能であることが示唆されました。

図5 マイクロ小腸システムを用いた薬物代謝酵素活性試験およびウイルス感染実験
(A)マイクロ小腸システムにおけるCYP3A4活性。マイクロ小腸システムにCYP3A4基質であるトリアゾラムを作用し、その代謝物であるα-水酸化体(OH-triazolam)の量をLC-MS/MSにより測定した。(B)マイクロ小腸システムにおけるHCoV-229E感染受容体ANPEPの蛍光染色の結果。ANPEP: HCoV-229E感染受容体、VIM: 線維芽細胞、DAPI: 細胞核。(C)間質流を作用したマイクロ小腸システムの頂端側(Apical)または基底側(Basolateral)からHCoV-229Eを感染し、細胞内のウイルスmRNA量を測定した。Static: 間質流なし。Flow: 間質流あり。
4. まとめと展望
今回の研究は、マイクロ流体デバイスを用いることでin vitroで間質流の再現を実現しました。間質流の存在下でヒトiPS/ES細胞から小腸上皮細胞および間質細胞を同時に誘導することで、生体小腸に類似した多層構造を有した小腸組織モデル「マイクロ小腸システム」を作製できました。研究チームは本モデルが、腸疾患研究やそれらに対する新薬開発に貢献することを期待しています。
5. 論文名と著者
- 論文名
Construction of multilayered micro-small intestine-like tissue by reproducing interstitial flow - ジャーナル名
Cell Stem Cell - 著者
Sayaka Deguchi1,*, Kaori Kosugi1, Naoki Takeishi2, Yukio Watanabe1, Shiho Morimoto1, Ryosuke Negoro3, Fuki Yokoi1,4, Hiroki Futatsusako1,4, May Nakajima-Koyama1, Mio Iwasaki1, Takuya Yamamoto1,5,6, Yoshiya Kawaguchi1, Yu-suke Torisawa7, Kazuo Takayama1,8*
* 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都工芸繊維大学 機械工学系
- 立命館大学 薬学部
- 京都大学 大学院医学研究科
- 京都大学 ヒト生物学高等研究拠点(WPI-ASHBi)
- 理化学研究所 革新知能統合研究センター(AIP)
- 京都大学 大学院工学研究科
- 日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 京都大学iPS細胞研究基金
- 科学技術振興機構(JST)ACT-X(JPMJAX222A)
- 日本学術振興会 科研費(JP20H04504)
- 日本医療研究開発機構(AMED)(JP21gm1610005, JP23bm1323001, JP23jf0126002)
7. 用語説明
注1)マイクロ流体デバイス
微小流路を持つ細胞培養装置。微細流路の幅および深さは、自在に設計することができる。
注2)間質流
血管が隣接する組織に生じる緩やかな体液の流れ。血管から染み出した血漿成分が間質液と混ざって作流れている。間質流の流速は、血流に比べて非常に遅い。
注3)多能性幹細胞(iPS/ES細胞)
自己増殖能力と様々な種類の細胞へと分化する能力を持つ細胞。この研究ではiPS細胞(induced pluripotent stem cell)およびES細胞(embryonic stem cell)をどちらも用いて実験を行った。
注4)in vitro
培養皿やマイクロ流体デバイスなどの人工的な環境で行われた細胞培養実験のこと。
注5)灌流
細胞や組織、臓器などに培養液などの液体を流すこと。
注6)播種
細胞を培養皿などにまくこと。
注7)in situ ハイブリダイゼーション
細胞などのなかにある特定のRNAの量と位置を測定する方法。
注8)線維芽細胞
多くの臓器に存在する。何らかの損傷により組織に傷が生じると、この細胞が増殖する。