多種多様な植物形質転換体の作出に期待
2019-01-22 理化学研究所,科学技術振興機構
理化学研究所(理研) 環境資源科学研究センター バイオ高分子研究チームの緑川 景子 特別研究員、児玉 豊 客員研究員(宇都宮大学 バイオサイエンス教育研究センター 准教授)、沼田 圭司 チームリーダーらの研究チームは、非ウイルス性遺伝子キャリアとして注目されるペプチドを用いた遺伝子送達システムの植物組織への侵入経路を明らかにしました。
本研究成果は、これまで形質転換注1)が難しかった植物種の細胞への遺伝子送達に適した効果的な標的組織の決定に指針を与えるものです。今後はペプチドによる遺伝子送達効率を向上させ、多種多様な植物形質転換体の作出につながると期待できます。
今回、研究チームは、さまざまな植物細胞に侵入する細胞膜透過性ペプチド(CPP)注2)とポリカチオン性ペプチド注3)からなる融合ペプチドと、プラスミドDNA注4)の複合体を用いて、異なる植物種への遺伝子送達経路を比較しました。その結果、この複合体はタバコでは根毛、シロイヌナズナでは葉の水孔注5)から取り込まれることを見いだし、植物種によってペプチドの侵入経路が異なっている可能性があることが分かりました。タバコの根毛を形成する細胞やシロイヌナズナの水孔を形成する細胞は、他の組織と比較して薄い細胞壁で構成されており、構造的に弱いことが知られています。このことから、構造的に脆弱な細胞に融合ペプチドが取り込まれやすいことが明らかとなりました。
本研究は、2019年1月22日(英国時間)に英国のオンライン科学雑誌「Scientific Reports」に掲載されます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 総括実施型研究 ERATO「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田 圭司)」による支援を受けて行われました。
<背景>
動物および植物細胞への遺伝子送達システムのためのウイルスベクター注6)の代替法として、非ウイルス性の遺伝子キャリアは幅広く研究されています。非ウイルス性キャリアは、正に帯電したさまざまな化合物(例えばカチオン性リポソーム注7)またはポリマー)を使用して、プラスミドDNAを凝縮し、細胞内へ輸送します。これまで、研究チームは細胞膜透過性ペプチド(CPP)とポリカチオン性ペプチドからなる融合ペプチドを使用した、植物細胞用の遺伝子送達システム(ペプチド法)を開発してきました。
現在、植物の形質転換体の作出に汎用されている細菌を用いた方法は、適用できる植物種が限られ、かつ核ゲノムの改変に限定されており、ミトコンドリアゲノムや葉緑体ゲノムなどオルガネラゲノムの改変には適用できないという制約がありました。そのため、研究チームが開発してきたペプチド法は、従来の形質転換技術が持つこれらの問題を克服する代替法として期待されています。
しかし、本法は従来法に比べ、細胞内への遺伝子送達効率が低いことが課題となっていました。本法の実用化のためには、遺伝子送達効率のさらなる向上が必要であり、そのためには形質転換を行いたい植物に応じて「ペプチド-プラスミドDNA複合体」の導入に適した植物組織を選択することが重要になります。しかし、複合体の植物細胞への取り込みやその侵入経路はよく理解されていませんでした。
<研究手法と成果>
研究チームはまず、細胞膜透過性ペプチドとDNAとの相互作用が期待されるポリカチオン性ペプチドからなる融合ペプチドとレポーター遺伝子注8)として、発光酵素であるルシフェラーゼをコードする遺伝子を挿入したプラスミドDNAからなる「ペプチド-プラスミドDNA複合体」を作製しました。複合体は、無傷の植物体全体へ適用するために、脱気・加圧処理によって導入しました。その後、この複合体が細胞内に到達すると、ルシフェラーゼが発現されることを利用し、シロイヌナズナとタバコについて地下部と地上部における送達効率を比較しました。その結果、タバコでは地下部(根)、シロイヌナズナでは地上部(茎と葉)から複合体が取り込まれやすいということが分かりました。
さらに、どの組織から複合体が取り込まれているのかを詳しく調べるため、ペプチドと蛍光色素を付加したプラスミドDNAとの複合体を用いて、共焦点レーザー走査型顕微鏡注9)による観察を行いました。はじめに、タバコの根における複合体の取り込みを調べた結果、根毛周辺に多くの蛍光シグナルが検出されました。三次元解析で詳細に調べた結果、複合体が根毛の細胞内部にまで取り込まれていることが確認できました。さらに、レポーター遺伝子として組み込んだ緑色蛍光タンパク質(GFP)の蛍光が観察でき、取り込まれたプラスミドDNAが細胞内で発現されていることが確認できました。このことから、タバコの場合、複合体の取り込みは「根毛」経由であることが明らかとなりました。
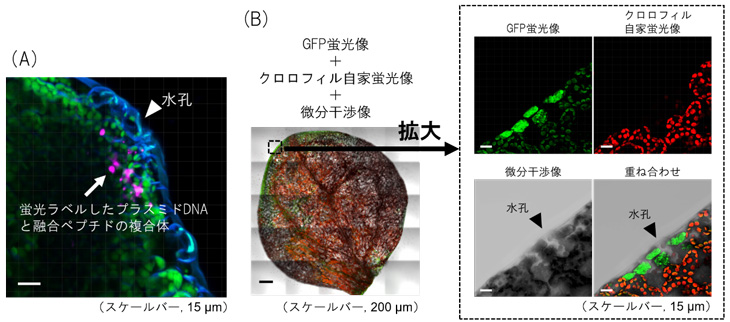
一方、シロイヌナズナでは、葉の排水組織である「水孔」に複合体が蓄積している様子が観察されました(図1A)。さらに詳しく調べた結果、葉の周縁部のGFPが発現している細胞付近に水孔が存在することが確認できました(図1B)。したがって、葉における複合体の取り込みは、「水孔」経由であることが明らかになりました。
次に、根では複合体の取り込みが確認できなかったシロイヌナズナをリン酸欠乏培地で生育し、強制的に根毛を発達させた結果、根毛での複合体の取り込みが確認できました(図2)。水孔と根毛を形成する細胞は、他の組織の細胞と比較して薄い細胞壁で構成されています。このことから、ペプチド-プラスミドDNA複合体の植物組織への侵入には、このような「構造的な脆弱性」が重要であることが強く示唆されます。
<今後の期待>
本研究は、非ウイルス性遺伝子キャリアであるペプチドを用いた遺伝子送達システムの植物組織への侵入に、構造的脆弱性が重要であることを明らかにしました。この知見は、これまで形質転換が困難とされてきた植物種に対して、遺伝子送達を行う際の効果的な標的組織を決定する1つの基準となり得ます。
本研究により得られた形態学的知見に加え、複合体取り込みにおける分子メカニズムが解明されれば、細胞への遺伝子送達効率向上のためのより効果的なペプチドの発見や、多種多様な植物形質転換体の作出につながることが期待できます。
さらに今回の研究は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)」のうち、「2.飢餓をゼロに」と「12.つくる責任つかう責任」に貢献する成果になります。
<参考図>
![]()
図1 ペプチド-プラスミドDNA複合体を導入したシロイヌナズナの葉の蛍光画像
(A)蛍光ラベルしたプラスミドDNA(マゼンタ)と融合ペプチドからなる複合体をシロイヌナズナの葉に導入した。水孔から複合体が侵入している様子が分かる。緑色はクロロフィルの自家蛍光、青色は細胞膜を示す。
(B)シロイヌナズナにレポーター遺伝子としてGFPを組み込んだプラスミドDNAと融合ペプチドからなる複合体を取り込ませ、葉の部分を共焦点蛍光顕微鏡により観察した。GFPは葉の周縁部で特に発現しており、GFPの蛍光が見られる細胞の付近には水孔が観察された。
![]()
図2 根毛の伸長を促進したシロイヌナズナの根でのGFP蛍光画像
リン酸欠乏にさらすことでシロイヌナズナの根毛を発達させ、融合ペプチドとGFP発現遺伝子を含むプラスミドDNAの複合体を取り込ませた。
(A)標準培地(左)とリン酸欠乏状態(右)で育てたシロイヌナズナの根。
(B)GFPを発現しているシロイヌナズナの根。根毛の伸長により、シロイヌナズナの根でもGFPの蛍光が観察された。
![]()
図3 ペプチド-プラスミドDNA複合体は「根毛」または「水孔」経由で取り込まれる
<用語解説>
- 注1)形質転換
- 細胞の外からDNAを導入し、その遺伝的性質を変えること。
- 注2)細胞膜透過性ペプチド(CPP)
- 細胞膜を透過して細胞内へ移行することができるペプチドの総称。10~100個ほどのアミノ酸からなる。CPPはCell-penetrating peptideの略。
- 注3)ポリカチオン性ペプチド
- 正に帯電したアミノ酸であるリジンなどが10~20残基程度つながったペプチド。
- 注4)プラスミドDNA
- 細胞質中に存在し、ゲノムDNAからは独立して自律的に複製される。環状の構造を持ち、単独では細胞内に移行しにくい。
- 注5)水孔
- 植物の葉に見られる排水組織の一種で、葉脈の末端にあたる葉の縁に見られる。蒸散の少ない状況などで、体内の過剰な水分を排出する。
- 注6)ウイルスベクター
- ウイルスが持つ病原性に関わる遺伝子を除去し、導入したい外来遺伝子を組み込んだもの。目的の遺伝子を細胞へ運ぶ「運び屋」としての役割を担う。
- 注7)リポソーム
- 細胞膜や生体膜の主成分であるリン脂質を用いて、溶液中で作製できる脂質二重膜のカプセル。
- 注8)レポーター遺伝子
- 解析したい遺伝子の発現を簡便に検出、定量する目的で利用される遺伝子のこと。
- 注9)共焦点レーザー走査型顕微鏡
- 高解像度の蛍光画像を取得できる顕微鏡。光軸方向と二次元走査型の情報を組み合わせることで、立体イメージも構築できる。
<論文情報>
タイトル:“Vacuum/Compression Infiltration-mediated Permeation Pathway of a Peptide-pDNA Complex as a Non-Viral Carrier for Gene Delivery in Planta”
著者名:Keiko Midorikawa, Yutaka Kodama, and Keiji Numata
DOI:10.1038/s41598-018-36466-1
<お問い合わせ先>
<研究に関すること>
緑川 景子(ミドリカワ ケイコ)
理化学研究所 環境資源科学研究センター バイオ高分子研究チーム 特別研究員
児玉 豊(コダマ ユタカ)
理化学研究所 環境資源科学研究センター バイオ高分子研究チーム 客員研究員
(宇都宮大学 バイオサイエンス教育研究センター 准教授)
沼田 圭司(ヌマタ ケイジ)
理化学研究所 環境資源科学研究センター バイオ高分子研究チーム チームリーダー
<JST事業に関すること>
内田 信裕(ウチダ ノブヒロ)
科学技術振興機構 研究プロジェクト推進部
<報道担当>
理化学研究所 広報室 報道担当
科学技術振興機構 広報課