2024-07-19 がん研究会,国立がん研究センター
発表のポイント
- RAS遺伝子(注1)変異型転移性大腸がんの治療後に、変異ステータスが変異型(注2)から野生型(注3)へ変化した患者さんの割合、および変異ステータスの変化に関連する臨床病理学的特徴をSCRUM-Japanの研究を利用して初めて解明しました。
- これまで抗EGFR抗体薬(注4)を含む治療の効果が期待できないとされていたRAS遺伝子変異型大腸がん患者さんのうち、およそ1割はこれらの治療法の恩恵を受けられる可能性があることを初めて明らかにしました。
- RAS遺伝子変異ステータスの変化(変異型→野生型)には、・肝転移またはリンパ節転移がないこと
・臨床病理学的因子として大腸がんでは頻度の低いRAS遺伝子変異(KRAS エクソン2以外)があること
が関連していることを明らかにしました。本研究の結果は、転移性大腸がん患者さんの治療方針を決定する際の重要な情報として活用されることが期待されます。
概要
公益財団法人がん研究会有明病院(病院長:佐野 武、東京都江東区)の消化器化学療法科の大隅 寛木副医長、篠崎 英司副部長、山口 研成副院長らの研究グループは、国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)東病院(病院長:土井 俊彦、千葉県柏市)の中村 能章医員、坂東 英明医長、吉野 孝之副院長らの研究グループと共同で、進行消化器がんにおいて、患者の腫瘍から血液中に流出したDNA(血漿循環腫瘍DNA、ctDNA:Circulating tumor DNA)を用いた解析で、RAS 遺伝子変異型転移性大腸がんの治療後に、変異ステータスが変異型から野生型へ変化した患者の割合、および変異ステータスの変化に関連する臨床病理学的特徴を初めて明らかにしました。
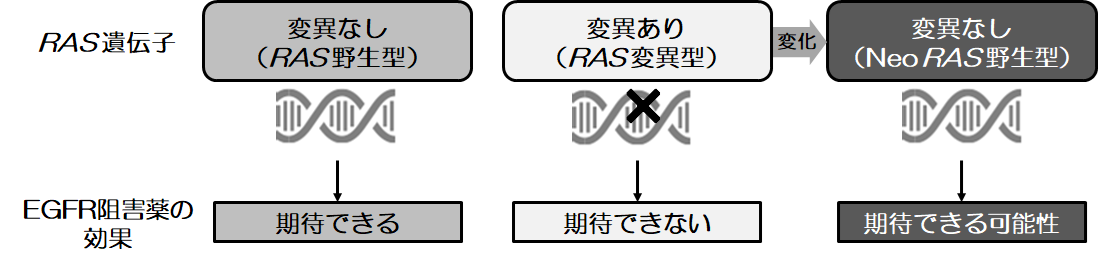
RAS 遺伝子変異型の患者は、転移性大腸がんの主要な治療である抗上皮成長因子受容体(EGFR:epidermal growth factor)抗体薬の効果が期待できず予後不良であることから、これらの患者に対する新たな治療選択肢が必要とされてきました。近年、RAS 遺伝子変異型と診断された患者が治療後にRAS 野生型になる場合に、抗EGFR抗体の効果が期待できることが明らかになってきました。
今回、治療前後におけるRAS 変異ステータスが変化する割合、RAS 変異ステータスの変化と関連する臨床病理学的因子が明らかにされたことにより、薬物療法前の診断でRAS 遺伝子変異型であっても抗EGFR抗体薬を含む治療の恩恵を受けられる患者を早期に見極めることができるため、治療方針の決定に活用されることが期待されます。
背景
RAS遺伝子に突然変異が起こると、がん細胞の増殖を促進するシグナルが恒常的に活性化されるため、抗EGFR抗体薬投与による治療効果を期待できず、RAS 遺伝子変異型転移性大腸がん患者はRAS 野生型転移性大腸がん患者と比べて予後不良と言われています。そのため、治療開始前にRAS遺伝子検査を行い、RAS遺伝子変異ステータスを確認しておくことが推奨されています。
従来一般臨床では、身体に負担の大きい腫瘍組織の生検を繰り返し行うことはしていませんでしたが、昨今、身体に負担の小さいリキッドバイオプシー(注5)を用いた遺伝子変異検査法の進歩により、簡便に繰り返しRAS 遺伝子変異のステータスを確認することができるようになりました。しかし、RAS 遺伝子変異型の 転移性大腸がん患者のうちどのくらいの頻度で治療後にRAS遺伝子変異ステータスの変化が起こるのか、これまでその詳細は明らかにされていませんでした。また少数例ではあるものの、治療後にRAS 野生型になる患者に対して抗EGFR抗体薬が有効である可能性も示唆されていますが、これに該当する患者はどのような臨床病理学的特性を有するのかについても明らかではありませんでした(図1)。
図1.
本研究は、進行消化器がんの患者を対象にした腫瘍組織を用いたがんゲノムスクリーニングプロジェクト「GI-SCREEN-Japan(腫瘍組織検査)」と、患者の血液を用いてがんのゲノム異常を検出する検査(リキッドバイオプシー)の研究「GOZILA Study(リキッドバイオプシー)」のctDNA解析結果を用いて、抗EGFR抗体による治療効果が期待できないとされるRAS 遺伝子変異型転移性大腸がん患者のうち、どのくらいの患者で治療変更後に変異ステータスが野生型に変化するか、またこの変化はどのような臨床病理学的特性を有する患者で起こりやすいのかを明らかにする目的で実施されました。
なお、本研究の成果は、2023年米国腫瘍学会(ASCO:American Society of Clinical Oncology)学術集会の口演発表で報告(米国時間2023年6月4日、発表者:大隅寛木)され、科学雑誌「Nature Communications」(日本時間2024年7月13日)に掲載されました。
研究方法
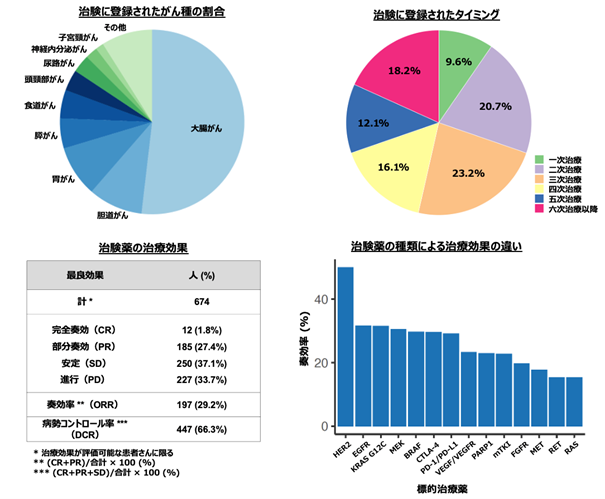
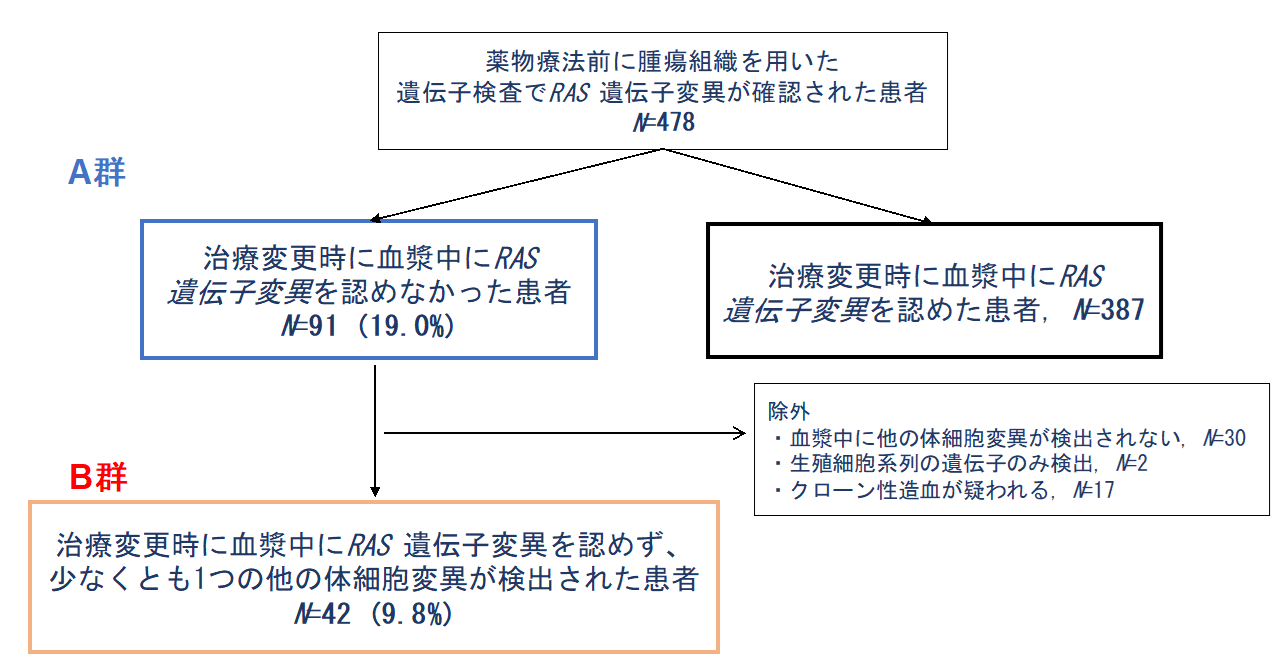
2018年3月から2022年2月の間にGOZILAに登録された転移性大腸がん患者4991名のうち、薬物療法前の腫瘍組織を用いた遺伝子検査でRAS 遺伝子変異が確認された478名を研究の対象としました。これらの患者のうち、治療変更時のctDNAの結果、RAS 遺伝子変異が検出されなかった患者(A群)と、さらにA群の中で少なくとも他の体細胞変異が認められた患者(B群)に関して、それぞれの全体に占める割合を求めました。また、各群で、RAS 遺伝子変異ステータスの変化に関連する臨床病理学的な特性を検討しました。
図2.
結果
A群、B群の全体に占める割合はそれぞれ19.0%、9.8%でした(図2)。
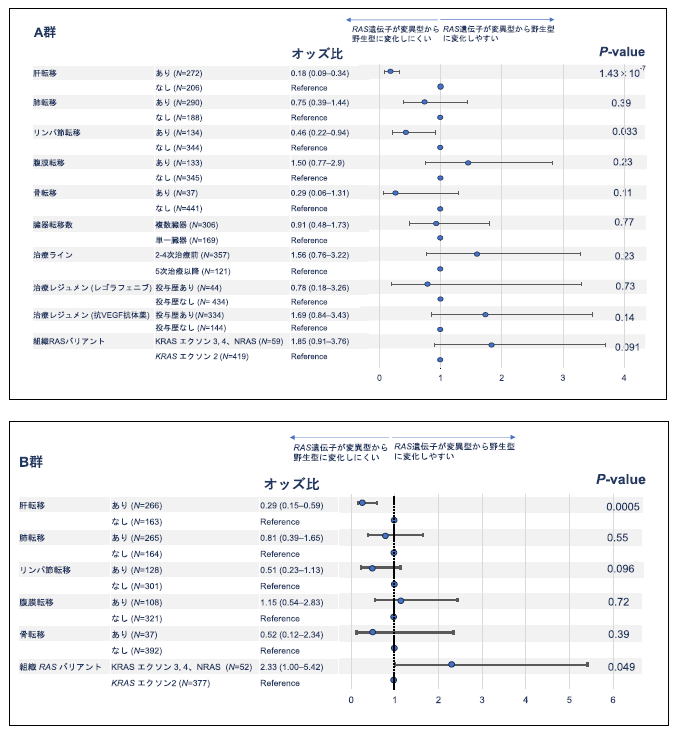
RAS 遺伝子変異型から治療後にRAS 野生型になる転移性大腸がん患者の臨床病理学的特徴の検討の結果、以下の特性がRAS 遺伝子変異型から野生型への変化と関連することが示唆されました(図3)。
A群:
- 肝転移またはリンパ節転移があると変化しにくい(それぞれ転移なしに対する転移ありのオッズ比(注6):0.18、0.75)
B群:
- 肝転移があると変化しにくい(転移なしに対する転移ありのオッズ比:0.29)
- 大腸がんでは頻度の低いRAS遺伝子変異があると変化しやすい (KRAS エクソン2に対するKRAS エクソン2以外のオッズ比:2.33)
図3.
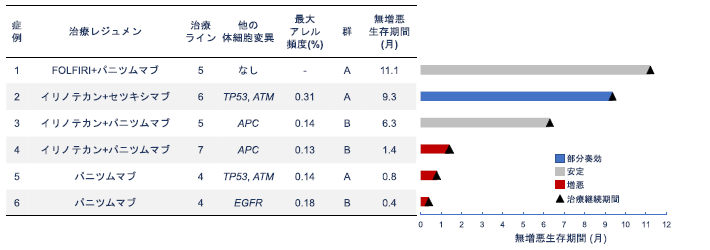
抗EGFR抗体薬を含む治療が行われた患者の臨床転帰
RAS 遺伝子が変異型から野生型に変化した患者(91名)のうち、抗EGFR抗体を含む治療を受けた患者は6名でした。治療内容を調べたところ、今回の治療ライン(抗がん剤投与による治療の順番)は4次から7次で、全員が抗EGFR 抗体薬を単独または他の化学療法剤との併用で治療が行われておりました。6名の患者のうち、治療で腫瘍が縮小したのは1名で、2名は6ヵ月以上病勢が安定していました。治療開始から病気が悪くなるまでの期間(無増悪生存期間)は最長11.1ヵ月、最短0.4ヵ月でした(図4)。
図4.
展望
今回の研究で、これまで抗EGFR抗体薬を含む治療法の効果が期待できないとされていたRAS 遺伝子変異型転移性大腸がん患者さんの中にもおよそ1割の患者さんは、これらの治療法の恩恵を受ける可能性があることが明らかにされました。
本研究の結果を踏まえ、現在、RAS 遺伝子変異型からRAS 野生型に遺伝子変異ステータスが変化する転移性大腸がん患者さんに対し、抗EGFR抗体薬を含む治療の有効性・安全性を検討するための臨床試験(C-PROWESS試験、jRCT:s031210565)が進行中です。
本論文は、産学連携全国がんゲノムスクリーニングプロジェクトSCRUM-Japanの研究を二次利用した解析です。直近のSCRUM-Japanの研究については、国立がん研究センター7月19日付のプレスリリース「世界最大規模の統合解析により、がん個別化医療による生存期間の延長を確認―産学連携SCRUM-Japan MONSTARプロジェクトの成果を米国癌学会旗艦誌「Cancer Discovery」に論文発表―」もご参照ください。
用語解説
注1 RAS遺伝子
RAS(ラス)は、細胞の増殖などに関わるタンパク質のひとつで、RASタンパク質には「KRAS(ケーラス)」、「NRAS(エヌラス)」、「HRAS(エイチラス)」の3種類がある。
注2 RAS変異型
RAS遺伝子に変異を有する患者のこと。
注3 RAS野生型
RAS遺伝子に変異のない患者のこと。
注4 抗EGFR抗体
がんの治療に用いられる分子標的治療薬の一種。がん細胞の増殖に関わる上皮成長因子受容体(EGFR:epidermal growth factor)に結合することでこの受容体の働きを抑え、がん細胞の増殖を抑制する薬剤。
注5 リキッドバイオプシー
患者さんの血液、尿、涙、唾液、乳汁、脳脊髄液、胸水、腹水など採取可能な体液サンプルを指し、経時的な検査の為に繰り返し採取・測定可能であるため、身体への負担が少ない利点が挙げられる。ctDNAはリキッドバイオプシーの1分野であり、血液中にごく微量に存在するがん由来のDNAである。
注6 オッズ比
ある事象の起こりやすさを 2つの群で比較して示す統計学的な尺度で、オッズ比が1より大きいことは、RAS 遺伝子変異型から野生型への変化しやすいことを意味する。
論文情報
論文名
Clinical features associated with NeoRAS wild-type metastatic colorectal cancer A SCRUM-Japan GOZILA substudy
著者
Hiroki Osumi、 Eiji Shinozaki*、 Yoshiaki Nakamura、 Taito Esaki、 Hisateru Yasui、 Hiroya Taniguchi、 Hironaga Satake、 Yu Sunakawa、 Yoshito Komatsu、 Yoshinori Kagawa、 Tadamichi Denda、 Manabu Shiozawa、 Taroh Satoh、 Tomohiro Nishina、 Masahiro Goto、 Naoki Takahashi、 Takeshi Kato、 Hideaki Bando、 Kensei Yamaguchi、 and Takayuki Yoshino*
(*責任著者)
掲載誌 Nature Communications
DOI 10.1038/s41467-024-50026-4
URL https://www.nature.com/articles/s41467-024-50026-4(外部サイトにリンクします)
掲載日 2024年7月13日
お問い合わせ先
研究に関する問い合わせ
公益財団法人がん研究会 有明病院
担当:大隅寛木(消化器化学療法科 副医長)
国立研究開発法人国立がん研究センター
担当:中村能章(東病院 国際研究推進室 室長)
広報窓口
公益財団法人がん研究会 広報課
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)