2024-07-23 理化学研究所,東京大学大学院理学系研究科
理化学研究所(理研)生命機能科学研究センター 生体非平衡物理学理研白眉研究チームの足立 景亮 研究員(数理創造プログラム 研究員)、川口 喬吾 理研白眉研究チームリーダー(開拓研究本部 川口生体非平衡物理学理研白眉研究チーム 理研白眉研究チームリーダー、東京大学 大学院理学系研究科附属 知の物理学研究センター 准教授)の研究チームは、タンパク質分子の集まりやすさやタンパク質凝集体[1]の混ざりやすさを、アミノ酸配列に基づいて予測する理論を提案しました。
本研究成果は、膜を持たない細胞小器官[2]の形成機構の解明に貢献し、将来的には、タンパク質のアミノ酸変異が細胞機能に与える影響を予測する理論に発展していくと期待されます。
生物の細胞内には、タンパク質などの分子で作られるさまざまな細胞小器官が存在します。細胞小器官には、ミトコンドリアなど膜で囲まれた構造体以外に、膜を持たないタンパク質凝集体も多いことが知られています。しかし、異なる種類のタンパク質凝集体が細胞内で混ざり合わずに共存できるメカニズムはほとんど分かっていませんでした。
今回、研究チームは、タンパク質凝集体の形成に関わる「天然変性領域[3]」を構成するアミノ酸配列の特徴から、タンパク質同士の集まりやすさを予測する理論を提案しました。また、この理論を応用することで、異なる種類のタンパク質凝集体が混ざり合うかどうかを決めるアミノ酸配列の比較的単純なルールを解明しました。
本研究は、オンライン科学雑誌『Physical Review X』(7月18日付)に掲載されました。

アミノ酸配列に基づくタンパク質凝集の予測理論
背景
生き物を構成している細胞の内部には、遺伝情報を担うDNAやさまざまな働きをするタンパク質など、数千種以上もの分子が存在します。これらの分子は細胞内で一様に混ざり合っているわけではなく、大まかな機能ごとに区画化されていることが知られています。それぞれの区画は細胞小器官と呼ばれ、細胞を構成する単位と見なすことができます(図1)。
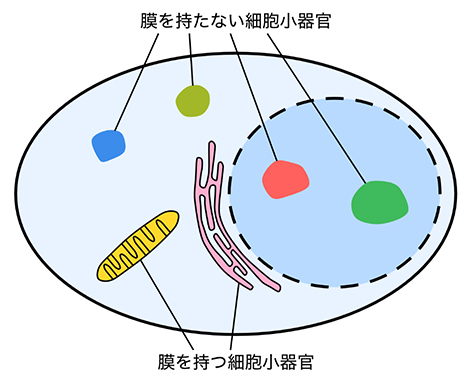
図1 膜を持つ細胞小器官と膜を持たない細胞小器官
ミトコンドリアや小胞体、核は脂質で構成された膜を持つ代表的な細胞小器官である。一方、ストレス顆粒や核小体は膜で隔てられていないにもかかわらず、区画化された構造を保つ。
細胞小器官は、ミトコンドリアのように膜で覆われたものだけでなく、核小体[4]やストレス顆粒(かりゅう)[5]といった、膜を持たないものも多いことが知られています。膜を持たない細胞小器官はタンパク質凝集体とも呼ばれ、タンパク質同士が互いに引きつけ合って集まることで作られると考えられています。細胞内では、異なる種類のタンパク質凝集体が、膜で隔てられていないにもかかわらず、混ざり合わずに共存しています。
多くのタンパク質は、らせん構造やシート構造などで構成される立体構造と、このような特定の構造を取らない「天然変性領域」と呼ばれる部分の組み合わせでできています。天然変性領域の性質や役割の研究は立体構造を取る領域に比べて進んでいませんでしたが、タンパク質の機能制御やタンパク質凝集体の形成に関わることが分かってきたことで、注目されています。近年の研究では、タンパク質はアミノ酸が鎖のようにつながってできていることを踏まえ、天然変性領域におけるアミノ酸の組成や並び順がタンパク質の凝集にどう影響するのかが盛んに調べられています(図2)。特に、アミノ酸を一つの粒子と見なしてタンパク質をポリマーで表現する理論モデルが提案され、タンパク質の凝集を計算機上でも再現できるようになってきました。しかし、どのようなアミノ酸配列であればタンパク質が自発的に凝集するのか、なぜ異なる種類の凝集体が混ざり合わないのかといった単純な問いにも、ある程度大規模な数値計算を実施しなければ答えられないという状況でした。
そこで研究チームは、タンパク質の集まりやすさや凝集体の混ざりやすさを決めているアミノ酸配列のルールは存在するかという問いを理論的に考えました。
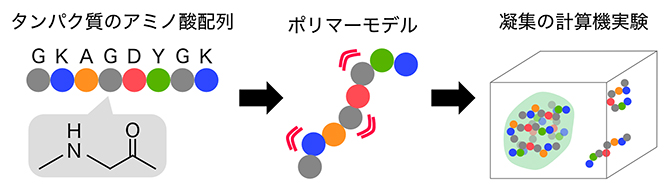
図2 タンパク質のアミノ酸配列とポリマーモデル
タンパク質は20種類のアミノ酸が、ペプチド結合(-CO-NH-)により直列に結合したポリマー(高分子)である(図中のアルファベットは、アミノ酸の1文字表記の例)。天然変性領域は特定の立体構造を取らないため、ポリマーモデルではアミノ酸を一つの粒子と見なして、それらがつながった状態で他のポリマー中のアミノ酸とどのように相互作用するかを計算し、水溶液中での挙動を計算する。
研究手法と成果
本研究では、タンパク質のポリマーモデルを解析することで、タンパク質の集まりやすさや凝集体の混ざりやすさが、アミノ酸配列のルールから予測できることを明らかにしました。
さまざまなアミノ酸配列に対してタンパク質の凝集を調べるため、ヒトの細胞内タンパク質に存在する200種類以上の天然変性領域の配列に注目しました。これらの配列それぞれについて、水溶液中のポリマーモデルの数値実験を行い、タンパク質同士の集まりやすさを特徴付ける量(臨界温度[6])を計算しました(図2)。数値実験においては、分子動力学ソフトウェアGENESIS[7]の粗視化分子モデル[8]を用い、理研Hokusai-BigWaterfall[9]を活用しました。その結果、臨界温度はアミノ酸の組成だけでなく並び順にも依存していることが分かりました。
タンパク質の集まりやすさ(臨界温度の高さ)は、二つのタンパク質を引きつけ合う相互作用の強さから決まると考えられます。この相互作用をアミノ酸配列から計算するため、統計物理学に基づく相互作用の計算方法を考えました。
最初に試した計算法は、タンパク質同士の相互作用を、アミノ酸組成から決まるアミノ酸同士の相互作用の総和に置き換えるというものです(図3右上)。この方法ではタンパク質内のアミノ酸の並び順が無視されますが、それでも臨界温度を大ざっぱに予測できることが、コンピュータシミュレーションの結果との比較から明らかとなりました。これは、タンパク質の相互作用は大まかにはアミノ酸組成だけで決まっていることを示しており、特に強く相互作用するアミノ酸(例えば芳香族アミノ酸[10])の含有率が高いほど、タンパク質が凝集しやすいといった実験事実とも矛盾しない結果が得られました。
次に、さらに予測精度を上げるために、アミノ酸の組成だけでなく並び順も考慮した計算法を考えました。具体的には、アミノ酸単体の間の相互作用の代わりに、隣り合うアミノ酸ペアの間の相互作用を用いることで、並び順への依存性も予測できることが分かりました(図3右下)。すなわち、タンパク質の集まりやすさは、アミノ酸ペアの含有率という比較的単純な情報により相当な部分が決まっていることが分かりました。
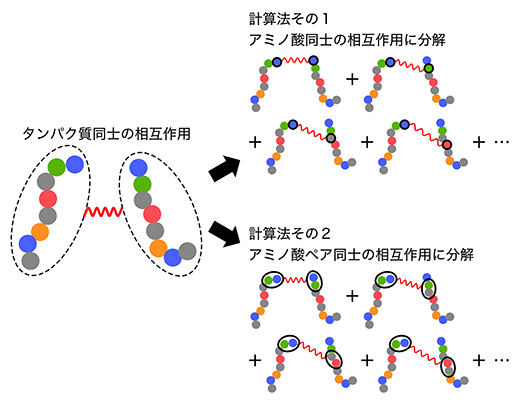
図3 タンパク質同士の相互作用の新しい計算法
本研究では、タンパク質(天然変性領域)同士の相互作用を解析するに当たり、タンパク質を一つのまとまりとして計算するのではなく、タンパク質を構成するアミノ酸同士の相互作用の総和をタンパク質同士の相互作用と見なした。
[計算法その1]二つのタンパク質間の相互作用を、左側のタンパク質の一つのアミノ酸(この例では先頭の青)と右側のタンパク質の一つのアミノ酸との相互作用に分解し、その総和を求める。
[計算法その2]二つのタンパク質間の相互作用を、左側のタンパク質の連続した二つのアミノ酸(この例では先頭の青と緑)と右側のタンパク質の連続した二つのアミノ酸との相互作用に分解し、その総和を求める。
最後に、異なる種類のタンパク質凝集体の混ざりやすさを決めているルールを調べました(図4)。もし同種タンパク質の間の相互作用が異種タンパク質の間の相互作用を上回れば、それぞれの凝集体が混ざり合わずに共存できると考えられます。そこで、上述の計算法によって相互作用を見積もり、凝集体の共存が可能なアミノ酸配列の組み合わせを調べました。その結果、混ざり合わずに共存が可能なアミノ酸配列には特徴があり、①荷電アミノ酸[11]を多く含む配列、②芳香族アミノ酸を多く含む配列、③それら以外の配列、という3種類に大別されることが分かりました。これにより、凝集しやすいタンパク質を新たに細胞が作ろうとしてもそのほとんどはこれら3種類の既存の凝集体のどれかに吸収されてしまうこと、また物理的性質の大きく異なる配列を使えば新規の凝集体を作れるものの、その数には限界があることが分かりました。
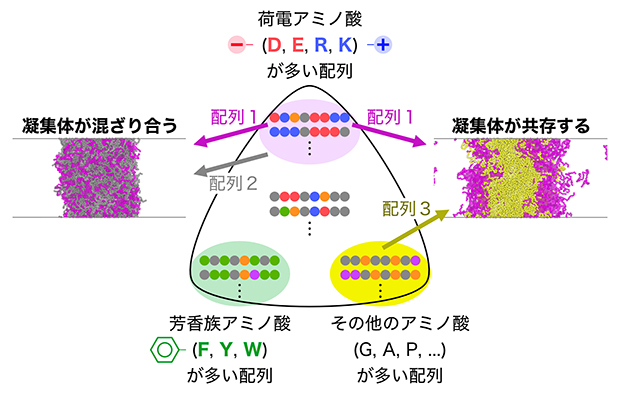
図4 凝集体の混ざりやすさを決めている配列のルール
タンパク質凝集体の混ざりやすさは、個々のタンパク質に含まれる配列の特徴で決まり、①荷電アミノ酸を多く含む配列、②芳香族アミノ酸を多く含む配列、③それ以外の配列、という3種類に大別される。異なる特徴を持つタンパク質凝集体は混ざりにくいため、細胞内で共存が可能となる。上記の例では、配列1と配列2のアミノ酸構成は異なっているが、「荷電アミノ酸が多い」という特徴を共有するため混ざり合った一つの凝集体を作ってしまう。一方、配列1と配列3はそれぞれ異なる特徴を持つため、混ざり合わず、別々の凝集体を作る。
今後の期待
本研究により、タンパク質の集まりやすさや凝集体の混ざりやすさを決めているのは、「アミノ酸ペアの含有率」や「3種類に大別される配列の特徴」といった比較的単純なアミノ酸配列のルールであることが明らかになりました。一方、今回のモデルではタンパク質と水だけが存在する単純な環境を仮定していますが、実際の細胞の内部には、タンパク質だけでなくRNAやATP[12]などさまざまな分子が存在しています。そのような複雑な環境において、混ざり合わずに各々の機能を維持できるタンパク質凝集体は最大何種類になるのか、そして生物はその最大数を実現しているのか、といった問いへの答えは今後の研究で明らかになっていくと期待されます。
またタンパク質の凝集メカニズムの理解は、筋萎縮性側索硬化症[13]をはじめとする神経疾患など、異常タンパク質の蓄積が原因と考えられる疾患の解明にもつながります。本研究で提案した理論は、将来的には、タンパク質のアミノ酸変異による凝集体の状態変化やそれに伴う細胞機能の変化を予測する理論に発展していくと期待されます。
補足説明
1.タンパク質凝集体
タンパク質同士の会合により形成される凝集体。従来は、タンパク質の変性などによって生じる異常な現象と考えられてきたが、近年では、高濃度のタンパク質が一つの液相を形成し、周囲から分離した挙動を示す「液-液相分離」との関連が注目されている。
2.細胞小器官
細胞の中で一定の形態や機能を持つ構造体の総称。ミトコンドリアや液胞など脂質膜を持つものと、膜を持たない非膜型細胞小器官(液滴)がある。
3.天然変性領域
αヘリックスやβシートなどの二次構造を取らないアミノ酸領域。IDR(intrinsically disordered region)とも呼ばれる。
4.核小体
真核生物の細胞核に存在し、タンパク質合成の場であるリボソームの構築とその構成成分のリボソームRNAの転写が行われる場所。
5.ストレス顆粒(かりゅう)
細胞がストレスを受けると、細胞質中に一時的に形成される構造。翻訳を停止したmRNAと結合したタンパク質で構成される。
6.臨界温度
ここでの「臨界」は凝集体から液相への相転移を指しており、臨界温度が高いことは、相転移しにくい(タンパク質が集まりやすい)ことを意味する。
7.分子動力学ソフトウェアGENESIS
理研計算科学研究センター粒子系生物物理研究チームを中心に開発しているソフトウェア。細胞内環境を含む大きな生体分子系のシミュレーションやレプリカ交換分子動力学法などの構造探索手法を利用することができる。
8.粗視化分子モデル
分子を構成する全ての原子(全原子モデル)の動きを追う分子動力学シミュレーションでは、扱える系が時間的・空間的に限られている。より長時間で大規模な分子系の分子動力学シミュレーションを低コストで実行するために、一つのアミノ酸残基を1粒子で近似した粗視化分子モデルが用いられている。
9.理研Hokusai-BigWaterfall
超並列演算システム、大容量メモリ演算サーバー、フロントエンドサーバー、2種類のストレージから構成されるシステム。理研での科学技術研究などの推進と発展に資する研究のために使われている。
10.芳香族アミノ酸
残基に芳香族基を持つアミノ酸で、チロシン(Y)、フェニルアラニン(F)、トリプトファン(W)、ヒスチジン(H)がある。
11.荷電アミノ酸
側鎖がイオン化するアミノ酸残基を荷電性残基と呼ぶ。イオン化して負荷電を持つアミノ酸残基にはアスパラギン酸(D)、グルタミン酸(E)が、イオン化して正電荷を持つアミノ酸残基にはアルギニン(R)、リシン(K)、ヒスチジン(H)がある。
12.ATP
アデノシン三リン酸(adenosine triphosphate)。生物全般に存在するリン酸化合物の一つで、塩基と糖が結合した化合物(ヌクレオシド)に三つのリン酸が結合していることから、三リン酸と呼ばれている。
13.筋萎縮性側索硬化症
神経細胞の変性・脱落を伴う神経変性疾患の一つ。原因として、TDP-43やFUSなどのタンパク質の凝集が関与していると考えられている。
研究支援
本研究は、理化学研究所運営費交付金(理研白眉)で実施し、日本学術振興会(JSPS)科学研究費助成事業若手研究「接着性培養細胞を用いた非平衡協同現象における普遍性の探索(研究代表者:足立景亮)」、同新学術領域研究(研究領域提案型)「ゆらぎと応答の基本限界から探索する生体分子の設計原理(研究代表者:岡田康志)」、同基盤研究(B)「自己駆動する集団におけるカイラル輸送現象の研究(研究代表者:早田智也)」、同基盤研究(A)「細胞内構造を支えるヘテロポリマー間相互作用の網羅的解析(研究代表者:川口喬吾)」による助成を受けて行われました。
原論文情報
Kyosuke Adachi and Kyogo Kawaguchi, “Predicting Heteropolymer Interactions: Demixing and Hypermixing of Disordered Protein Sequences”, Physical Review X, 10.1103/PhysRevX.14.031011
発表者
理化学研究所
生命機能科学研究センター 生体非平衡物理学理研白眉研究チーム
研究員 足立 景亮(アダチ・キョウスケ)
(数理創造プログラム 研究員)
理研白眉研究チームリーダー 川口 喬吾(カワグチ・キョウゴ)
(開拓研究本部 川口生体非平衡物理学理研白眉研究チーム 理研白眉研究チームリーダー、東京大学 大学院理学系研究科附属 知の物理学研究センター 准教授)
報道担当
理化学研究所 広報室 報道担当
東京大学大学院理学系研究科・理学部 広報室

