2021-12-28 順天堂大学,大阪大学,日本医療研究開発機構
概要
順天堂大学大学院医学研究科脳回路形態学(神経機能構造学)の日置寛之教授、山内健太助教ら、および大阪大学大学院歯学研究科口腔解剖学第二教室の古田貴寛講師らの共同研究グループは、全脳スケールからシナプススケールまで神経回路の構造をズームインしながら観察する手法の開発に成功しました。神経回路を構成する神経線維には、ヒトでは最長で1メートルを超す軸索があり、マウスのような小さな動物でもその長さは数センチメートルに及ぶものがあります。このような大規模な回路構造の解析には、光学顕微鏡による観察が適しています。一方、回路結合のエッセンスであるシナプスはナノメートルスケールの構造であり、電子顕微鏡[1]を用いないと観察することができません。本研究で開発した組織構造観察技術は、組織透明化技術[2]と電子顕微鏡観察技術との融合により、全脳構造からシナプス構造までのシームレスな観察を実現し、脳の機能基盤である神経回路構造の網羅的な解析に貢献します。本論文はiScience誌のオンライン版に2021年12月27日付で公開されました。
本研究成果のポイント
- 超微細構造[3]を保持した組織透明化技術を確立
- 透明化標本内における蛍光顕微鏡観察と電子顕微鏡観察との両立により、全脳構造からシナプス構造までのシームレスな構造観察を実現
- 大規模スケールの構造観察から、狙いをつけた超微細構造へズームイン技術を確立
背景
脳は、膨大な数のニューロン(神経細胞)が互いに連絡しあって複雑な神経回路を形成することにより機能しています。脳の動作原理を解明するためには、神経回路の「配線図」を明らかにすることが必要不可欠であり、その取り組みは世界各国で盛んに行われています。しかし、脳は全体として大きなサイズを持つ一方、神経細胞間の連絡がなされるシナプスはとても小さく電子顕微鏡でなければ見ることができません。神経回路の構造解析にはこの「大きいのに細かい」という問題を解決する必要があります。近年、開発の進む組織透明化技術は、光学顕微鏡を用いて大きいままで大規模に標本を観察することを可能としました。しかし、シナプス観察には電子顕微鏡が必要となります。そこで本研究では、組織透明化技術によって大規模構造データを取得した標本において、標的構造にズームインして電子顕微鏡解析を行うことのできる技術を開発し、広い視野と高い解像度の両立を目指しました。
内容
本研究では、透明化処理を行った脳組織について電子顕微鏡で観察することにより、全脳観察から目的のシナプスにズームインする組織構造解析技術を開発しました(図1)。実験技術の開発には、様々な実験手法の開発と独自の工夫の積み重ねが必要でした。
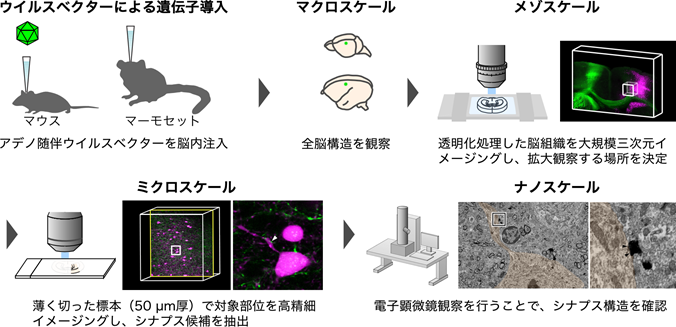
図1:本研究で開発した全脳からシナプススケールへのズームイン技術マウスもしくはマーモセットの脳内にアデノ随伴ウイルスベクター[4]を注入して、光学顕微鏡および電子顕微鏡により観察できるように神経細胞を標識する。本イメージング技術は、以下の4段階から構成される。1)全脳構造を観察(マクロスケール)、2)透明化処理した脳スライス標本(1mm厚)を観察(メゾスケール)、3)50μm厚に切った切片を高精細に観察(ミクロスケール)、4)電子顕微鏡でシナプスなどの微細構造を観察(ナノスケール)。
まず最初に、組織透明化に必要不可欠なステップ以外を削ぎ落とすことにより、超微細構造へのダメージを最小にすることを試みました。この新しい透明化法によって処理された標本は、組織の膨張や収縮を引き起こすことなく、従来の透明化法と同等の透明度を示しました。そこで研究グループは、改良した組織透明化技術がグルタールアルデヒド(GA)[5]により固定した脳組織も透明にするかを調べました。改良した透明化法は、組織の膨張や収縮をほとんど伴わずに、GAを用いて固定した脳組織を透明にすることができました。さらにGAを用いて固定した脳組織を、改良した透明化法により透明化したところ、従来の透明化法と比較してシナプスなどの超微細構造が格段に保持されていることがわかりました。
次に光学顕微鏡と電子顕微鏡との両方で目的構造を標識することができる遺伝子発現システムを開発しました。この標識法は、光学顕微鏡データにて目的領域に狙いをつけ、その領域を電子顕微鏡で観察する際に必要不可欠となります。研究グループは、アデノ随伴ウイルスベクターを利用して、感染した細胞内で緑色蛍光タンパク(GFP)とアスコルビン酸ペルオキシダーゼ(APEX2)[6]の融合タンパクを高発現するシステムの構築に成功しました。このシステムでは、GFPで標識された感染細胞は光学顕微鏡(蛍光顕微鏡)で観察することができ(メゾスケール・ミクロスケール)、その後にAPEX2の反応によってジアミノベンジジン(DAB)という色素をその細胞に沈着させることにより、標識細胞の超微細構造を電子顕微鏡を用いて観察することが可能(ナノスケール)となります。
これらの技術を組み合わせることで研究グループは、全脳構造からシナプス構造までの神経回路構造をズームインしながらシームレスに観察できる技術の開発に成功しました。そして、上記アデノ随伴ウイルスベクターの脳内注入により作製した脳組織標本に対して、本研究で開発した新しい透明化法を施すことで、光学顕微鏡による脳構造の大規模構造データを取得しました。標識された神経細胞は細胞体だけでなく、その入力部位である樹状突起や、出力部位である長い軸索までもがGFPにより可視化されていました。そうした神経突起(樹状突起や軸索)に狙いをつけて、DABを沈着させた後に電子顕微鏡により観察しました。細胞体から遠く離れた場所にある神経突起の超微細構造はきちんと保存され、かつDABにより標識されており、シナプスレベルの構造解析が可能であることが確認されました。
これらの実験はマウスとマーモセットの両方で実現しており、研究グループが開発した手法が様々な動物種に広く適用可能であることを示しています。
今後の展開
本研究において研究グループが開発した組織構造解析技術は、様々な脳部位や動物種で適用可能であり、さらには狙った神経回路の配線図を迅速に手にすることを可能とします。これらの特徴により、これまで解き明かされていなかった神経回路の配線図が次々と解明されることが期待されます。また今回、開発した組織構造観察技術は、疾患の病態解明に大きく貢献すると期待されます。疾患モデル動物を用いた研究において、ある特定の異常領域を大規模構造データの中から見い出し、そこに狙いをつけズームインして超微細構造の解析まで繋げることにより、これまで見つけることができなかった病態の発症機序や薬理作用を明らかにすることができると考えられます。
用語解説
- [1]電子顕微鏡
- 光を用いる光学顕微鏡(蛍光顕微鏡など)に比べ、電子線を用いる電子顕微鏡は、より高精細な観察を可能にする。透過型電子顕微鏡と走査型電子顕微鏡がよく用いられる。
- [2]組織透明化技術
- 生体組織内では光が散乱することが多いため不透明となる。溶液処理によって標本の光散乱を低減させることで透明度を向上化させる手法が、組織透明化技術である。
- [3]超微細構造
- 細胞膜や微小管など、光学顕微鏡では観察できない小さい構造物の総称である。なお、シナプスは特徴的な膜構造を呈するため、光学顕微鏡ではなく電子顕微鏡観察によって同定される。
- [4]アデノ随伴ウイルスベクター
- 非増殖性かつ毒性のないウイルスベクター(目的の遺伝子情報を組み込んだウイルスを細胞に感染させ、その感染細胞に目的遺伝子を発現させる方法)。最近では基礎研究分野での利用だけでなく、遺伝子治療への応用開発が進められている。
- [5]グルタールアルデヒド
- ホルムアルデヒドが固定剤として一般的に用いられる。グルタールアルデヒドを固定液に添加することで微細構造がよく保持されるため、電子微鏡観察用の試料作製際に用いられる。
- [6]APEX2
- 過酸化水素を基質とする酵素(ペルオキシダーゼ)であり、様々な色素を沈着させることができる。
論文情報
本研究成果は、2021年12月27日(米国東部時間)発行の「iScience」誌に掲載されました。
- 論文タイトル
- 「Multi-Scale Light Microscopy/Electron Microscopy Neuronal Imaging from Brain to Synapse with a Tissue Clearing Method, ScaleSF」
- DOI
- 10.1016/j.isci.2021.103601.
特記事項
本研究は下記の共同研究グループのメンバーで実施しました。
大阪大学 大学院 歯学研究科 口腔解剖学第二教室 講師 古田 貴寛
順天堂大学 大学院 医学研究科 脳回路形態学 助教 山内 健太
順天堂大学 大学院 医学研究科 脳回路形態学 研究補助員 岡本 慎一郎
京都大学 大学院 医学研究科 神経生物学 大学院生 高橋 慧
順天堂大学 大学院 医学研究科 形態解析イメージング研究室 角田 宗一郎
順天堂大学 大学院 医学研究科 脳回路形態学 特任助手 石田 葉子
大阪大学 大学院 歯学研究科 口腔解剖学第二教室 技術補佐員 竹中 綾
大阪大学 大学院 歯学研究科 口腔解剖学第二教室 教授 吉田 篤
順天堂大学 大学院 医学研究科 神経疾患病態構造学講座 特任教授 内山 安男
順天堂大学 大学院 医学研究科 神経機能構造学 教授 小池 正人
京都大学 大学院 医学研究科 神経生物学 特定職員 伊佐 かおる
京都大学 大学院 医学研究科 神経生物学 教授 伊佐 正
順天堂大学 大学院 医学研究科 脳回路形態学 教授 日置 寛之
また、本研究は以下の支援を受けて行われました。
- 日本医療研究開発機構(AMED)
- 「革新的技術による脳機能ネットワークの全容解明プロジェクト(JP21dm0207112)」
「脳科学研究戦略推進プログラム(JP19dm0207093、JP18dm0207020)」 - 科学技術振興機構(JST)
- 創発的研究支援事業(JPMJFR204D)
ムーンショット型研究開発事業(JPMJMS2024) - 日本学術振興会(JSPS)
- 基盤研究(B)JP21H02592、JP21H03529
基盤研究(C)JP20K07231、JP20K07743
新学術領域研究(研究領域提案型)「共鳴誘導で革新するバイオイメージング(JP18H04743)」 - 順天堂大学
- 順天堂大学大学院共同研究 マルチスケール脳構造イメージング講座(株式会社ニコンソリューションズ)
老人性疾患病態・治療研究センター研究奨励費X2001、X2016
研究ブランディング事業
お問い合わせ先
研究内容に関するお問い合せ先
順天堂大学 大学院医学研究科脳回路形態学
教授 日置 寛之(ひおき ひろゆき)
大阪大学 大学院歯学研究科口腔解剖学第二教室
講師 古田 貴寛(ふるた たかひろ)
取材に関するお問い合せ先
順天堂大学 総務局 総務部 文書・広報課(担当:長嶋)
AMEDの事業に関するお問い合わせ先
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト


