2024-09-25 京都大学iPS細胞研究所
ポイント
- 筋ジストロフィー注1)の細胞治療効果としての運動機能を高精度に長期的に評価する新しい方法を開発した。
- デュシェンヌ型筋ジストロフィー(DMD)モデルマウス注2)での細胞治療により、筋肉の最大等尺性収縮トルク注3)の低下が防がれ、筋肉疲労耐性が向上し、ミトコンドリア活性注4)が改善された。
- 新しい評価方法が、DMDの病態解明と治療法の開発に大きく貢献する可能性がある。
1. 要旨
大学院生の吉岡クレモンス紀穂さん(CiRA臨床応用研究部門)、竹中菜々研究員、櫻井英俊准教授(CiRA臨床応用研究部門)らの研究グループは、筋ジストロフィーの細胞治療効果を長期的に高精度に評価する新しい方法を開発しました。
DMDは、ジストロフィン注5)というタンパク質が作れないことにより、骨格筋の弱化と易疲労性注6)の進行が引き起こされる、治療が困難な進行性の筋疾患です。DMDモデルマウスへの細胞移植によりジストロフィンタンパク質を補充できることが示されていますが、その治療効果を評価するためには、長期間にわたって評価する新しい方法が求められていました。本研究では、新しく開発された方法を用いて、細胞治療によるジストロフィン補充がDMD患者さんの筋肉に与える機能的および分子的な効果を検証しました。
免疫不全のDMDマウスモデル(Dmd-null/NSG)注7)の5週齢の腓腹筋に、健康な人の不死化させた筋芽細胞(Hu5/KD3)注8)を筋内に移植してジストロフィンを補充しました。これにより、野生型のマウス、DMDマウス、およびジストロフィンが補充されたDMDマウスの筋肉機能を長期間にわたって比較しました。また、新たに開発したGO-ATeam2トランスジェニックDMDマウスモデル注9)を用いて、反復収縮中の腓腹筋ATP注10)レベルをリアルタイムで評価しました。
結果、DMDマウスにおけるジストロフィン補充は、腓腹筋の最大等尺性収縮トルク(MCT)の低下を防ぎました。特に、トレッドミルランニング後の筋疲労耐性が21週齢の移植マウスで改善されていました。トレッドミルランニング後、ジストロフィンを補充した筋線維は筋肉損傷マーカーで陽性を示さず、85.4%が持久力筋になっていることが確認されました。さらに、反復収縮に対するATPレベルが改善され、ジストロフィンを補充した筋線維でミトコンドリア活性が著しく向上していました。
細胞治療によるジストロフィン補充は、新たに開発された評価方法を用いてDMD筋肉機能を効果的に改善することが示されました。21週齢のマウスにおける筋肉疲労耐性の向上は、細胞移植後の損傷耐性とミトコンドリア活性の増加に関連していることが明らかになりました。これらの発見は、DMDの病態理解と治療法の開発に大きく貢献すると期待されます。
この研究成果は2024年9月19日「Stem Cell Research & Therapy」で公開されました
2. 研究の背景
DMDは、男性新生児5000人に1人程度の割合で見られる遺伝性神経筋疾患です。徐々に患者さんの筋力は低下し、筋肉の易疲労性が進行します。これにより、心肺機能や歩行機能が悪化します。DMDの原因遺伝子は、ジストロフィンというタンパク質をコードしています。DMD患者さんの骨格筋では、損傷や線維化が蓄積し、筋肉全体の萎縮を引き起こすと報告されています。しかし、ジストロフィンの欠乏が運動機能の低下を引き起こすメカニズムはまだ完全には解明されていません。
現在のところ、ステロイド療法とリハビリテーションがDMDの一般的な治療法ですが、進行を遅らせるのみで、副作用もあります。アンチセンス媒介のエクソン・スキッピングや遺伝子治療が試みられているものの、いずれも完全な治療法には至っていません。
再生医療は新たな治療法として浮上しており、正常なジストロフィンを持つ筋前駆細胞を用いた細胞移植が注目されています。これまでの研究では、DMDモデルマウスの筋肉において、ジストロフィンタンパク質の補充により筋肉機能の改善が報告されていますが、一貫した方法による評価はなされていませんでした。また、筋肉が持つ最大の収縮力などを指標として測定されてきましたが、必ずしも患者さんの生活の質を向上させるための指標とは一致しませんでした。本研究では、細胞療法がDMD患者さんの運動機能改善効果を持つかどうか、信頼性のある基準で評価することを目指しました。
3. 研究結果
1. 最大等尺性収縮トルクでは回復効果が見られなかった
DMDモデルマウスにおけるジストロフィン補充の効果を評価するため、健康な人の不死化させた筋芽細胞(Hu5/KD3)を移植して筋力を測定しました。13週から33週にわたる評価では、DMDマウス(DMD)はMCT(最大収縮トルク)で野生型マウス(WT)に劣りましたが、ジストロフィン補充したDMDマウス(DMD+Dys)と未治療群(DMD)の間に有意差は見られませんでした(Fig. 1)。これはDMDマウスの筋力低下がジストロフィン補充によって劇的に改善されなかったことを示唆しています。

Fig. 1 安静時におけるマウス腓腹筋の最大等尺性収縮トルク(MCT)の評価。
2. 筋疲労耐性では回復効果が見られた
筋疲労耐性の改善を評価するため、研究チームはトレッドミルランニング(TMR)法を使用しました。マウスは13週齢から21週齢まで、4週間ごとに、1分間に9メートルの早さで15分間ランニングしました。ランニング直後の筋力を最大収縮トルク(MCT)で測定し、休息時のMCTと比較し、筋疲労耐性(Muscle fatigue ratio)を測定しました。
21週齢のDMDマウス(DMD)ではランニング後のMCTが著しく低下し、筋疲労耐性も低下しましたが、ジストロフィンを補充したDMDマウス(DMD+Dys)はMCT減少が抑制され、筋疲労耐性も高く保たれました(Fig. 2)。さらに、33週齢までの長期評価においても、ジストロフィン補充グループは筋力維持と疲労耐性の改善が認められました。
これにより、ジストロフィン補充がDMDモデルマウスにおける筋疲労耐性の改善に寄与することが示されました。
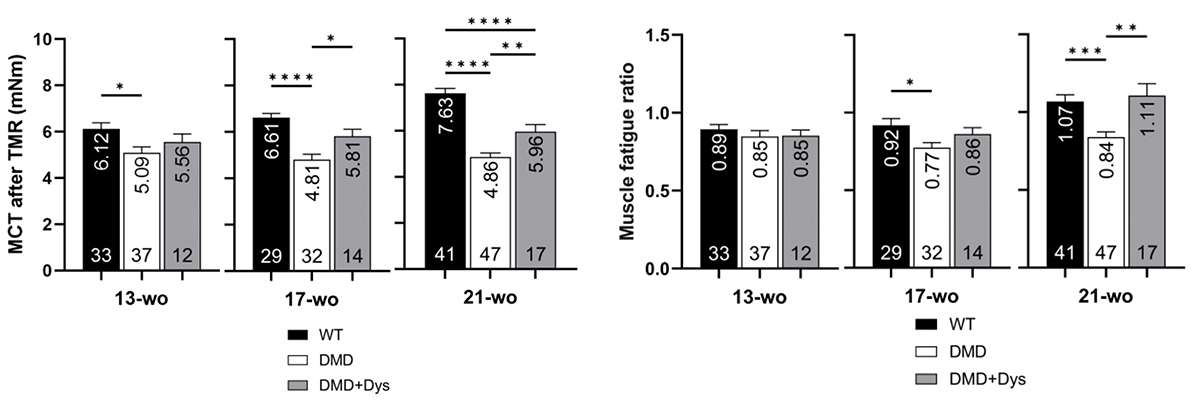
Fig. 2 トレッドミルランニング後のMCTおよび筋疲労耐性
3. 筋細胞の免疫組織化学的評価
MCTの測定を行った後、21週齢のマウスの筋組織を採取し、免疫組織染色を行いました。DMDマウス(DMDconおよびDMD+TMR)ではジストロフィンが検出されませんでしたが、細胞移植を行ったDMDマウス(DMD+Dys+TMR)では、ジストロフィンが補充されていることを確認しました(Fig. 3)。21週時点でのジストロフィン補充率は10.6%であり、ジストロフィン陽性筋線維の数とMCTの間に正の相関が見られました。さらに、ジストロフィン補充された筋線維の数が10%以上の場合、重度の筋力低下を防ぐ効果があることが分かり、ジストロフィン補充の有効性が示唆されました。
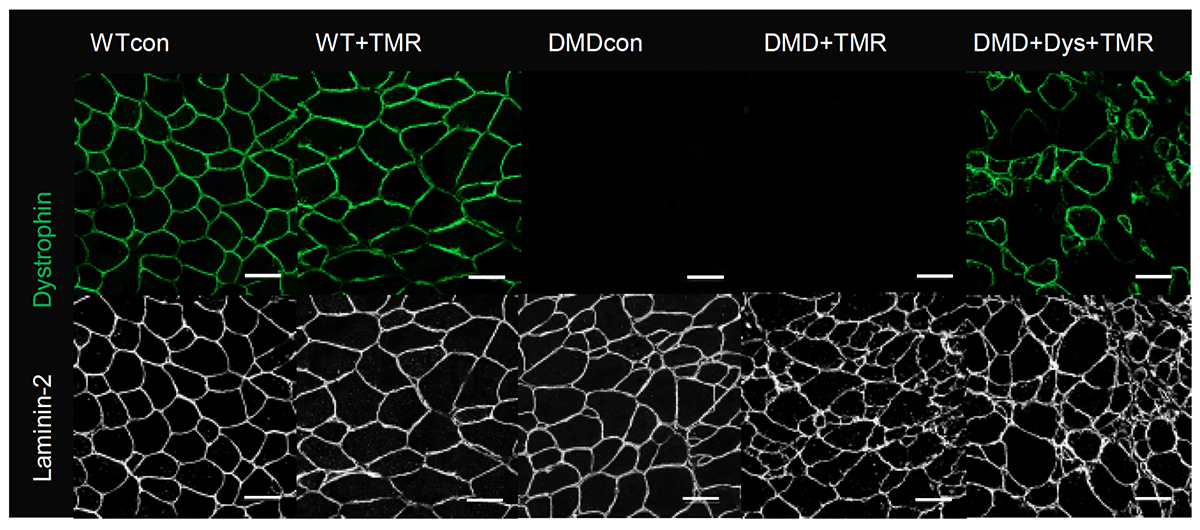
Fig. 3 免疫組織染色でジストロフィンの発現を確認
緑:ジストロフィン 白:ラミニン-2(筋線維の輪郭を示す)
4. 筋線維タイプの評価
筋線維には速筋という瞬発力をもつタイプの筋線維と、遅筋とよばれる持久力に優れた筋線維があります。そこで細胞移植により、筋線維タイプの組成に変化があるかどうかを調べました。ジストロフィンを補充したDMD筋では、持久力に優れるタイプI筋線維およびタイプIIA筋線維が、有意に増加していることが明らかになりました(Fig. 4)。
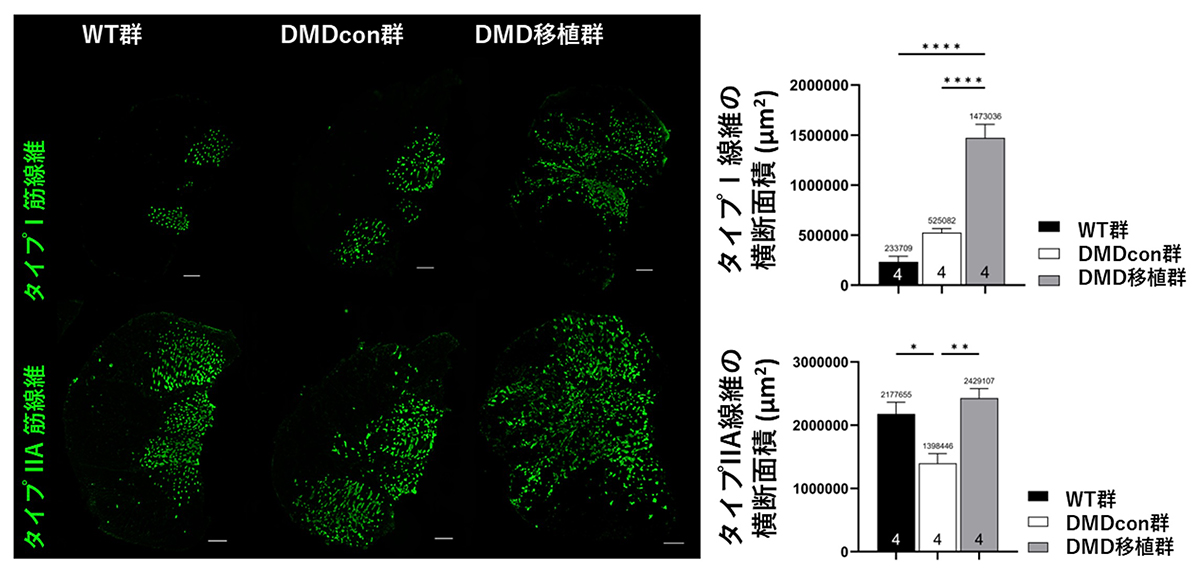
Fig. 4 免疫組織染色で筋線維タイプを確認
緑:上段 タイプI筋線維、下段 タイプIIA筋線維
5. ATP測定による筋疲労の評価
生きた状態でATPを測定できるATPtg DMDマウスを使用して、筋疲労を作成する40%の最大収縮強度で電気的に刺激された繰り返し等尺性収縮(RIC)中に、マウスの腓腹筋の画像を撮影しました。連続した画像の定性的分析では、全腓腹筋に高いATPレベルを示したATPtg WT マウスに対して、ATPtg DMD マウスの筋肉のATPレベルが低いことが示されました。未処置のATPtg DMDマウスと比較して、ジストロフィンを補充したATPtg DMDの筋肉は、ATP活性の増加を示しました(Fig. 5)。
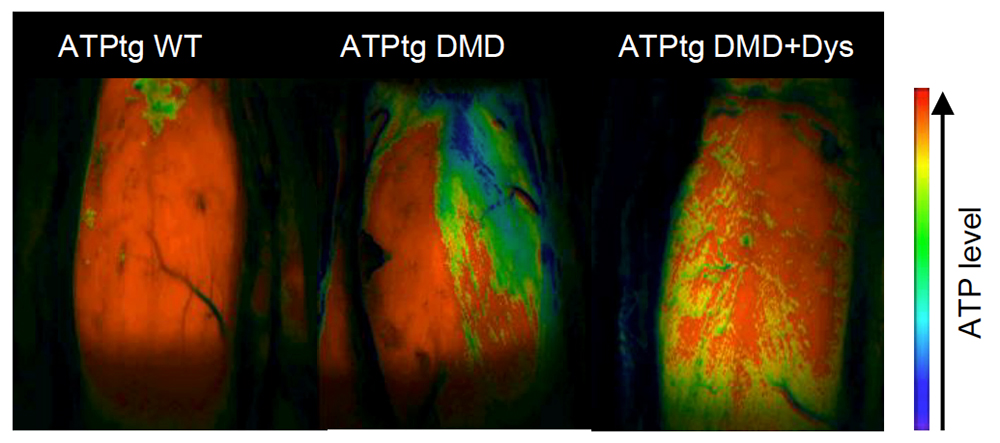
Fig. 5 測定したATPレベルのイメージ
赤い部分がATP量の多い部分を示している。
4. まとめと展望
DMDマウスモデルを用いた細胞移植研究において、運動機能を向上させるジストロフィン補充療法の長期的な有効性を確認する新たな評価方法を確立しました。ジストロフィンの補充によりDMDマウスの筋疲労耐性が著しく改善され、さらにジストロフィンが10%以上補充されたときには、重度の筋力低下を防ぐことができることがわかりました。この機能改善は、細胞移植後にジストロフィン陽性筋線維が優先的に再生し、筋損傷に対する保護特性を持つだけでなく、持久性筋線維の特徴である、高いミトコンドリア活性による酸化的リン酸化を主なエネルギー源として活用する代謝機能が寄与したためと考えられます。本研究により見出した新たな評価方法は、DMDの細胞移植医療の臨床応用に貢献すると期待しています。
5. 論文名と著者
- 論文名
Cell transplantation-mediated dystrophin supplementation efficacy in Duchenne Muscular Dystrophy mouse motor function improvement demonstrated by enhanced skeletal muscle fatigue tolerance - ジャーナル名
Stem Cell Research & Therapy - 著者
Clémence Kiho Bourgeois Yoshioka1,2, Nana Takenaka-Ninagawa1,3*, Megumi Goto1, Mayuho Miki1,2, Daiki Watanabe4,5, Masamichi Yamamoto5, Tomoki Aoyama2, Hidetoshi Sakurai1* - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 名古屋市立大学大学院 医学研究科
- 大阪体育大学大学院 スポーツ科学研究科
- 国立循環器病研究センター
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)- 再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点(JP13bm0104001)- 再生・細胞医療・遺伝子治療実現加速化プログラム 再生・細胞医療・遺伝子治療研究中核拠点(JP23bm1323001)
- 日本学術振興会(JSPS)科学研究費 特別研究員奨励費(17J40184)
- AMED(22ama121050j0002, 20ek0610017h0003)
7. 用語説明
注1)筋ジストロフィー
筋肉の弱化と萎縮を引き起こす遺伝性筋疾患。様々なタイプがあり、特に小児期に最も多く発症するものとしてデュシェンヌ型筋ジストロフィーがある。
注2)DMDモデルマウス
デュシェンヌ型筋ジストロフィーを再現するために遺伝子改変した実験用マウス。ジストロフィンタンパク質を作ることができない。
注3)最大等尺性収縮トルク(MCT)
筋肉が最大限に力を発揮した時のトルク(回転力)。筋力の指標として使用される。
注4)ミトコンドリア活性
細胞内のエネルギー生産に関与するミトコンドリアの機能状態。
注5)ジストロフィン
筋細胞の構造と機能を維持するために必要なタンパク質。DMD患者に欠乏している。
注6)易疲労性
疲れやすい体質のこと
注7)免疫不全のDMDマウスモデル(Dmd-null/NSG)
デュシェンヌ型筋ジストロフィーと免疫不全を併せ持つ実験用マウス。今回の研究では細胞移植を行うため、免疫不全にして拒絶反応を防いでいる。
注8)筋芽細胞(Hu5/KD3)
筋肉の前駆細胞で、筋肉を形成する細胞。Hu5/KD3はヒト由来で不死化させたもの。
注9)GO-ATeam2トランスジェニックDMDマウスモデル
ATPレベルをリアルタイムで評価できる蛍光プローブを持つ遺伝子改変マウス。
注10)ATP(アデノシン三リン酸)
細胞内でエネルギーを供給する分子。筋肉の収縮などのエネルギー的な活動に関与する。