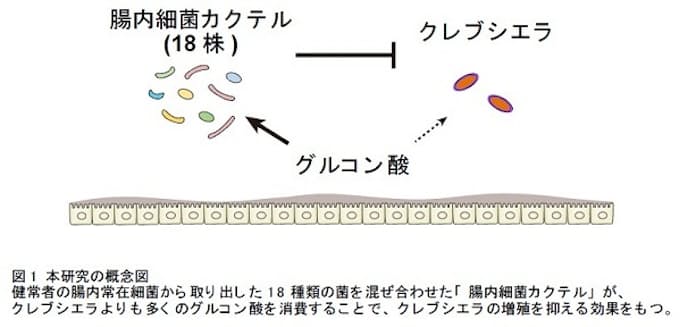
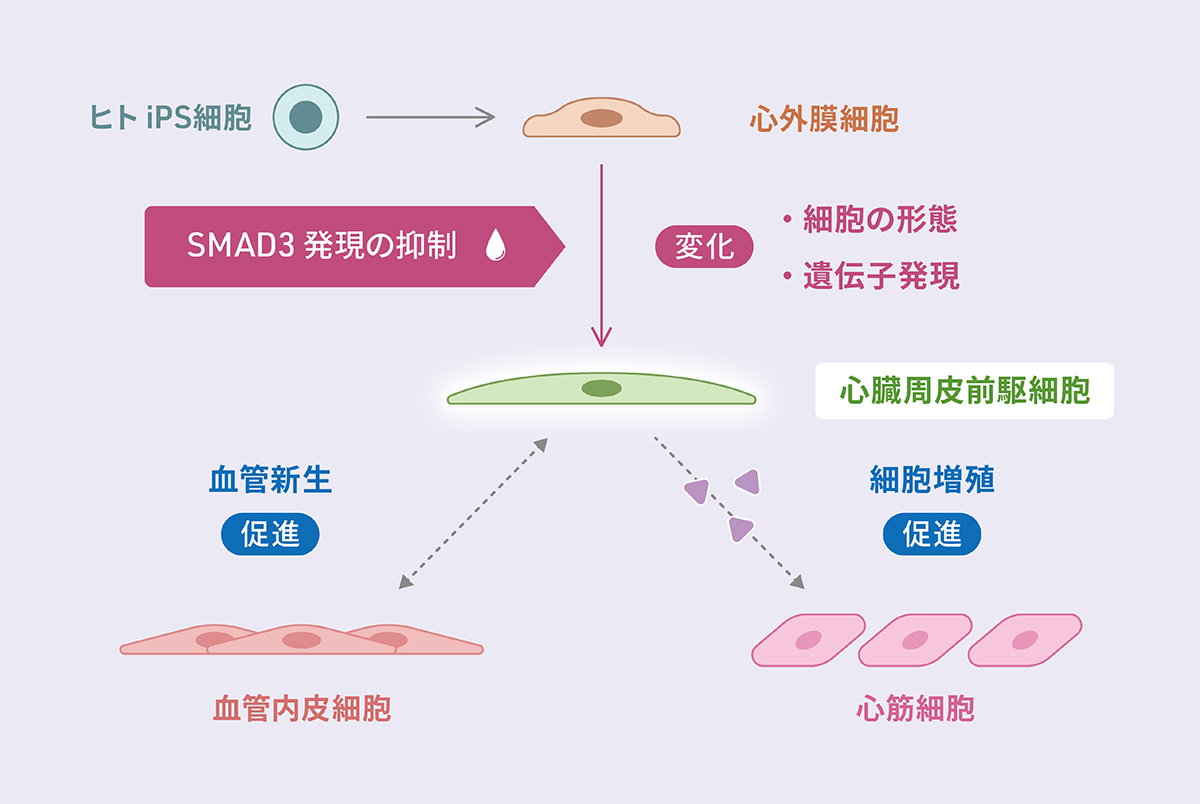
2024-09-26 量子医科学研究所
発表のポイント
- 増大するアルツハイマー病患者から抗体医薬による治療対象者を絞り込む、低コストで簡便な検査技術が必要とされています。
- タウ1)蛋白病変(タウ病変)の脳内沈着を血液で検出する新規計測法を開発し、本法で検出されるタウ蛋白が、PET2)検査で捉えたタウ病変を反映する世界初の血液バイオマーカー3)であることを実証しました。
- 血液検査により脳内タウ病変を評価できる本法は、アルツハイマー病の診断や効果の予測に基づく治療対象者の選択、ひいては治療効果判定と幅広い活用が期待されます。
成果の概要
量子医科学研究所 脳機能イメージング研究センターの互健二 研究員、建部陽嗣 協力研究員、徳田隆彦 医長らは、アルツハイマー病の脳内に沈着するタウ蛋白を血液で検出する新規の計測法を開発しました。この計測法で検出されるタウ蛋白(mid-p-tau1814))は、 PET検査で捉えられる脳内タウ病変の量を反映する、世界初の血液バイオマーカーであることが明らかになりました。
認知症の7割を占めるアルツハイマー病は、発症前から脳内にアミロイドβ(Aβ)5)とタウという2種類の異常に凝集した蛋白質が脳の中に蓄積し、病変として脳内沈着します。その結果大脳で多くの神経細胞が障害を受けたり死滅したりすることで、物忘れをはじめとする認知症の症状が出現すると考えられています。
2023年、これらの異常蛋白を標的とした診断と治療において大きな進展がありました。Aβ病変のPET検査とAβを除去する抗体医薬レカネマブ6)(商品名:レケンビ)が日本で保険適用されたことです。これにより臨床の現場でAβ病変の沈着をPET検査で評価し、これを薬の投与で減少させ、認知機能の低下を遅らせることが可能になりました。その一方、脳内のタウ病変が少ない人ほど薬の効果が高いことがわかりました。PET検査・薬ともにコスト高でもあるため、タウ病変の脳内沈着の程度を治療開始前に評価することが、治療対象者の絞り込みや、薬の効果を予測する上で重要になります。
脳内のタウ病変はQSTが開発した18F-PM-PBB3などを用いたタウPET検査により評価できますが、コスト面の問題があります。厚生労働省研究班によると認知症患者は2030年には523万人にのぼると推計され、低コストで簡便な検査技術として、脳内タウ病変量を正確に反映する血液バイオマーカーの開発が世界中で進められていますが、これまで実現していませんでした。
そこで、徳田医長らは2017年に開発した、血液中に極微量存在する、異常にリン酸化されたタウ蛋白(p-tau)の超高感度計測システムを改良し、新規バイオマーカーmid-p-tau1817)を開発しました。そして、タウPET検査で脳内タウ蓄積を評価したアルツハイマー病患者の血中mid-p-tau181を測定することで、その有用性を評価しました。その結果、mid-p-tau181は、これまでの血液p-tauと比較して、アミロイドの影響を受けずにより直接的に脳内タウ病変を反映することが明らかになりました。
現在、Aβを除去する新たな治療薬として、レカネマブに加えてドナネマブという抗体医薬も保険適用される見込みとなっています。さらに、タウ病変を標的とした治療薬候補も世界中で開発が進められています。このような治療法の進展に伴い、脳内タウ病変を高精度に反映する血液バイオマーカーmid-p-tau181が、認知症診療において重要な役割を果たすと期待されます。
本研究の成果は、英国の科学誌「Translational Neurodegeneration」のオンライン版に2024年9月5日(木)に掲載されました。
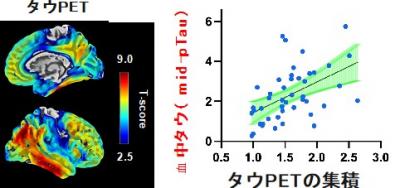
図1 18F-PM-PBB3タウPETと血中タウの相関
研究開発の背景と目的
認知症の7割を占めるアルツハイマー病は、発症の15年以上前からアミロイドβ(Aβ)という異常蛋白の脳内蓄積が始まります。Aβだけでは広範な神経細胞障害は生じませんが、蓄積したAβによって、タウ病理の伝播という病態が引き起こされます。タウ病理の伝播とは、正常な加齢により内側側頭葉という脳部位に限局して蓄積したリン酸化タウ蛋白が、他の脳部位へ拡散していくことを指します。このリン酸化タウ蛋白は神経毒性を有しており、それが大脳皮質へ拡散すると大脳の多くの神経細胞が死ぬことで、物忘れをはじめとする認知症の症状が出現すると考えられています。
2023年、アルツハイマー病の異常タンパクを標的とした診断技術と治療法において大きな進展がありました。Aβ病変のPET検査とAβを除去する抗体医薬レカネマブ(商品名:レケンビ)が日本で保険適用されたことです。これにより臨床の現場でAβ病変の沈着をPET検査で評価し、これを薬の投与で減少させ、認知機能の低下を遅らせることが可能になりました。
その一方、重要なこととして、レケンビの有効性は、脳内のタウ蛋白の蓄積量が少ない患者でより高く、蓄積がある程度進んだ患者では有効性が十分ではないこともわかってきました。このことは、レケンビの投与に際しては、脳のタウ蛋白の蓄積量を投与前に測定することで、レケンビの効果が高い患者とそうでない患者を層別化できることを示しています。しかし、現状、脳のタウ蛋白の蓄積量はコストが高いタウPETでしか測定できません。低コストで簡便に多くの患者をスクリーニングし、治療対象者を絞り込むため、脳のタウ蛋白の蓄積を反映する血液バイオマーカーの開発が強く求められています。
徳田医長らは2017年に当時としては世界で初めて、血液中に極微量存在する、異常にリン酸化されたタウ蛋白を検出するバイオマーカー(p-tau)を用いた超高感度計測システムを開発していました。しかしp-tauはAβの影響を受け、タウのみを検出するためには改良が必要でした。そこで本研究では、脳内タウ病変を高精度に反映し、早期にタウ蛋白の蓄積を検出して、その有無の区別を可能とする新規血液バイオマーカーmid-p-tau181を開発し、その有用性を評価しました。
研究の手法と成果
本研究では、健常高齢者40名、アルツハイマー病(PET検査によりAβ陽性の軽度認知障害を含む)患者48名、進行性核上性麻痺患者50名、前頭側頭葉変性症患者26名の計164名を対象に、包括的な評価を行いました。まず、全対象者に対してアミロイドおよびタウPETを実施し、脳内のAβおよびタウ蛋白の蓄積量と分布を詳細に評価しました。タウPET検査には、QSTが独自に開発した高感度PET検査薬剤18F-PM-PBB3を使用しました。18F-PM-PBB3は、従来のタウPET検査薬剤と比較して、より高いコントラストでタウ病変を可視化することが可能です。次に、全対象者から血液サンプルを採取し、新規に開発したタウの血液バイオマーカーであるmid-p-tau181の測定を行いました(図2)。
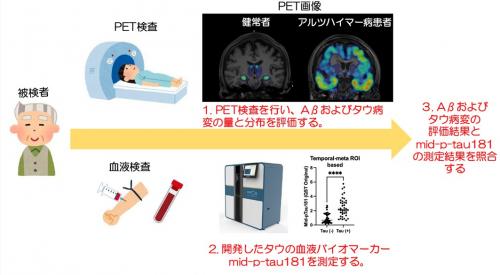
図2 脳内タウ病変を反映する新規血液バイオマーカーmid-p-tau181の検証プロセス
このmid-p-tau181は、研究グループが以前に開発したp-tau181を基に、より特異的に脳内タウ病変を反映するよう改変したものです。従来のp-tau181(N-p-tau181)が主にタウ蛋白のN末端を含む断片を検出するのに対し、新たに開発したmid-p-tau181は、タウ蛋白の中間領域に焦点を当てています。具体的には、タウ蛋白のN末端と C末端の両方が切断された断片を検出するよう設計しています。これは、タウ病変の脳内分布が拡がり症状が進行すると、脳に沈着したタウ蛋白ではそのN末端とC末端が切断されていくという過程を考慮したものです(図3)。
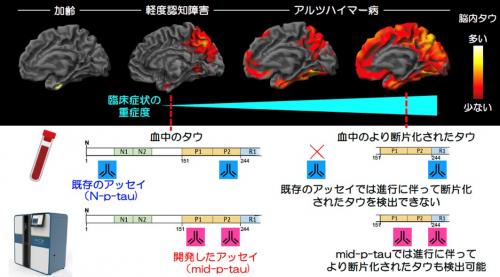
図3 新規血液バイオマーカーmid-p-tau181の開発と従来法との比較
タウ蛋白の構造と、従来のN-p-tau181と新規mid-p-tau181の検出領域の違いを示しています。
(N-p-tau181の抗体:青色、mid-p-tau181の抗体:ピンク色)
血液中に極微量しか存在しない異常なタウ蛋白を高精度に検出するため、測定には従来のELISA法と比較して約1000倍の感度を持つ、超高感度デジタルELISA技術であるSimoa(Single Molecule Array, Quanterix)7)を用いました。既存のN-p-tau181と新規のmid-p-tau181の両方をSimoaで高精度に測定し、それぞれの特性を比較しました。その結果、新規に開発したmid-p-tau181が従来のN-p-tau181と比較して、タウPETで捉えられる脳内タウ蛋白の蓄積量とより強い相関を示すことが明らかになりました(図4)。また、mid-p-tau181の濃度とタウPETで捉えられるタウ蛋白の蓄積量の間には、脳全体の中でも、アルツハイマー病で顕著なタウ蓄積が現れる側頭葉や頭頂葉において強い相関が確認されました。
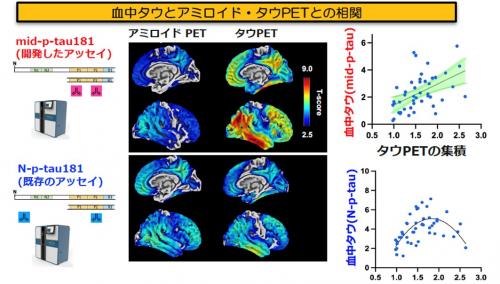
図4 mid-p-tau181とN-p-tau181の脳内Aβ・タウ病変との相関比較
左の図は血中タウ濃度とPET薬剤の集積が相関する部位を図示したものです。色が青いほど相関性が低く、赤いほど相関性が高いことを示しています。
結果、mid-pTau181はタウPETと相関が高く、N-pTau181はアミロイドPETとも相関があることが示されています。
右の図は散布図形式で、縦軸にmid-p-tau181とN-p-tau181の濃度、横軸にタウPETの値を示しています。
mid-p-tau181はタウPETと線形相関を、N-p-tau181はタウPETとの非線形相関を示しています。
さらに、mid-p-tauの最も重要な特徴である「アミロイド蓄積の影響を受けずにタウ蓄積を反映する」という特性を検証するために、mid-p-tau181とN-p-tau181の測定値に、アミロイドPETおよびタウPETの測定値がどのくらい寄与しているかを統計学的に検定しました。その結果、mid-p-tau181の測定値は、タウPETの測定値すなわち脳内タウ蛋白の蓄積の程度を直接的に反映していることが示されました。一方、N-p-tau181は脳内タウ蓄積だけでなく、アミロイドβ蓄積の影響も受けていることが判明しました(図5)。
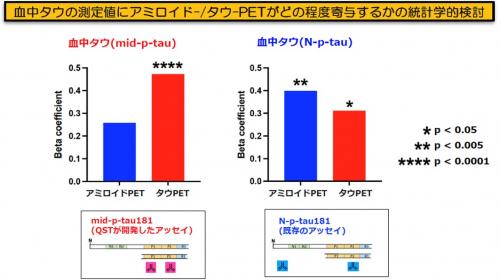
図5 血中タウの測定値にアミロイド-/タウ-PETがどの程度寄与するかの統計学的検討
血漿p-tau値に、アミロイドPETおよびタウPETの測定値(SUVR)がどのくらい寄与しているかを統計学的に検定しました (有意水準はp<0.05)。
統計学的には、血漿mid-p-tau値の大小の決定には、タウPETのSUVRが有意に寄与していますが、
アミロイドPET SUVRは寄与していませんでした(アミロイドPET: p = 0.056; タウ PET: p < 0.0001, Adjusted R2 = 0.450)。
一方、血漿N-p-tau値の大小には、統計学的にアミロイドPET SUVRとタウPETのSUVRの両者が寄与していましたが、
アミロイドPET の寄与がより大きいことが明らかになりました(アミロイドPET: p = 0.002; タウPET: p = 0.020, Adjusted R2 = 0.420)。
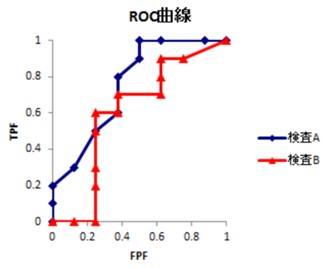
またmid-p-tau181の臨床的有用性をさらに検証するため、脳内タウ蛋白の蓄積の有無をどの程度区別できるか検証しました。その結果、特に、アルツハイマー病患者のタウPET陽性例では、タウPET陰性の症例や健常者と比較して、mid-p-tau181濃度が有意に高いことが示されました(図7左)。さらに、3種類の異なる評価方法を用いた統計学的解析を行った結果、mid-p-tau181は85%以上の精度で脳内タウ蛋白の蓄積の有無を区別できることが確認されました(図7右)。これは、mid-p-tau181を測定する血液検査が、タウPETと同等の情報を提供できる可能性を示唆しています。
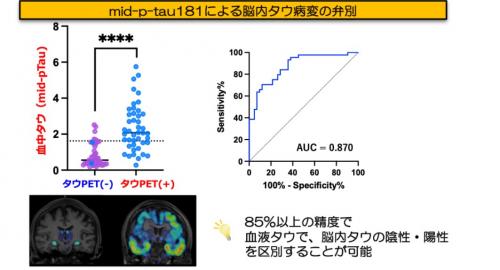
図4:mid-p-tau181の脳内タウ蓄積弁別能力の検証
左側にタウPET陽性・陰性群でのmid-p-tau181濃度の散布図、右側にROC8)曲線を示しています。
散布図では、タウPET陽性群が陰性群より高値を示し、ROC曲線は高いAUC9)値を示す曲線(青色)で表現されています。
今後の展開
本研究により、新規血液バイオマーカーmid-p-tau181が脳内タウ病変を高精度に反映し、アルツハイマー病をはじめとするタウ蛋白の蓄積を認める疾患に対して有用であることが示されました。現在、レカネマブに加えて、ドナネマブのような新たなAβを標的とした抗体医薬も保険適用される見込みとなっています。さらに、タウ病変を標的とした治療薬候補も世界中で開発が進められています。このような治療法の進展に伴い、脳内タウ病変を高精度に反映する血液バイオマーカーであるmid-p-tau181の臨床的需要は、今後ますます高まるものと考えられます。QSTでは、自ら主導しているトータルステージ脳疾患創薬アライアンスにおいて、今後治療候補薬材が開発された際には、その臨床試験や治験実施時の検査や治療効果の評価にも、タウPETと合わせてmid-p-tau181を測定する血液検査を使用していくことも考えています。
mid-p-tau181は、タウの病態解明や、タウ病変の沈着を抑える治療薬の開発・治療効果判定まで一気通貫で利用可能な技術として、さらにより幅広く認知症やその関連する病態を評価する診断技術として、認知症診療の発展に大きく寄与する可能性があります。
用語解説
1)タウ
神経細胞の骨格を形成する微小管に結合する蛋白。正常な状態では神経細胞の機能維持に重要な役割を果たしますが、アルツハイマー病などの疾患では異常にリン酸化され、細胞内に蓄積することで神経細胞の機能障害を引き起こします。
2)PET(陽電子断層撮影法)
Positron Emission Tomographyの略。特殊な放射性物質を用いて、生体内の様々な生理的・病理的プロセスを可視化する画像診断法。アルツハイマー病の診断では、脳内のアミロイドβやタウの蓄積を検出するのに用いられます。
3)バイオマーカー
生体内の生物学的変化を定量的に測定できる指標。本研究では、血液中のタウ蛋白(mid-p-tau181を、脳内のタウ病変を反映するバイオマーカーとして開発しました。
4)mid-p-tau181
本研究で開発した新しい血液バイオマーカー。タウ蛋白の中間領域にあるリン酸化された181番目のスレオニン残基を検出します。脳内タウ病変をより直接的に反映することが特徴です。
5)アミロイドβ
脳内で産生される蛋白の一種。アルツハイマー病患者の脳では、この蛋白が異常に蓄積して凝集し、神経細胞に悪影響を与えると考えられています。
6)レカネマブ
アルツハイマー病治療薬の一つで、脳内のアミロイドβを標的とする抗体医薬品。アミロイドβの蓄積を減少させることで、認知機能低下の進行を遅らせる効果が確認されています。
7)Simoa(Single Molecule Array)
超高感度なデジタルELISA技術。従来の方法と比べて約1000倍の感度を持ち、血液中の極微量の蛋白を検出することができます。
8)ROC曲線
Receiver Operating Characteristic曲線の略。検査や診断薬の性能を2次元のグラフに表したものです。ある検査で異常と正常を区別するカットオフポイントごとに真陽性率(=TPF)と偽陽性率(=FPF)を計算し、縦軸にTPF、横軸にFPFをとった平面にプロットして線で結んで表します(下図参照,統計WEB統計学用語集より)。ROC曲線を作成した時に、グラフの下の部分の面積をAUC(Area Under the Curve)と呼びます。AUCは0から1までの値をとり、値が1に近いほど判別能が高いことを示します。
9)AUC(Area Under the Curve)
ROC曲線下面積のこと。診断テストの総合的な性能を0から1の値で示す指標で、1に近いほど優れた判別能力を持つことを意味します。
謝辞
本研究は、日本医療研究開発機構(AMED)認知症研究開発事業「多施設連携プラットフォーム(MABB)を基盤にした各種認知症性疾患に対する日本発の包括的な診断・層別化バイオマーカーシステムの確立」研究(22dk0207055)および革新的技術による脳機能ネットワークの全容解明プロジェクト「神経変性疾患のタンパク凝集・伝播病態と回路障害の分子イメージング研究」、MEXT/JSPS科研費JP16H05324、JP18K07543、JSTムーンショット型研究開発事業「臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて(JPMJMS2024)」などの支援を受けました。
論文情報
タイトル:A novel plasma p-tau181 assay as a specific biomarker of tau pathology in Alzheimer’s disease
著者:Kenji Tagai, Harutsugu Tatebe, Sayo Matsuura, Zhang Hong, Naomi Kokubo, Kiwamu Matsuoka, Hironobu Endo, Asaka Oyama, Kosei Hirata, Hitoshi Shinotoh, Yuko Kataoka, Hideki Matsumoto, Masaki Oya, Shin Kurose, Keisuke Takahata, Masanori Ichihashi, Manabu Kubota, Chie Seki, Hitoshi Shimada, Yuhei Takado, Kazunori Kawamura, Ming-Rong Zhang, Yoshiyuki Soeda, Akihiko Takashima, Makoto Higuchi & Takahiko Tokuda