2024-12-03 京都大学iPS細胞研究所
ポイント
- パーキンソン病注1)やハンチントン病注2)などにおける運動異常症の発症には、大脳基底核線条体と呼ばれる脳領域が関与することが知られています。しかし、哺乳類の大脳基底核線条体に存在する特徴的なモザイク構造(ストリオソーム注3))の運動制御における役割は、その発見から約半世紀にわたり謎でした。
- ストリオソームの神経細胞活動を操作可能な遺伝子改変マウス注4)を用いて、ストリオソームは線条体でのドパミン注5)放出を抑制し、運動を抑制することを見出しました。これは大脳基底核の従来のモデルから予想されるはたらきとは異なっていました。
- 大脳基底核モザイク構造の謎の一端を明らかにし、運動異常症の発症メカニズム解明につながる成果であり、大脳基底核の詳細な理解に基づいた運動異常症のiPS細胞由来病態モデルに役立つと期待されます。
1. 要旨
奥宮太郎(京都大学医学部附属病院先端医療研究開発機構助教(研究当時)、京都大学CiRA増殖分化機構研究部門非常勤研究員、理化学研究所バイオリソース研究センター(BRC)iPS創薬基盤開発チーム客員研究員)、渡邉大(京都大学大学院医学研究科生体情報科学講座教授)、髙橋良輔(京都大学医学部附属病院脳神経内科教授(研究当時)、京都大学学術研究展開センター部門長)および井上治久(京都大学CiRA増殖分化機構研究部門教授、理化学研究所バイオリソース研究センター(BRC)iPS創薬基盤開発チームチームリーダー、理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム客員主管研究員)らの研究グループは、マウス大脳基底核線条体のモザイク構造を形成するストリオソームと呼ばれる領域の神経細胞が、ドパミンの放出を抑制し、運動を抑制する機能を有することを見出しました。本研究結果は、大脳基底核研究領域に残る半世紀にわたる謎の一端を明らかにし、従来の大脳基底核モデルでは説明できない新たな運動制御機構の存在を示唆することで、運動異常症の発症メカニズム解明につながる成果であり、線条体を標的細胞としたiPS細胞由来の病態モデル作製や治療法開発に役立つと考えられます。
本研究成果は2024年12月2日に北米神経科学会が発行する国際科学誌「The Journal of Neuroscience」でオンライン公開されました。
2. 研究の背景
1)大脳基底核線条体モザイク構造の謎
大脳基底核線条体と呼ばれる脳領域は、私たちの脳の中心部に位置する比較的大きな灰白質注6)です(図1)。線条体は筋肉や感覚神経と直接の神経連絡を持ちませんが、脳内の他の領域から多くの入力を受け、脳内においてドパミンが最も豊富に放出される重要な脳領域です。線条体細胞が変性するハンチントン病や、ドパミン細胞が変性するパーキンソン病、意図に反した筋収縮をきたすジストニアなどの運動異常症の発症と関連することが知られています。
肉眼では哺乳類の大脳基底核線条体は均一に見えますが、組織学的・遺伝学的に性質の異なる構造が入り組んで特徴的なモザイク構造を形成していることが約半世紀前にPertらによって初めて記述されました(Pert et al., PNAS 1976)(図1)。このモザイク構造の機能的意義は、1970年代の発見以来、大脳基底核の大きな謎でした。モザイク構造の約15%を占めるストリオソームと呼ばれる区画は中脳ドパミン細胞へ神経細胞の線維を伸ばし、逆に中脳ドパミン細胞は線条体へ濃密なドパミン投射線維を送ることから、とくに運動異常症との関連が提唱されてきましたが、ストリオソーム区画だけを調べる方法が確立されておらず、謎は解けていませんでした。
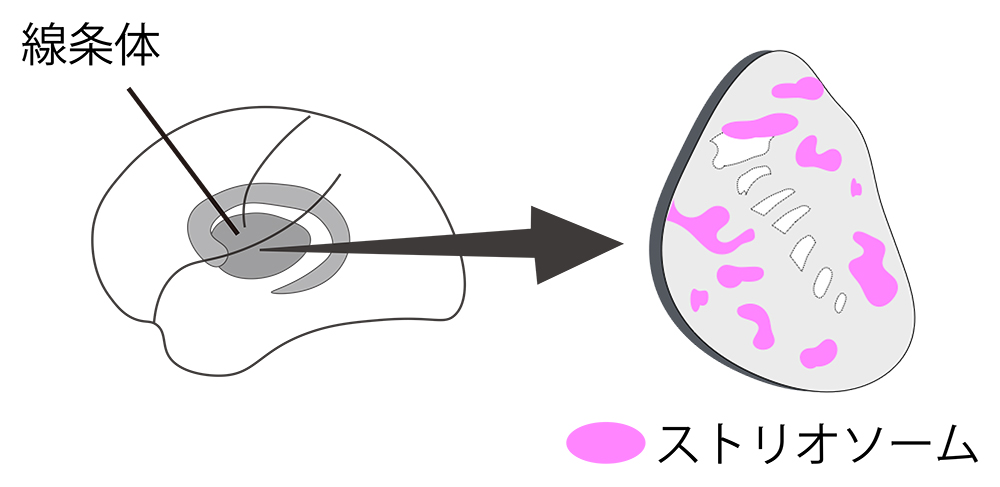
(図1)運動異常症に関与する大脳基底核線条体の
モザイク構造(模式図)
2)遺伝子改変マウスを利用した線条体モザイク構造の解明手法
特定の神経細胞集団の機能を明らかにするためには、その神経細胞集団だけに研究に必要な遺伝子を発現させるような遺伝子改変マウスを用いる手法が効果的です。研究グループはストリオソーム神経細胞がμオピオイド受容体注7)を強く発現することを利用して、μオピオイド受容体遺伝子にCre組換え酵素注8)を組み込んだ遺伝子改変マウスを作製していました。この遺伝子改変マウスとアデノ随伴ウイルスベクター注9)を用いて、線条体ストリオソーム区画優位に蛍光タンパク質注10)を導入することに成功していました(図2)。
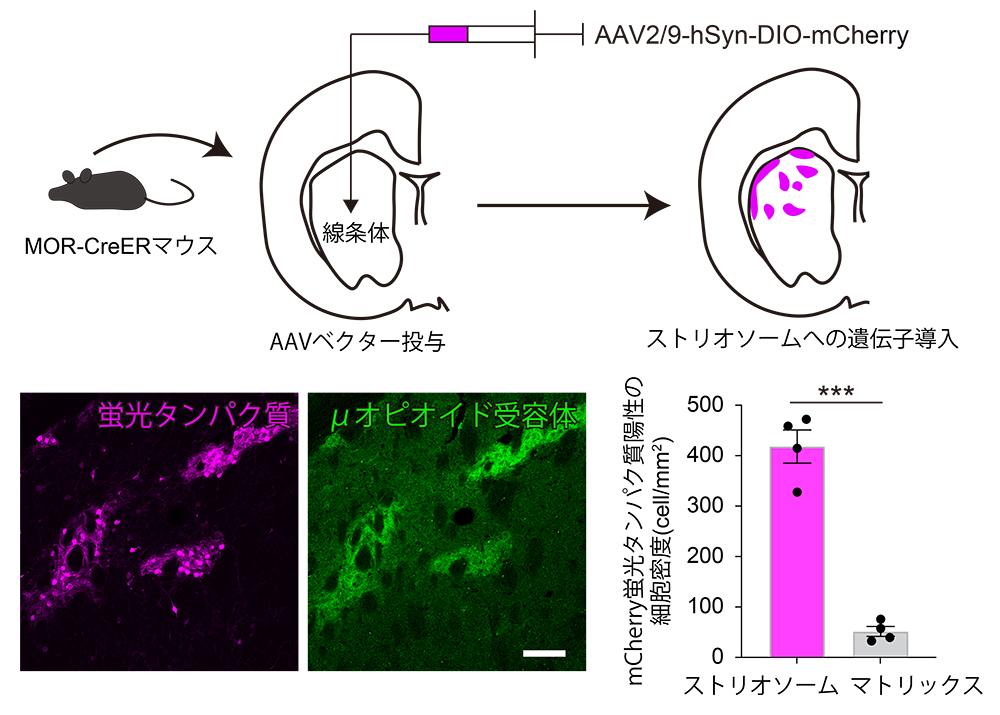
(図2)(上)遺伝子改変マウスにアデノ随伴ウイルスベクターを投与し、ストリオソームへの遺伝子導入を行う模式図。(下)線条体ストリオソームへのmCherry蛍光タンパク質導入。
3. 研究結果
1)MOR-CreERマウスは線条体ストリオソーム区画を標的とした人為的な神経活動操作を可能にする
線条体ストリオソーム構造を人為的に活性化させるために、アデノ随伴ウイルスベクターを用いてμオピオイド受容体を強く発現する細胞に、特殊な薬剤(deschloroclozapine、DCZ)により活性化される改変型のムスカリン性アセチルコリン受容体(designer receptor exclusively activated by designer drugs, DREADD注11))を発現させました。薬剤(DCZ)をマウスに投与することで、ストリオソーム区画の神経活動を優位に人為的に活性化させることに成功しました(図3)。
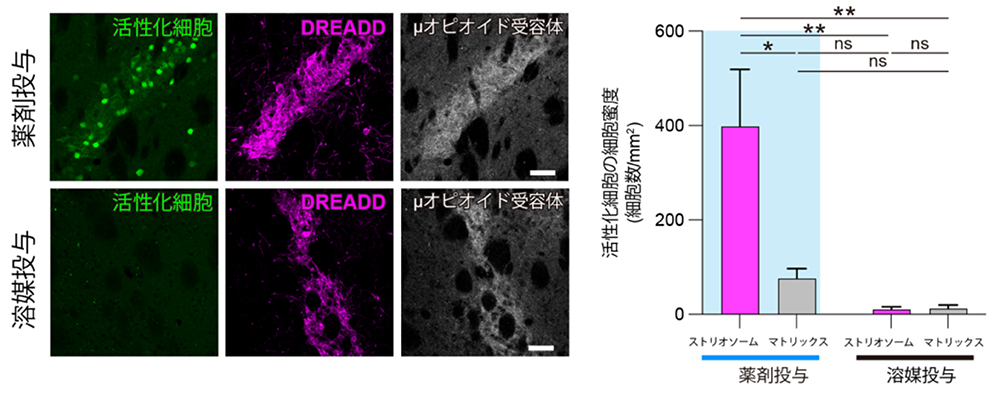
(図3)MOR-CreERマウスを利用して、線条体ストリオソーム区画を活性化する
2)ストリオソームはマウス自発運動において古典的大脳基底核モデルから予想される働きとは逆の働きを示す
今回利用したMOR-CreERマウスでは、ストリオソームの中でも直接路注12)と呼ばれる線条体投射細胞に主にDREADDが発現していました。従来の大脳基底核の直接路・間接路モデル注12)に基づくと、一般に線条体直接路の活性化によってマウスの運動量は増加し、対側への回転数は増加すると予想されました。しかし驚くべきことに、実際には一側のストリオソーム区画直接路の活性化によって、マウスの運動量が減少し、対側への回転数が減少しました(図4)。
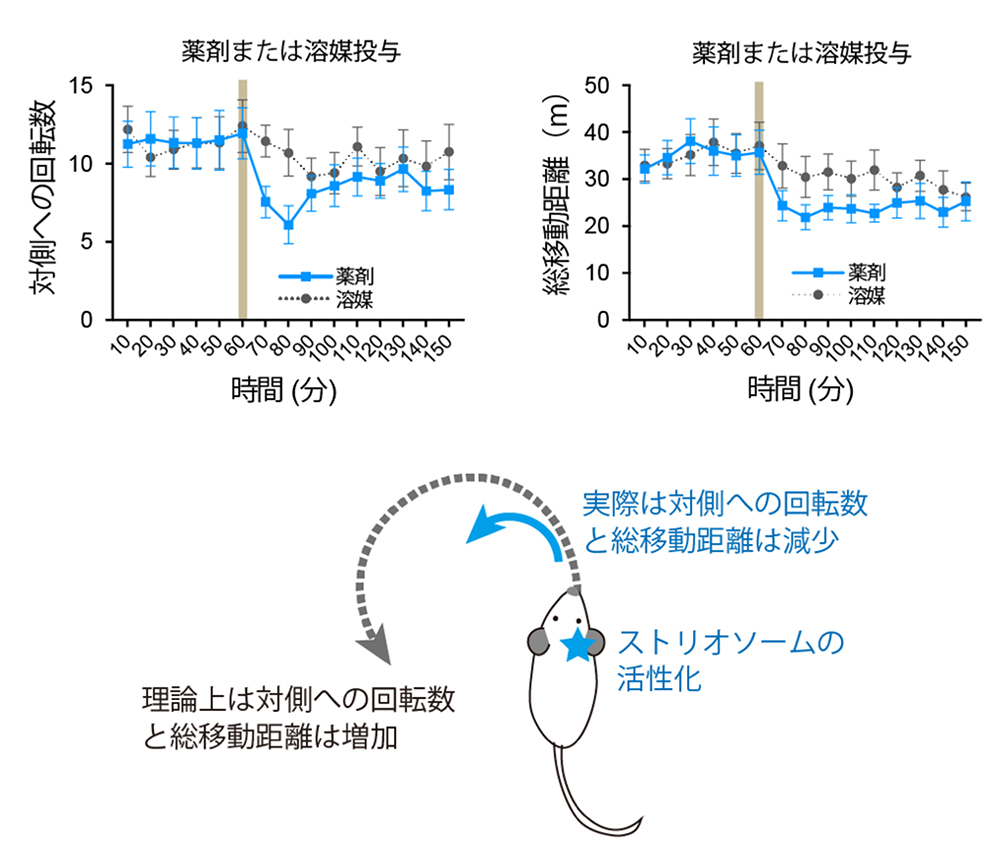
(図4)(左上)ストリオソームの活性化により、活性化部位と反対側への回転数が減少する。(右上)ストリオソームの活性化により、運動量が減少する。(下)古典的大脳基底核モデルから予想される運動変化と実際に観察された運動変化。
3)ストリオソームはドパミン放出を強力に抑制する
さらに、ストリオソームを活性化した際の、ドパミン信号の変化を解析しました。ドパミン信号の測定には、ドパミン感受性緑色蛍光タンパク質(GRABDA2m)注13)を用い、無線式の光ファイバー式蛍光測光装置(ファイバーフォトメトリー注14))によってマウス脳内の蛍光強度を測定しました。その結果、覚醒して自由に活動するマウスでは、ストリオソームの活性化によって、ドパミン信号は低下することを見出しました(図5)。ストリオソームは中脳ドパミン細胞へ神経細胞の線維を伸ばし、逆に中脳ドパミン細胞は線条体へ濃密なドパミン投射線維を送ることから、ストリオソームは、従来の大脳基底核の間接路・直接路モデルとは異なり、ドパミン放出の制御を介して、運動を制御している可能性が考えられました。
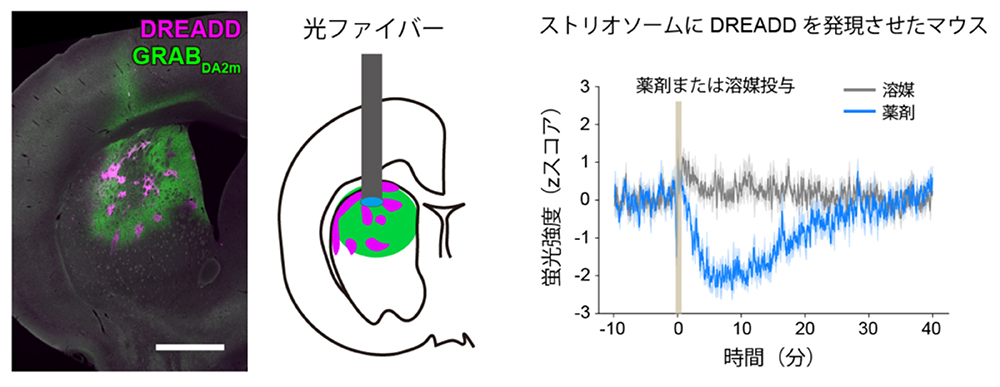
(図5)(左)ドパミン感受性蛍光タンパク質GRABDA2mの発現。(中)ファイバーフォトメトリーによる線条体のドパミン信号評価(模式図)。(右)線条体ストリオソームのDREADDによる活性化により、線条体でのドパミン信号強度は低下する。
4. まとめ
大脳基底核神経回路においてモザイク構造の運動制御にはたす役割は約半世紀にわたり謎でした。研究グループは、モザイク構造を形作るストリオソームは、古典的な大脳基底核の運動制御モデルから予想される働きとは逆の興味深い働きを有することを明らかにしました。さらに、ストリオソームはドパミン放出を強力に抑制していることを明らかにし、ドパミン制御を介してマウスの運動を制御している可能性が考えられました。今回明らかになった大脳基底核線条体のモザイク構造の運動制御機構に関する知見を手がかりにして、モザイク構造を標的としたヒトiPS細胞による運動異常症の病態モデル作製と治療法開発に役立つことが期待されます。
5. 論文名と著者
- 論文名
Striosome circuitry stimulation inhibits striatal dopamine release and locomotion - ジャーナル名
The Journal of Neuroscience - 著者
Taro Okunomiya1,2,3, Dai Watanabe4, Haruhiko Banno1,2, Takayuki Kondo2,3,5, Keiko Imamura2,3,5, Ryosuke Takahashi6,7*, Haruhisa Inoue1,2,3,5*
*:責任著者 - 著者の所属機関
- 京都大学医学部附属病院 先端医療研究開発機構(iACT)
- 京都大学iPS細胞研究所(CiRA)
- 理化学研究所 バイオリソース研究センター(BRC)
- 京都大学大学院医学研究科 生体情報科学講座
- 理化学研究所 革新知能統合研究センター(AIP)
- 京都大学医学部附属病院 脳神経内科
- 京都大学学術研究展開センター(KURA)
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会JSPS科研費- 若手研究「ストリオソーム神経細胞選択的な遺伝子操作マウスを用いた神経変性疾患の病態機序解明
(研究代表者:奥宮太郎、JP20K16494)」- 若手研究「線条体区画構造を標的とした疾患モデル開発による神経疾患の病態解明
(研究代表者:奥宮太郎、JP23K14776)」– 基盤研究(B)「点鼻タウワクチンによる脳内免疫応答の解明とナノ粒子のベクター利用
(研究代表者:井上治久、JP21H02807)」– 学術変革領域研究(A)「未病を在宅で検知する―デジタルバイオマーカーによる「身体の天気予報」
(研究代表者:坂野晴彦、JP23H03886)」 - 日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療プロジェクト-「次世代医療を目指した再生・細胞医療・遺伝子治療研究開発拠点
(研究代表者:髙橋淳、JP23bm1323001)」-「脳細胞ヒト化による神経病態と免疫応答解析の基盤技術開発
(研究代表者:井上治久、JP23bm1423012)」-「認知症保護的バリアントの機能解明に基づく治療の研究開発
(研究代表者:井上治久、JP 24wm0625501)」 - キヤノン財団研究助成プログラム
- 京都大学医学部附属病院iACT
7. 用語説明
注1)パーキンソン病
慢性進行性の神経変性疾患であり、動作緩慢、振戦、筋強剛といった運動症状が生じます。中脳のドパミン神経細胞が変性・脱落するに伴い線条体のドパミン含量が減少することで、線条体を含む大脳基底核の働きが変化し、運動症状が生じると考えられています。
注2)ハンチントン病
慢性進行性の神経変性疾患であり、舞踏運動、精神症状、認知症を主体とする常染色体顕性遺伝疾患です。線条体の神経細胞が変性・脱落するに伴い線条体を含む大脳基底核の働きが変化し、運動症状が生じると考えられています。
注3)ストリオソーム
パッチとも呼ばれ、線条体のモザイク構造を形成する区画です。ストリオソームの周辺領域はマトリックスと呼ばれます。モザイク構造は、様々な組織学的・遺伝学的マーカーにより区別されますが、最もよく使われる組織学的マーカーのひとつがμオピオイド受容体です。
注4)遺伝子改変マウス
生物の設計図であるゲノムに、人為的に遺伝子を導入したり、変異を加えたりして、改変を加えたマウス系統をさします。
注5)灰白質
中枢神経のなかで、神経細胞の細胞体が集まった部分。肉眼で脳を観察した時に、神経線維が走る白質と比べて、やや濃く灰色かかって見えることから灰白質と呼ばれます。
注6)ドパミン
ドーパミンとも呼ばれ、神経伝達物質のひとつで、神経細胞の活動を調節する役割をもちます。中脳から大脳に投射するドパミン神経が、運動や精神機能、学習に関与するとされています。
注7)μオピオイド受容体
モルヒネに代表されるオピオイド鎮痛薬と結合する7回膜貫通型のGタンパク共役型受容体。鎮痛作用の発現とその副作用に関与しています。本研究では、線条体ストリオソームを定義するマーカー遺伝子として用いました。
注8)Cre組換え酵素
バクテリオファージP1由来のDNA組換え酵素。2つのloxP配列を選択的に認識してDNA組み換えを生じさせます。loxP配列を工夫することで、Cre組換え酵素活性を有する細胞に目的とする遺伝子を発現させることができます。
注9)アデノ随伴ウイルスベクター
アデノ随伴ウイルスは小型の一本鎖DNAウイルスであり、本来のウイルスタンパク質の遺伝子の代わりに、研究のための蛍光タンパク質や、DREADDなどの外来遺伝子を組み込んで作製したものがアデノ随伴ウイルスベクターです。神経科学研究において一般的に使用されます。
注10)蛍光タンパク質
特定の波長の光に暴露すると励起し、蛍光を発するタンパク質。本研究では、mCherryと呼ばれる、緑色光により励起し赤色蛍光を発する蛍光タンパク質を用いました。
注11)DREADD (designer receptor exclusively activated by designer drug)
特定の薬剤(デザイナー薬剤)に選択的に応答する人工的な改変受容体の総称。神経科学研究で広く使われ、DREADDを用いた研究手法は化学遺伝学とも呼ばれます。本研究では、ムスカリン性アセチルコリン受容体に遺伝子変異が加えられた、内在性のアセチルコリンには反応せず特定の薬剤にのみ反応して神経細胞を活性化させるhM3Dq型のDREADDを用いました。デザイナー薬剤としてdeschloroclozapineを用いて、デザイナー薬剤を含まない溶液(溶媒)を投与した際の結果と比較することにより、特定の細胞群を活性化した際の変化を評価しました。
注12)直接路、直接路・間接路モデル
線条体からの出力を伝える神経回路を、直接路と間接路という2つの経路に分けることよって理解するモデル。1990年前後に提唱され、パーキンソン病やハンチントン病の運動症状や、ドパミン補充療法の効果を説明可能なため、大脳基底核の運動制御理解の基盤となっています。直接路は運動を促進し、いわば車のアクセルとしてはたらきます。今回活性化した細胞群は多くがストリオソーム内の直接路に分類されるため、直接路・間接路モデルに基づけば、対側への回転数は増加し、運動量は増加するはずでした。
注13)ドパミン感受性緑色蛍光タンパク質
ドパミン受容体に緑色蛍光タンパク質を融合させ、ドパミン濃度が上昇すると蛍光輝度が上昇するように改変した蛍光タンパク質。本研究では、GRABDA2mと呼ばれる、青色光で励起され緑色蛍光を発するドパミン感受性緑色蛍光タンパク質を用いました。
注14)ファイバーフォトメトリー
表面からは観察することが難しい深部の組織の蛍光を観察するために、細長い光ファイバーを目的の組織まで埋め込み観察する手法。体外へ導いた光ファイバーを1〜2m離れた計測機器まで長く伸ばす有線式と、短い光ファイバー先端に接続された小型計測機器を頭部に固定し、離れた受信機で信号を受け取る無線式があります。