2024-12-17 医薬基盤・健康・栄養研究所
国立研究開発法人医薬基盤・健康・栄養研究所(大阪府茨木市 理事長 中村祐輔)創薬デザイン研究センター創薬標的プロテオミクスプロジェクト 足立淳副センター長のグループは、がん研究会有明病院大腸外科 福長洋介部長(現・関西医科大学総合医療センター 下部消化管外科学講座 理事長特命教授)、がん研究会有明病院肝胆膵外科 高橋祐部長、宇治徳洲会病院消化器外科 長山聡部長、京都大学大学院医学研究科小濱和貴教授のグループと共同で、予後の悪い大腸がん肝転移[注1]に対する治療標的を発見しました。詳細は以下のとおりです。
【研究成果のポイント】
質量分析計を用いた高感度リン酸化シグナル[注2]解析によって、薬剤治療中に再発した悪性の大腸がん肝転移でキナーゼの一種であるPAK1[注3]が活性化していることを発見しました。
大規模な薬剤感受性情報(様々な薬剤に対する効き目(感受性)をがん細胞ごとに集積した情報)とリン酸化シグナル情報を用いて、がん細胞のリン酸化シグナルの特徴からがん細胞に適した薬剤候補をランキングする薬剤選択手法を開発しました。
上記薬剤選択手法を用いてPAK1キナーゼ活性が高い大腸がん細胞株に適した薬剤を予測すると複数のPI3K[注4]阻害剤がランキングされました。
PI3K阻害剤の一つであるCopanlisib(コパンリシブ)が抗腫瘍効果を有することを大腸がん細胞株及びマウス実験で確かめました。
本研究成果をもとにして、今後、難治性の大腸がん肝転移に対する新たな治療法の開発が期待されます。
本研究成果は2024年12月17日(日本時間)にCell Reports誌に発表されました。
ウェブサイト:https://doi.org/10.1016/j.celrep.2024.115061
研究の背景と意義
近年の分子標的薬の開発及び集学的治療により、大腸がんの生存率は飛躍的に改善しました。しかしながら、化学療法に不応、耐性になった場合、耐性になったがん細胞に対して有効な治療法の選択肢がないために、1次治療が奏功しない場合、2次治療の奏功率は10-15%程度と予後が悪いのが現状です。がん組織における不応・耐性機構の実態は未だよく理解されておらず、化学療法耐性機序に基づいた新たな治療法の開発は実臨床においても重要な課題です。
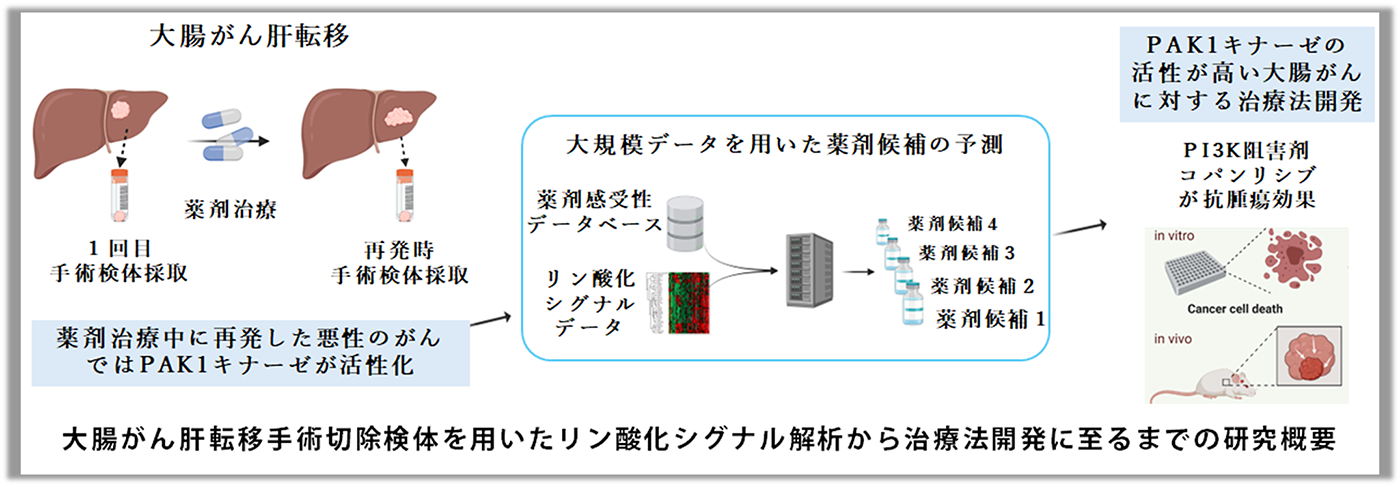
大腸がんは、原発巣だけでなく転移・再発巣も可能であれば繰り返し切除することが推奨される唯一のがん種であり、同一症例(患者)で化学療法前後の検体を比較したプロテオーム解析を行うことができます。そこで大腸がんの術後補助化学療法[注5]前後で採取された同一患者の肝転移巣の経時比較解析を行うことで、個人差を乗り越えて、化学療法耐性に関わる細胞内シグナルを同定することを試みました。
本研究の内容
(Ⅰ 術後の化学療法前後での臨床検体のキナーゼ活性比較)
術後補助化学療法中に再発を認めた症例群(During群)と術後補助化学療法後に再発した症例群(After群)を群間比較すると、During群の患者は予後が有意に不良でした。そこで、臨床検体から得られた2万個超のリン酸化定量データからそれぞれの群の化学療法前後でのキナーゼ活性変動プロファイルを取得し、群間比較を行うとDuring群においてキナーゼの一種であるPAK1が最も有意に活性化していました。
(Ⅱ 治療標的薬剤候補のランキング手法の開発)
我々は治療標的薬剤候補を高精度かつ効率的に探索するために、大腸がん培養細胞35株のリン酸化プロテオーム解析データ、公共の薬剤感受性データ(CTD2)を取得・収集し、これらの大規模情報を用いて、着目したキナーゼ等のリン酸化シグナルの特徴を持つがん細胞に対して効果の高い薬剤をランキングする手法を開発しました。
この手法を用いて、Ⅰで見出した治療標的候補、PAK1の活性が高い細胞に対して効果のある薬剤をランキングすると、Top5の薬剤候補が全てPAK1の上流キナーゼであるPI3Kの阻害剤でした。
(Ⅲ PI3K阻害剤の大腸がんへの効果の検証)
そこでPAK1が活性化している5種類の大腸がん細胞株を用いて、米国食品医薬品局(FDA)承認済のPI3K阻害剤をスクリーニングすると、濾胞性リンパ腫の治療に使用されているPI3K阻害剤Copanlisibが全ての大腸がん細胞株に対して増殖抑制効果を示しました。さらにPAK1高活性大腸がん培養細胞を移植して腫瘍を形成したマウスを用いた実験では、Copanlisib投与群では腫瘍の増殖が抑制されました。また薬理リン酸化プロテオーム解析により、Copanlisib投与群ではPI3K-PAK1シグナルが抑制されていることも細胞及びマウスを用いた実験で確認されました。
結論として、治療の前後で経時的に採取された同一患者肝転移巣の経時比較解析を行うことで、
(ⅰ)PI3KからPAK1に至るシグナル経路が化学療法耐性を克服するために有効な治療標的となること、(ⅱ) (ⅰ)の治療標的について、PI3K阻害剤Copanlisibが有望な薬剤候補であることが分かりました。
研究支援
本研究成果は、日本学術振興会 科学研究費補助金(19H03530)、JST CREST(JPMJCR24T1)の支援を受けました。
論文情報
論文タイトル:Longitudinal Phosphoproteomics Reveals PI3K-PAK1 Axis as a Potential Target for Recurrent Colorectal Liver Metastases.
著者:Daigo Gunji, Yuichi Abe, Satoshi Muraoka, Ryohei Narumi, Junko Isoyama, Narumi Ikemoto, Mimiko Ishida, Akina Shinkura, Takeshi Tomonaga, Satoshi Nagayama, Yosuke Fukunaga, Yu Takahashi, Yoshiharu Sakai, Kazutaka Obama, and Jun Adachi*(* 責任著者)
掲載雑誌:Cell Reports
用語解説
注1 大腸がん肝転移
大腸がんが進行し、がん細胞が血流を通じて肝臓に移動し、そこで新たな腫瘍を形成する状態です。肝転移は大腸がんでは最も頻繁に見られる転移であり、治療と予後において重要な要素となります。
注2 リン酸化シグナル
細胞内外の刺激に対して細胞膜上・細胞質中のタンパク質が、リン酸化反応を介して、情報伝達を行うことです。がん細胞の増殖、転移、細胞死等に重要な役割を果たしています。
注3 PAK1
PAK1(p21-activated kinase 1)は、セリン/スレオニンキナーゼの一種であり、細胞内のさまざまなシグナル伝達経路に関与しています。PAK1は、RhoファミリーのGTPアーゼであるCdc42やRac1と相互作用し、これらのGTPアーゼによって活性化されます。PAK1は細胞の形状変化、運動、増殖、アポトーシス、細胞周期の進行などに重要な役割を果たしています。特に、がんにおいてはPAK1の過剰な活性化が腫瘍の成長や転移を促進するため、PAK1を標的とした治療法が研究されています。
注4 PI3K
PI3K(ホスファチジルイノシトール3-キナーゼ)は、細胞内で重要な役割を果たす酵素のファミリーであり、細胞増殖、分化、移動、生存、代謝などに関与するシグナル伝達経路において中心的な役割を担っています。PI3Kは、細胞膜のリン脂質であるPI(ホスファチジルイノシトール)をリン酸化し、さまざまな細胞内シグナル伝達プロセスを活性化します。PI3K経路は、がんにおいてしばしば異常に活性化されています。この経路の異常は、遺伝子変異や過剰なシグナル伝達によって引き起こされ、がん細胞の増殖、転移、治療抵抗性に寄与します。
注5 術後補助化学療法
がんの手術後に行われる化学療法のことです。手術によってがん組織を取り除いた後に、残っているかもしれない微小ながん細胞(目に見えないレベルのがん細胞)を排除し、再発を防ぐ目的で行われます。特に、手術だけでは完全に取り切れない可能性がある場合や、がんの再発リスクが高い場合に使用されます。
医薬基盤・健康・栄養研究所について
2015年4月1日に医薬基盤研究所と国立健康・栄養研究所が統合し、設立されました。本研究所は、メディカルからヘルスサイエンスまでの幅広い研究を特⾧としており、我が国における科学技術の水準の向上を通じた国民経済の健全な発展その他の公益に資するため、研究開発の最大限の成果を確保することを目的とした国立研究開発法人として位置づけられています。
ウェブサイト:https://www.nibiohn.go.jp/