マウス生体内で、短期間かつ効率的に心筋細胞を作製し、心臓の機能を改善することに成功
2017-12-22 慶應義塾大学医学部,国立研究開発法人日本医療研究開発機構,株式会社IDファーマ
慶應義塾大学医学部内科学(循環器)教室の家田真樹専任講師、宮本和享共同研究員らの研究グループは、心筋梗塞モデルマウスの心臓に、細胞のゲノムを損傷することなく3つの心筋誘導遺伝子(注1)を導入して、梗塞巣の心臓線維芽細胞(注2)を効率よく短期間で、かつ直接的に心筋細胞へ転換して、心機能を改善することに成功しました。
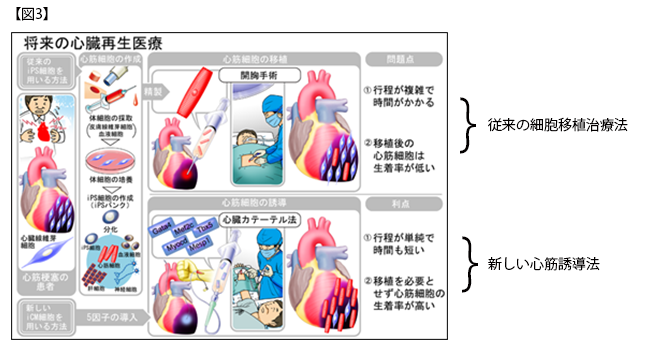
家田専任講師らは、細胞移植を必要としない新しい心筋再生法として、心臓に存在する心筋以外の心臓線維芽細胞に心筋誘導遺伝子を導入して、心筋を直接作製する研究を行っています。これまで、マウス生体内の心臓線維芽細胞に3つの心筋誘導遺伝子を、遺伝子の運び屋であるレトロウイルスベクター(注3)を用いて導入し、マウス生体内で直接的に心筋細胞を作製できることなどを報告してきました(注4)。しかし、これまでの方法では、1) 心筋誘導の際に、ウイルスによって3つの遺伝子が組み込まれるために、細胞のゲノムを損傷する可能性がある、2) 心筋誘導効率が低く、心筋作製に長期間かかるという課題がありました。
本研究で、家田専任講師らは3つの心筋誘導遺伝子を同時に発現するセンダイウイルスベクター(注5)(以下、心筋誘導センダイウイルスベクター)を、株式会社IDファーマと共同で開発しました。この心筋誘導センダイウイルスベクターを用いて、培養皿上で、効率よく短期間でマウスおよびヒト線維芽細胞から心筋細胞をゲノムの損傷なく、直接的に作製することに成功しました。さらに心筋誘導センダイウイルスベクターをマウス心筋梗塞モデルの心臓に導入すると、1週間で心筋再生が始まり、1か月後には心機能が改善することを確認しました。
本研究成果は細胞移植を必要としない新しい心筋再生法であり、将来、心筋梗塞や拡張型心筋症をはじめとするさまざまな心臓疾患に対する再生医療への応用が期待されます。今回の研究成果は、2017年12月21日(米国東部時間)に国際科学雑誌『Cell Stem Cell』のオンライン速報版で公開されます。
研究の背景と概要
心筋梗塞、拡張型心筋症などの心臓病で心筋細胞が失われると、その部分は心臓内にある線維芽細胞の増殖、線維化により置き換えられ、心臓ポンプ機能が低下します。そのため、iPS細胞(注6)などの多能性幹細胞から作製する心筋細胞は、心臓病に対する細胞移植治療の細胞源として期待されています。しかしながら、iPS細胞等の幹細胞を用いる心臓再生治療の課題として、幹細胞混入に伴う腫瘍形成の可能性、移植後の細胞の長期生着が困難、大量に心筋細胞を作成するコストが膨大などの課題があります。また現時点では、心臓病で一度線維化を起こし、正常な機能が失われた組織を元の心筋組織に戻す治療はありません。そこで家田専任講師らは、これらの課題を解決する新しい再生法として、心臓内の心筋以外の細胞である心臓線維芽細胞に心筋誘導遺伝子を導入して、iPS細胞のような多能性幹細胞を経ずに、直接的に心筋細胞を作製して、心機能を回復する方法を開発してきました。
本研究に先駆け、2010年に家田専任講師らはマウス心筋細胞を作り出すために必要な「心筋誘導遺伝子」(iPS細胞を樹立するときの細胞の初期化に必要な4因子である「山中ファクター」にあたる)として、Gata4、Mef2c、Tbx5を見出しました(Ieda et al, Cell, 2010)。またマウス生体内に、遺伝子の運び屋であるレトロウイルスベクターで3つの心筋誘導遺伝子を導入して、心臓内の線維芽細胞を心臓内で心筋細胞へと転換できることを報告しました(Inagawa et al, Circ Res, 2012)。さらにヒトの「心筋誘導遺伝子」として、5遺伝子(Gata4、Mef2c、Tbx5、Myocd、Mesp1)あるいは6遺伝子(5遺伝子+miR-133)を確認しました(Wada et al, PNAS, 2013、Muraoka et al, EMBO J, 2014)。しかし、これまでの研究で用いられてきたレトロウイルスベクターは、1)ウイルスによって遺伝子が組み込まれるために、細胞のゲノムを損傷する可能性がある、2)心筋誘導効率が低く、心筋作製まで時間がかかるという課題がありました。
研究の成果と意義・今後の展開
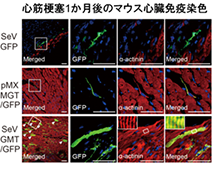
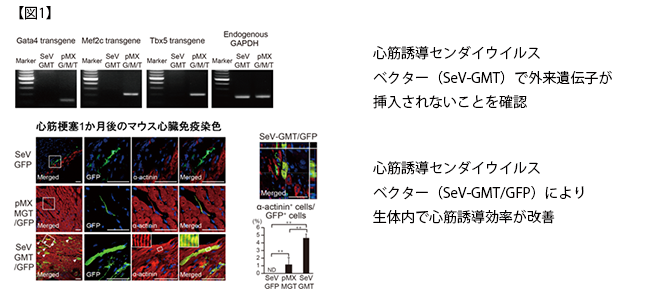
本研究で、家田専任講師らは株式会社IDファーマと共同で、マウスおよびヒト細胞の心筋誘導遺伝子を運び、細胞内で発現させる心筋誘導センダイウイルスベクターを開発しました。これまでの培養皿上で、レトロウイルスベクターを用いてマウス線維芽細胞から心筋細胞を誘導する方法では、拍動する心筋細胞の作成効率は約0.1%で、作成までに約1か月かかりました。一方、心筋誘導センダイウイルスベクターによる新しい方法では、心筋作製効率は約10%と従来法の100倍に改善し、さらに拍動する心筋細胞を約10日間で作成することができました。また心筋誘導センダイウイルスベクターを用いる方法では、細胞のゲノム内に心筋誘導遺伝子が挿入されず、ゲノムの損傷がないことも確認されました(図1)。さらにヒト心臓線維芽細胞では5あるいは6つの心筋誘導遺伝子を心筋誘導センダイウイルスベクターで導入し、約15%の効率で、iPS細胞のような多能性幹細胞を経ることなく直接的に心筋細胞を作製することに成功しました。
次に生体内での心筋誘導を比較検討するため、マウス心筋梗塞モデルで3つの心筋誘導遺伝子をレトロウイルスベクターあるいは心筋誘導センダイウイルスベクターでマウス心臓内に導入しました。1週後のマウス生体内での心筋誘導効率は、レトロウイルスベクターでは約0.5%で、誘導した心筋細胞も未熟型でしたが、心筋誘導センダイウイルスベクターでは心筋誘導効率が約1.5%に上昇し、成熟した心筋細胞作成に成功しました。さらに免疫不全マウスの心筋梗塞モデルでは、1か月後の生体内での心筋誘導効率がレトロウイルスベクターで約1%であるのに対して、心筋誘導センダイウイルスベクターでは約5%まで改善しました。さらに、心筋誘導センダイウイルスベクターによる治療群では、無治療群と比較して、1か月後の心臓のポンプ機能が改善し、心筋梗塞後の線維化組織が約半分に縮小しました。また不整脈や他臓器で心筋細胞が誘導されるなどの副作用は観察されませんでした。
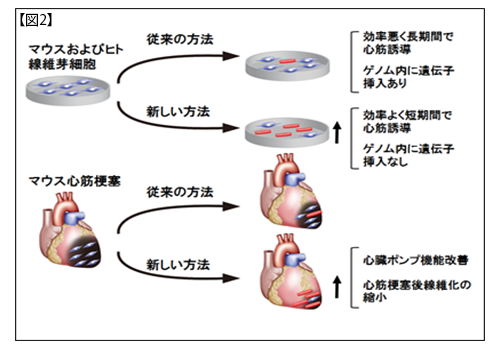
これらの結果により、研究グループでは、細胞のゲノムを損傷することなく、効率よく短期間で、心筋を心臓内で直接的に誘導する心筋再生法の確立に成功しました(図2)。今後、心筋誘導センダイウイルスベクターの免疫原性の改善や大動物での安全性・有効性の検証が必要ですが、本研究成果は細胞移植を必要としない新しい心臓再生医療実現を前進させる大きな一歩であると考えます(図3)。
従来法のレトロウイルスベクターと新しい方法の心筋誘導センダイウイルスベクターによる心筋誘導の比較
(上段)マウスおよびヒト線維芽細胞から心筋誘導
(下段)マウス心筋梗塞モデルで生体内心筋誘導
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム「幹細胞・再生医学イノベーション創出プログラム」、難治性疾患実用化研究事業「心臓線維芽細胞をターゲットとする心筋再生遺伝子治療薬の開発」、JSPS 科研費 JP25670394、JP16K19428、慶應義塾次世代研究プロジェクト推進プログラム、慶應義塾大学博士課程学生研究支援プログラム、公益財団法人武田科学振興財団、公益財団法人先進医薬研究振興財団、公益財団法人ノバルティス科学振興財団の支援を受けて行われました。
論文
- タイトル:
- Direct In Vivo Reprogramming with Sendai Virus Vectors Improves Cardiac Function after Myocardial Infarction
- 日本語訳:
- センダイウイルスベクターを用いた生体内心筋リプログラミングにより心筋梗塞後の心機能が改善
- 著者名:
- 宮本和享、秋山瑞葉、田村文弥、礒見まり、山川裕之、貞廣威太郎、村岡直人、児島秀典、萩庭頌、黒津祥太、谷英典、リーワン、リークワン、井上誠、井出吉紀、黒川洵子、山本恒久、関倫久、饗庭了、山岸敬幸、福田恵一、家田真樹
- 掲載誌:
- Cell Stem Cell オンライン版
用語解説
- (注1)心筋誘導遺伝子:
- 家田専任講師らが発見した心筋細胞を直接作製するために必要な3つの遺伝子群(Gata4,Mef2c,Tbx5)や、ヒト心筋細胞を直接作製する5遺伝子(Gata4、Mef2c、Tbx5、Myocd、Mesp1)あるいは6遺伝子(5遺伝子+miR-133)で、iPS細胞を樹立する時の「山中ファクター」にあたる。これら遺伝子群を線維芽細胞に導入すると、iPS細胞を経ることなく心筋細胞を直接作製できる。
- (注2)心臓線維芽細胞:
- 心臓内結合組織を構成する細胞で細胞外基質、液性因子を分泌する。心筋梗塞や拡張型心筋症などの病態では、心筋細胞数の減少に伴い心臓線維芽細胞が増殖し、心臓ポンプ機能障害や心臓線維化が起きる。
- (注3)レトロウイルスベクター:
- ベクターとは、細胞外から内部へ遺伝子を導入する際の「運び屋」を指す。目的遺伝子をウイルスに組み込み、細胞に感染させることにより遺伝子を導入する。レトロウイルスベクターは、 このウイルスベクターの1種類として確立されたもので、宿主の細胞に感染したあと、宿主のゲノム(DNA)のなかに入り込み遺伝子を発現する。
- (注4)
- Induction of cardiomyocyte-like cells in infarct hearts by gene transfer of Gata4, Mef2c, and Tbx5.(日本語訳:Gata4, Mef2c, Tbx5導入により心筋梗塞部位で直接心筋様細胞を作製著者: Masaki Ieda他、掲載誌:Circulation Researchオンライン版 2012年8月29日)
- (注5)センダイウイルスベクター:
- センダイウイルスベクターは、ウイルスベクターの1種類として確立され、宿主の細胞に感染したあと、宿主のゲノム(DNA)に入り込むことなく、細胞質内で遺伝子を発現し細胞のゲノムを損傷することがない。これまでに「山中ファクター」を発現するセンダイウイルスベクターが開発されており、細胞のゲノムを損傷することなく、効率よく短期間でiPS細胞を作成できることが知られている。
- (注6)iPS細胞:
- 体細胞に特定の遺伝子(山中ファクター)を導入することにより樹立される、ES細胞のように多くの細胞に分化することができる人工多能性幹細胞。2006年に京都大学山中伸弥教授の研究グループにより世界で初めてマウス体細胞を用いて樹立された。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部内科学(循環器)
専任講師 家田 真樹(いえだ まさき)
AMED事業に関するお問い合わせ先
国立研究開発法人 日本医療研究開発機構
戦略推進部 再生医療研究課
戦略推進部 難病研究課
IDファーマに関するお問い合わせ先
株式会社アイロムグループ CEOオフィス