2025-02-21 東京大学定量生命科学研究所
発表概要
発表のポイント
- 稀少疾患で共通する「遺伝子スイッチ」の異常を発見
コルネリア・デ・ランゲ症候群(CdLS)とCHOPS症候群の患者細胞で、エンハンサー(遺伝子ON/OFFを制御する領域)が正常に働いていないことを突き止めました。 - ゲノムDNAの大きなまとまり(TAD)は変わらず、細かい“ループ”のみが弱まる
ゲノムDNAの大枠(TAD)はそのままなのに、エンハンサーと遺伝子をつなぐ“輪っか構造”が弱まり、遺伝子の働きが落ちることがわかりました。 - がんなど幅広い疾患にも応用が期待
コヒーシンやAFF4の変異は白血病でも確認されており、この発見は希少疾患だけでなく、がんを含む多くの病気の新たな治療・診断法につながる可能性があります。
「遺伝子スイッチ」を乱す稀少疾患で共通のしくみ
図では電灯のスイッチを遺伝子のスイッチに例えています。健常者(左)ではスイッチは正常ですが、疾患(右)ではスイッチの共通の構造がうしなわれていました。(写真はAlena TS/ShutterstockとInframe36x24/Shutterstock)
概要
東京大学定量生命科学研究所の坂田豊典助教、白髭克彦教授らの研究グループは、カロリンスカ研究所、テキサス大学サウスウェスタンメディカルセンター、ノースウェル・ヘルスザッカー医科大学との共同研究により、稀少疾患(注1)であるコルネリア・デ・ランゲ症候群(CdLS)(注2)とCHOPS症候群(注3)に共通する分子メカニズムを解明しました。
本研究では、次世代シーケンサー(注4)を用いた大規模解析によって、患者さん由来の細胞を対象に、ゲノムDNAの立体構造(注5)やタンパク質の結合状態を、ゲノムDNA全体にわたって、くまなく調べました。その結果、CdLSとCHOPS症候群のどちらでも、エンハンサー(遺伝子のスイッチ)と呼ばれるゲノムDNAの領域で、コヒーシンが減少しているだけでなく、BRD4(転写を調節するタンパク質)やヒストンH3K27ac(ヒストンに付く修飾)も少なくなり、エンハンサーと遺伝子をつなぐ“輪っか(ループ)構造”(注6)も弱まっていることがわかりました。一方、ゲノムDNAを大枠で区画する「TAD」という構造(注7)はほぼ正常だったため、エンハンサー部分の異常こそが、これらの疾患の主な原因と考えられます(図1)。
CdLSやCHOPS症候群のような「コヒーシノパチー」(コヒーシンやコヒーシンと関係のある遺伝子の異常が原因で起こる病気全体の呼び方)を解明することは、血液がん(白血病など)を含む幅広い病気の仕組みを明らかにするうえでも非常に重要です。本研究の成果は、エンハンサーを中心とした遺伝子スイッチの異常が、がんの発症や重症化においても大きな役割を担っている可能性を示すものであり、今後の治療法や診断法の開発に大きく貢献すると期待されます。
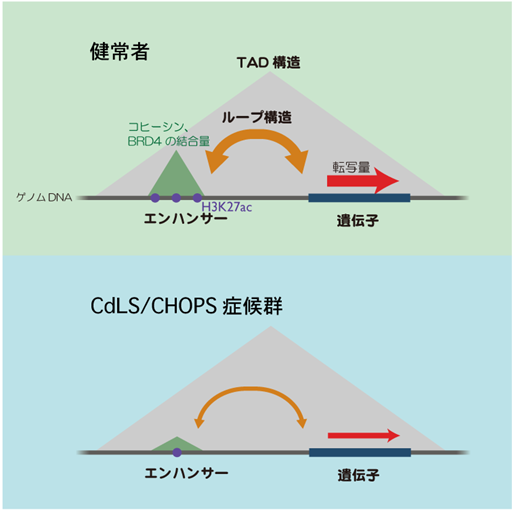
図1:疾患患者由来の細胞におけるエンハンサー領域の異常
CdLSとCHOPS症候群患者由来の細胞では、エンハンサー領域でコヒーシン、BRD4、H3K27acが減少しており、ゲノムの立体構造(ループ)も弱まっていました。これらの異常が遺伝子の転写量の減少の原因となっていると考えられます。一方で、より大きな構造であるTAD構造には大きな変化は見られませんでした。
発表内容
研究の背景
私たちの体の設計図であるゲノムDNAには、多くの「遺伝子」が存在します。これらの遺伝子がいつ、どのように働くかは、「エンハンサー」と呼ばれる特別なDNA領域によってコントロールされています。エンハンサーが正しく働くためには、DNAの立体構造が正常に保たれていることが重要です。その立体構造を整理する役目を担うのが、「コヒーシン」と呼ばれるタンパク質複合体です。特に、「NIPBL」というタンパク質は、このコヒーシンがDNAに適切に結合し、正しく機能するようサポートします。コルネリア・デ・ランゲ症候群(CdLS)では、しばしばNIPBLに異常が起こり、体の成長や知能の発達に影響を及ぼすことが知られています。一方、CHOPS症候群は、「AFF4」という遺伝子の異常が原因で、やはり似たような症状を引き起こします。AFF4は、遺伝子を読み取る装置(RNAポリメラーゼ)がスムーズに働けるよう調節する重要なタンパク質です。どちらの病気も、遺伝子の働き方が乱れることで症状が出ると考えられていましたが、その詳しい仕組みはまだわかっていませんでした。
研究の内容
そこで私たちは、NIPBLに異常を持つCdLSの患者さんと、AFF4に異常をもつCHOPS症候群の患者さんから提供された細胞を調べました。次世代シーケンサーを使った大規模なDNA解析技術により、
- ゲノムDNAの立体構造
- DNA上のどこにタンパク質が結合しているか
- 実際にどんな遺伝子が働いているか
を余すところなく分析しました。その結果、エンハンサーが遺伝子スイッチとして機能するために不可欠と考えられている以下の要素が、両疾患の細胞で大きく減少していることがわかりました(図2)。
- コヒーシン本体およびNIPBL
- BRD4(エンハンサーを認識し、転写を調節するタンパク質)
- ヒストンH3K27ac(エンハンサー活性化の目印となる修飾)
- エンハンサーと遺伝子を“近づける”ための立体構造(ループ構造)
これらが損なわれると、エンハンサーが十分に働けず、遺伝子スイッチがうまくONにならないことが、CdLSとCHOPS症候群に共通する症状の一因だと考えられます。
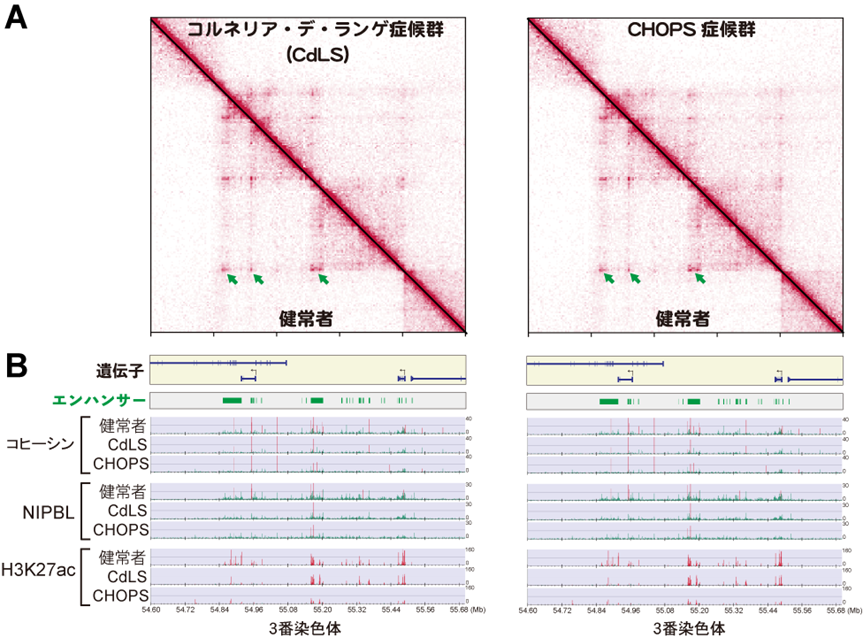
図2:ゲノムDNA立体構造とタンパク質結合プロファイルの可視化
(A)ゲノムDNA立体構造データを3番染色体の一部の領域で可視化しました。上部が患者細胞で、下部が健常者細胞での構造を示しています。赤い色が濃い場所ほど構造が強く形成されています。矢印はエンハンサーと遺伝子のループ構造を示しており、これらの構造は患者細胞では弱まって(色が薄く)見えます。(B)遺伝子とエンハンサーの位置と、健常者と患者細胞における各タンパク質の結合プロファイルを示しています。赤い領域にはより多くのタンパク質の結合が見られます。患者細胞では所々結合が減少して見えます。
今後の展望
コヒーシンやAFF4といった因子が、エンハンサーを正しく働かせるためにどのような役割を果たしているのか、さらに詳しく解明する必要があります。また、コヒーシンやAFF4の異常は、白血病などの血液がんでも報告されています。こうした研究を進めることで、稀な疾患だけでなく、がんなど多様な病気の発症メカニズムがより明らかになり、新しい治療法や診断法の開発につながることが期待されます。
〇関連情報:
本研究の重要性をさらに広い視点で解説する記事(Dispatch)が、今回の論文と同じ号に掲載されます。研究成果の背景や、今回の発見がどのような意味を持つかなどを詳しく紹介していますので、あわせてご覧ください。
発表者・研究者等情報
東京大学定量生命科学研究所 先端定量生命科学研究部門 ゲノム情報解析研究分野
坂田 豊典 助教(兼:カロリンスカ研究所 特任研究員)
橋本 咲 学術専門職員
坂東 優篤 講師
白髭 克彦 教授(兼:カロリンスカ研究所 客員教授)
テキサス大学サウスウェスタンメディカルセンター
泉 幸佑 准教授(兼:東京大学定量生命科学研究所 客員准教授)
ノースウェル・ヘルスザッカー医科大学
イアン D クランツ(Ian D. Krantz) 教授
研究助成
本研究は、日本学術振興会科研費「semi-in vivo系でのコヒーシンによる染色体機能と高次構造制御機構の解明(代表:坂田豊典、課題番号:22K06177)」、「機能的人工染色体の設計と利用のための革新的研究(代表:白髭克彦、課題番号:JPMJCR18S5)」、「発生・分化のゲノムモダリティと疾患(代表:白髭克彦、課題番号:20H05940)」、「コヒーシンによるエンハンソソーム制御:転写伸長反応制御の統合的理解に向けて(代表:白髭克彦、課題番号:20H05686)」、ならびに日本医療研究開発機構「クロマチン分子病理学による精密医療の実現」(AMED ASPIRE-A 代表:白髭克彦、課題番号P24jf0126003)、「先端エピゲノミクス・1細胞解析支援」(AMED BINDS代表:白髭克彦、課題番号24ama121020j0003)の支援により実施されました。
用語解説
(注1) 稀少疾患
患者さんの数がきわめて少なく、原因や治療法の解明が進みにくい病気の総称です。人口の一定割合以下しか発症者がいないため、研究の数が少なかったり、治療薬の開発が遅れがちになったりすることがあります。
(注2) コルネリア・デ・ランゲ症候群(CdLS)
遺伝子の異常が原因で、体の成長の遅れ、手足や顔立ちの特徴、学習面での遅れなど、多様な症状が現れます。1933年にオランダの小児科医コルネリア・カタリーナ・デ・ランゲによって初めて報告されました。
(注3) CHOPS症候群
CHOPSは、患者の示す特徴的な症状の英語頭文字(Cognitive impairment, Heart defects, Obesity, Pulmonary involvement, Short stature)をつなげた名称です。CdLSと似た症状が見られることが多く、CdLSとは違う遺伝子の異常で生じる“稀少疾患”の一つです。
(注4) 次世代シーケンサー
ゲノムDNAを高速かつ大量に読み取る(配列を解析する)ための先端技術です。従来の方法と比べて、はるかに短い時間で多くのDNA配列を調べることができます。病気の原因となる遺伝子異常や、細胞の中でのタンパク質結合の様子、ゲノムDNAの立体構造を余す所なくゲノムDNA全体について明らかにできるようになりました。
(注5)ゲノムDNAの立体構造
細胞の中のDNAは、ただの“ひものような形”ではなく、三次元的に折りたたまれ、部分的にループをつくって並んでいます。立体的な折りたたみ方が、遺伝子のスイッチ(エンハンサーなど)を調整し、細胞の働きに大きく影響します。いわば、「折り紙が折り方によって形が変わる」ように、DNAの折り方次第で遺伝子の働きも変わるのです。
(注6)ループ構造
DNAを“輪っか”のように折りたたむことで、離れたエンハンサーと遺伝子を近づけるしくみです。ループが弱まると、エンハンサーの働きが十分に伝わらなくなり、遺伝子のスイッチが入りにくくなります。
(注7)TAD構造
ゲノムDNAを大まかな“部屋”のように区切った構造のことです。同じTADの中にある遺伝子どうしは、互いに連絡を取りやすくなる性質があります。
アイキャッチ画像

雑誌名等
雑誌名:Current Biology
題 名:A common molecular mechanism underlying Cornelia de Lange and CHOPS syndromes
著者名:Toyonori Sakata*, Shoin Tei, Kosuke Izumi, Ian D. Krantz, Masashige Bando, Katsuhiko Shirahige*(*責任著者)
DOI: 10.1016/j.cub.2025.01.044
URL: https://doi.org/10.1016/j.cub.2025.01.044
問い合わせ先
東京大学定量生命科学研究所 先端定量生命科学研究部門 ゲノム情報解析研究分野
教授 白髭 克彦(しらひげ かつひこ)
東京大学定量生命科学研究所 総務チーム



