2025-02-27 国立がん研究センター,東京理科大学,千葉大学,長崎大学,熊本大学,千葉県がんセンター
発表のポイント
- これまでにReprimoはがん抑制的に働いていると考えられてきましたが、その分子メカニズムは不明でした。
- Reprimoタンパク質は細胞内から細胞外へ分泌されてがん細胞の細胞死を誘導することを発見しました。
- 細胞外へ分泌されたReprimoタンパク質が細胞膜表面上の受容体に結合すると、Hippo経路を介して細胞死が引き起こされる分子メカニズムを明らかにしました。
- 今後の研究を進めることで、Reprimoタンパク質自体が抗がん剤に応用できる可能性や、明らかになった分子的なシグナル伝達経路を標的にした新規の抗がん剤の開発が期待できます。
- 本研究成果は2025年2月6日に米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America:PNAS)に掲載されました。
概要
国立研究開発法人国立がん研究センター(東京都中央区、理事長:中釜 斉)研究所(所長:間野 博行)の基礎腫瘍学ユニットの大木 理恵子独立ユニット長率いる研究チームは、新しい細胞死誘導に関わるReprimoタンパク質の機能を明らかにしました。p53遺伝子注1は最も有名で重要ながん抑制遺伝子で、様々な遺伝子の制御に関わることが知られていますが、p53機能の全貌はいまだに解明されていません。
2000年に大木 理恵子独立ユニット長はp53遺伝子の制御を受けてがん抑制に関わるラテン語で「抑制」の意味のReprimo遺伝子(遺伝子シンボル:RPRM)を発見しましたが、これまでReprimoの分子機能は明らかになっていませんでした。
今回、特任研究員の滝川 雅大博士ら(現 東京理科大学 創域理工学部 生命生物科学科 助教)が、Reprimoタンパク質は細胞内から細胞外へと分泌され、Reprimoタンパク質を受け取ったがん細胞はアポトーシスと呼ばれる細胞死を起こすことを世界で初めて明らかにしました。正常な細胞ではがん抑制遺伝子p53遺伝子とReprimoが正常に働くことで細胞のがん化を抑制し、これらの機能を失うことでがん化が進行すると考えられます。また、Reprimoによる細胞死が起きた細胞内では、シグナル伝達経路として、カドヘリン様タンパク質受容体注2、Hippo経路注3、p73が必要であることも明らかになりました(図1)。
この発見により、Reprimoやその関連経路を標的とした新しい抗がん治療の開発が期待されます。今回の成果は、今後のがん治療研究に新たな道を開くものであり、これらの経路を標的にした抗がん剤の開発や、Reprimoタンパク質自体をがんの治療に応用することが期待されます。
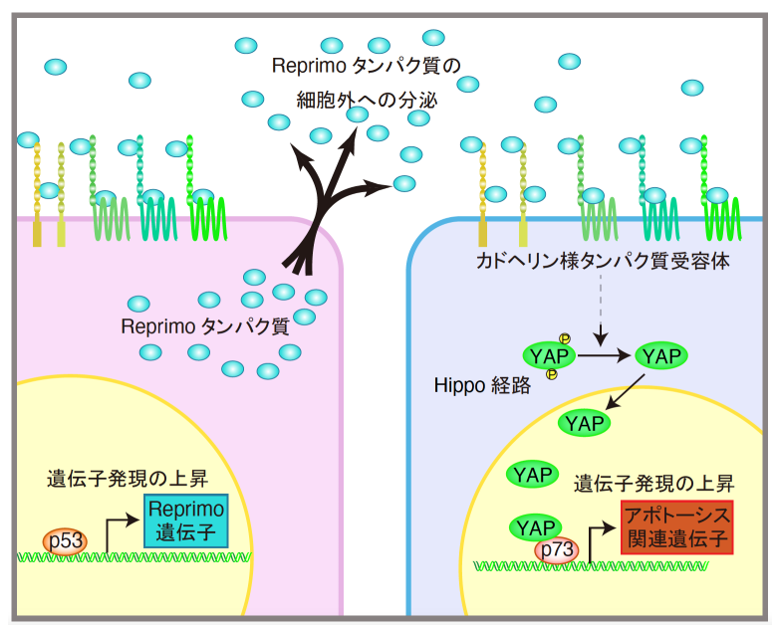
図1:Reprimoとは
左・ピンクの細胞の核内でp53によって転写誘導されたReprimo遺伝子からReprimoタンパク質が作られ、Reprimoタンパク質は細胞外へ分泌される。分泌されたReprimoタンパク質はがん化している右・紫の細胞膜上の受容体に結合し、細胞増殖に関わるHippo経路に働きかけることで、遺伝子の転写を担うYAP注3という因子が核内へ蓄積する。YAPはがん細胞の核内でp53に類似した性質をもつp73注4を活性化させ、アポトーシスを誘導する。
背景
がん抑制遺伝子p53の新たなメカニズム解明が、がん治療の新展開へ
がんは遺伝子に傷がつくことで発生します。中でも、がん抑制遺伝子であるp53遺伝子は、最も頻繁に変異が発見されるため、がん抑制において重要な役割を果たしていることが広く知られています。p53は、さまざまな遺伝子の働きを制御しており、Reprimo遺伝子もその制御を受けています。Reprimo遺伝子が活性化するとReprimoタンパク質が生成されます。Reprimoはがん抑制に関与していることが確認されていましたが、これまでReprimoの機能は解明されていませんでした。今回の研究では、Reprimoがどのようにがん抑制に関与するのか、その分子メカニズムの解明に挑みました。
研究成果
Reprimoタンパク質の分泌とがん細胞死のメカニズムを解明
研究チームは、Reprimoタンパク質が細胞外に分泌されていることを実験的に発見しました。このReprimoタンパク質の機能を解明するため、精製したReprimoタンパク質をがん細胞株に添加したところ、がん細胞が死滅する現象を確認しました。さらに、Reprimoタンパク質を子宮頸がん細胞株HeLaに添加した実験では、がん細胞が制御された細胞死(アポトーシス)を起こしていることが明らかになりました。その他にも、腎がん細胞株ACHN細胞、肺がん細胞株H1299細胞、腎臓由来の細胞株HEK293細胞に対しても同様の結果を得ることができました。(図2)。
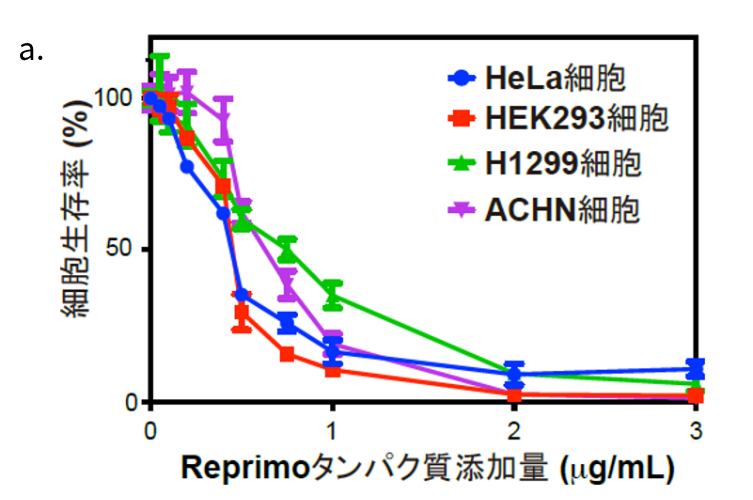
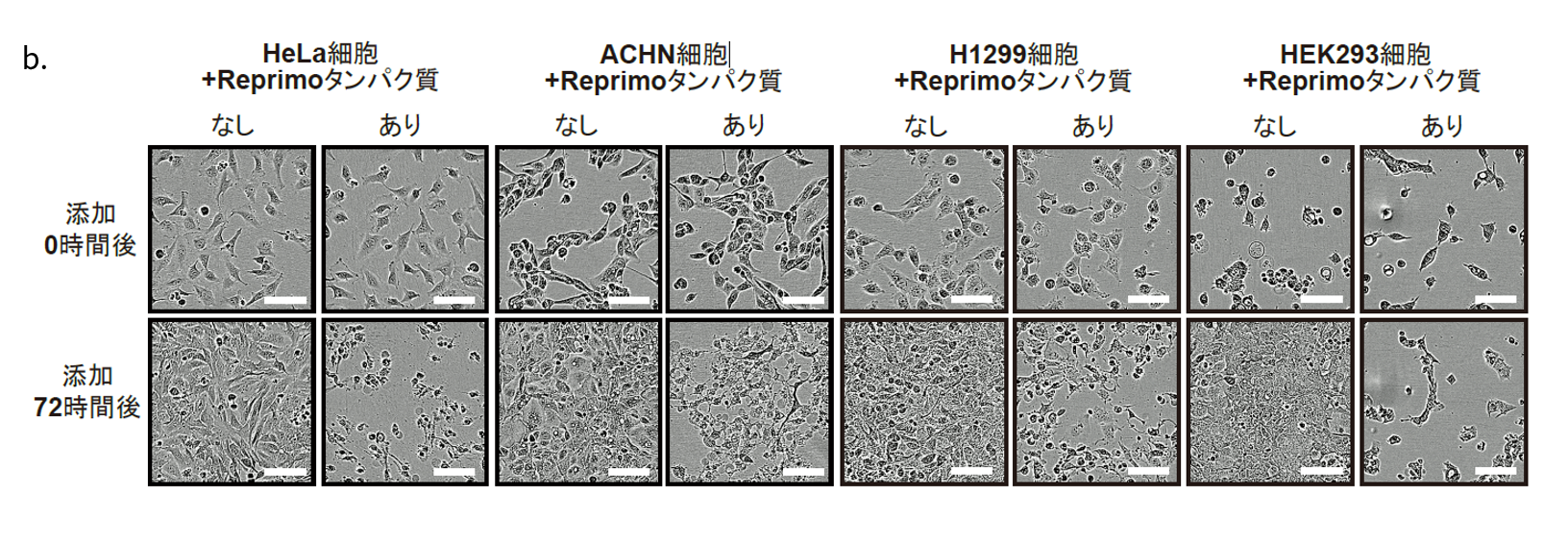
図2:
a.Reprimoタンパク質の添加による細胞生存率の変化
横軸がReprimoタンパク質の添加量、縦軸が細胞の生存率を示し、Reprimoタンパク質の添加量を増やすごとに細胞がアポトーシスを起こし、生存率が低くなっていることが分かる。
b.Reprimoタンパク質を添加したがん細胞の72時間後の顕微鏡写真
上段がReprimoタンパク質添加前のコントロール、下段が1㎍/ml添加した72時間後の顕微鏡写真でありReprimoタンパク質の添加の有無を比較している。72時間後はいずれもがん細胞が死んでいることが分かる。
続いて、Reprimoタンパク質を受け取る細胞膜表面の受容体を特定するため、免疫沈降と質量分析を行った結果、カドヘリン様タンパク質(FAT1, FAT4, CELSR1, CELSR2, CELSR3)がReprimoタンパク質の受容体であることを突き止めました。また、細胞内のシグナル伝達経路を調べたところ、Hippo経路の重要な因子であるYAP/TAZが活性化し、細胞の核内に蓄積することが確認されました。このYAP/TAZは、p73タンパク質と結合することでアポトーシスを誘導することが既に知られており、今回の研究でもReprimoによる細胞死にp73が関与していることを明らかにしました。
さらに、マウスを用いた実験では、Reprimoを発現する細胞とがん細胞を同時に移植すると、腫瘍の形成が抑制されることが確認され、生体内でもReprimoががん抑制に寄与していることが示されました。
展望
Reprimoタンパク質のがん治療への応用可能性を発見、副作用の少ない新薬開発に期待
研究チームは、Reprimoタンパク質がこれまでに試したすべてのがん細胞に細胞死を引き起こす一方で、実験を行った範囲では正常細胞には影響を与えないことを発見しました。この成果は、Reprimoタンパク質自体やその機能を応用した抗がん剤が、副作用を抑えながら高い治療効果を発揮する新しい治療薬の開発に繋がる可能性を示しています。
今回、私たちは世界で初めてReprimoタンパク質の機能を解明しました。今後は、細胞やマウス実験で証明された細胞死やがん抑制がヒトで応用可能であるか、臨床応用に向けてはさらなる検証が必要です。
論文情報
雑誌名 Proceedings of the National Academy of Sciences of the United States of America
タイトル Extrinsic induction of apoptosis and tumor suppression via the p53-Reprimo-Hippo-YAP/TAZ-p73 pathway
著者 Masahiro Takikawa, Airi Nakano, Jayaraman Krishnaraj, Yuko Tabata, Yuzo Watanabe, Atsushi Okabe, Yukiko Sakaguchi, Ryoji Fujiki, Ami Mochizuki, Tomoko Tajima, Akane Sada, Shu Matsushita, Yuichi Wakabayashi, Kimi Araki, Atsushi Kaneda, Fuyuki Ishikawa, Mahito Sadaie, and Rieko Ohki
DOI 10.1073/pnas.2413126122
掲載日 2025年2月6日
URL https://www.pnas.org/doi/10.1073/pnas.2413126122(外部サイトにリンクします)
研究費
研究費名(支援先):日本学術振興会
研究事業名:科学研究費 若手研究
研究課題名:p53PAD7傍分泌とHippoシグナル経路によるがん抑制機構の解明
研究代表者名:滝川 雅大
研究費名(支援先):日本学術振興会
研究事業名:科学研究費 若手研究
研究課題名:分泌性タンパク質p53PAD7によるアポトーシス誘導メカニズムの解明
研究代表者名:滝川 雅大
研究費名(支援先): 国立研究開発法人日本医療研究開発機構(AMED)
研究事業名:次世代がん
研究課題名:希少がんである神経内分泌腫瘍の代謝特性の解明と新規治療標的同定
研究代表者名:大木 理恵子
研究費名(支援先):日本学術振興会
研究事業名:科学研究費 基盤B
研究課題名:がん抑制遺伝子PHLDA3による臓器を超えた神経内分泌腫瘍抑制メカニズムの解明
研究代表者名:大木 理恵子
研究費名(支援先):日本学術振興会
研究事業名:科学研究費 挑戦的研究(萌芽)
研究課題名:食事療法を用いた副作用のない非機能性の膵臓神経内分泌腫瘍の予防法・治療法の開発
研究代表者名:大木 理恵子
研究費名(支援先):日本学術振興会
研究事業名:科学研究費 基盤C
研究課題名:肝臓におけるタンパク質フコシル化異常による疾患発症機構の解明
研究代表者名:田端 祐子
研究費名(支援先):日本学術振興会
研究事業名:特別研究員奨励費
研究課題名:p53-PAD7を介した分化方向性および肝がん制御機構の解明
研究代表者名:中野 愛里
研究費名(支援先):長崎大学卓越大学院プログラム
研究事業名:世界を動かすグローバルヘルス人材育成プログラム
研究課題名:Analysis of the role of p53-PAD7-YAP/TAZ pathway in deciding cell fate and oncogenesis of hepatocarcinoma
研究代表者名:中野 愛里
研究費名(支援先):科学研究費補助金
研究事業名:新学術領域研究(研究領域提案型)
研究課題名:学術研究支援基盤形成 先端モデル動物支援プラットフォーム
研究代表者名:今井 浩三、井上 純一郎 (研究分担者:荒木 喜美)
用語解説
注1 p53遺伝子
がんにおいて、最も高頻度に変異が発見される遺伝子であり、がん抑制遺伝子として知られている。主に転写制御を行い、標的遺伝子の活性化を行うが、がんではその機能は失われていると考えられている。
注2 カドヘリン様タンパク質
細胞間接着に関わり、細胞外領域にカドヘリン様ドメインを持つタンパク質群。一部のカドヘリン様タンパク質はショウジョウバエでは細胞の極性に影響を与えることが分かっているが、詳細な機能は分かっていないことが多い。
注3 Hippo-YAP/TAZ経路
ショウジョウバエ、マウス、ヒトで保存されたシグナル伝達経路。器官の大きさを制御するための細胞増殖に関わることが知られているが、反対に細胞死にも関わることが明らかになっている。転写共役因子であるYAP/TAZのリン酸化状態がこの経路によって制御され、さまざまな標的遺伝子の発現が変化する。
注4 p73
p53のファミリーメンバーであり、p53と同様にがん抑制に関わる遺伝子の発現制御を行う。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター研究所
基礎腫瘍学ユニット 大木 理恵子
広報窓口
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室
東京理科大学 広報課
国立大学法人千葉大学 広報室
国立大学法人長崎大学 生命医科学域・研究所事務部 総務課(企画担当)
国立大学法人熊本大学 総務部総務課広報戦略室
千葉県がんセンター 事務局