2025-04-03 ラトガース大学
<関連情報>
- https://www.rutgers.edu/news/how-researchers-are-shining-light-kidney-disease
- https://www.nature.com/articles/s41467-025-57512-3
線虫における毛様体細胞外小胞のサブタイプはポリシスティンによって決定される Polycystins recruit cargo to distinct ciliary extracellular vesicle subtypes in C. elegans
Inna A. Nikonorova,Elizabeth desRanleau,Katherine C. Jacobs,Josh Saul,Jonathon D. Walsh,Juan Wang & Maureen M. Barr
Nature Communications Published:03 April 2025
DOI:https://doi.org/10.1038/s41467-025-57512-3
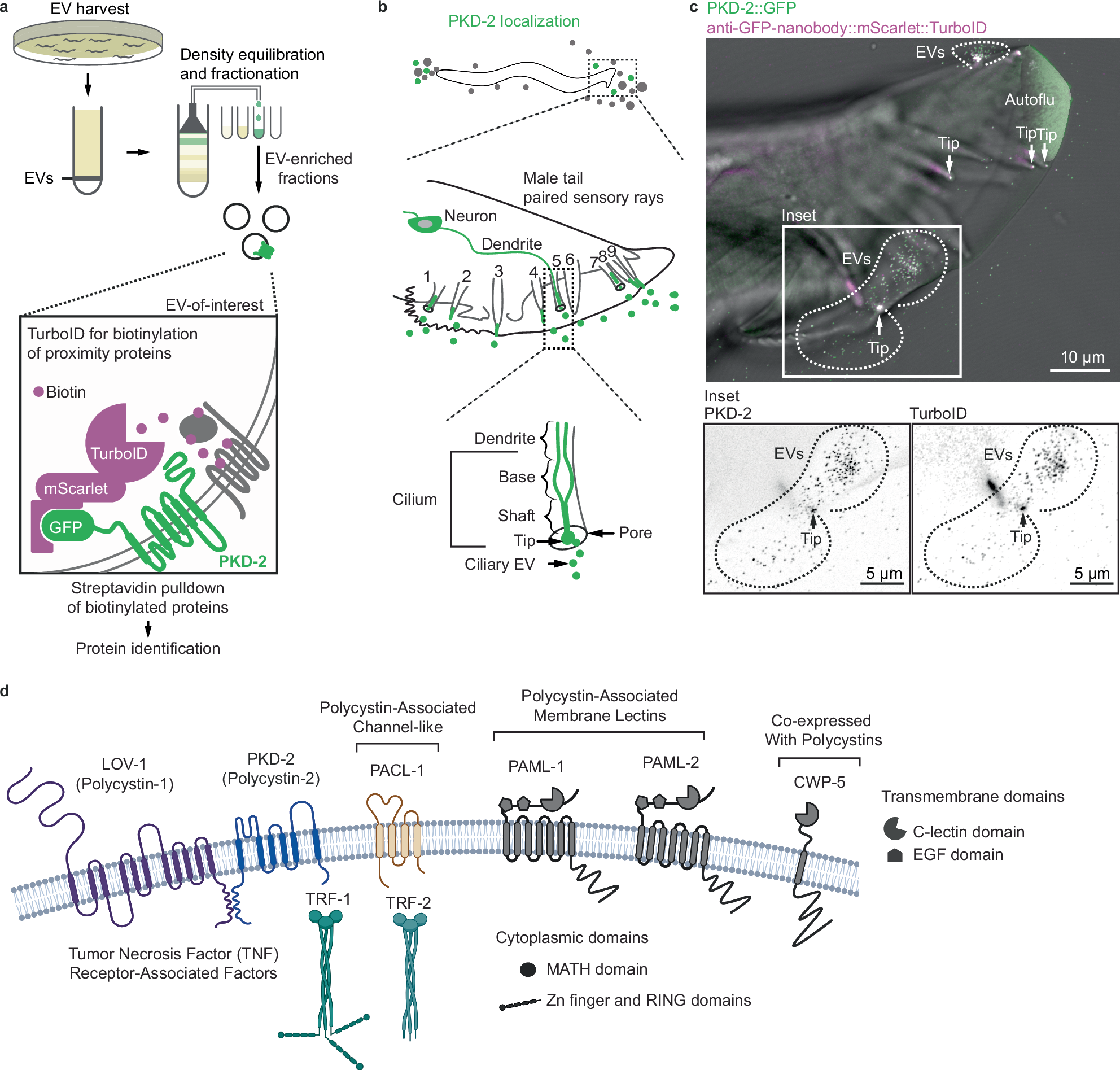
Abstract
Therapeutic use of tiny extracellular vesicles (EVs) requires understanding cargo loading mechanisms. Here, we use a modular proximity labeling approach to identify the cargo of ciliary EVs associated with the transient receptor potential channel polycystin-2 PKD-2 of C. elegans. Polycystins are conserved ciliary proteins and cargo of EVs; dysfunction causes polycystic kidney disease in humans and mating deficits in C. elegans. We discover that polycystins localize with specific cargo on ciliary EVs: polycystin-associated channel-like protein PACL-1, dorsal and ventral polycystin-associated membrane C-type lectins PAMLs, and conserved tumor necrosis factor receptor-associated factor (TRAF) TRF-1 and TRF-2. Loading of these components to EVs relies on polycystin-1 LOV-1. Our modular EV-TurboID approach can be applied in both cell- and tissue-specific manners to define the composition of distinct EV subtypes, addressing a major challenge of the EV field.