シナプスの表面形状をナノスケールで解析することに成功
2019-03-20 東京大学,科学技術振興機構
ポイント
- 神経ネットワークの要であるシナプスの表面形状をナノスケールで測定し、この技術を活用して可塑性に関連したシナプス形態の新しい変化を発見しました。
- これまでの顕微鏡観察ではシナプスの形を正確に測定することは困難でしたが、今回開発された技術を用いると電子顕微鏡のデータに近い表面形状が得られます。
- 脳の発達過程でシナプスに起こる異常は精神疾患の発症にも関連しており、今回開発された解析手法は薬物スクリーニングの効率化にも貢献すると考えられます。
東京大学 大学院医学系研究科の柏木 有太郎 助教、岡部 繁男 教授らの研究グループは、超解像顕微鏡注1)の手法の1つである構造化照明法注2)を用いて、神経細胞のつなぎ目であるシナプスの形態、特に樹状突起スパイン(スパイン)注3)と呼ばれる構造の表面形状をナノスケールで解析する技術を開発しました。スパインは記憶・学習の基盤とされているシナプス可塑性注4)によってその形態が変化します。そのためスパインの形状を、技術的に困難な電子顕微鏡を使わずに、光学顕微鏡で効率よく解析する技術が求められています。しかし、これまでは光学顕微鏡の解像度が低いためにこのような解析は実現できませんでした。今回の技術開発により、構造化照明法を用いて電子顕微鏡で得たデータとほぼ同等のスパイン形状データ(図1)を1000個以上のスパインから取得し、数理科学的な手法を用いて自動的に解析することが可能となりました。精神疾患などの脳の疾患ではスパインの数や形に変化が生じる例も報告されており、精神疾患の薬物スクリーニングの手法としても今回開発された技術の応用が期待されます。
本研究成果は、2019年3月19日(英国時間)に英国科学誌「Nature Communications」のオンライン版で公開されます。
<研究内容>
神経細胞のつなぎ目であり、神経ネットワークの要として働くシナプスは、シナプス可塑性などの機構を通じて学習・記憶などの過程に重要な役割を果たしています。シナプスはその大きさが数ミクロンと大変小さく、これまではその微細形態を正確に測定する場合には電子顕微鏡を用いた立体再構築が行われてきました。しかしながら電子顕微鏡の画像を多数取得してシナプスの構造を再構築する作業は煩雑かつ困難で、多くのシナプスを解析するには多大な労力と時間がかかっているのが現状です。一方で通常の光学顕微鏡ではシナプスの形態を解析するには解像度が悪く、効率的で解像度の高い手法として注目されている超解像顕微鏡技術を活用した新しい解析手法の開発が期待されていました。
本研究では、電子顕微鏡に頼らず、急速に発展してきた超解像顕微鏡の技術を活用して、光学顕微鏡によるデータからシナプスの形をナノスケールで正確に測定するための技術を開発しました。具体的には、超解像顕微鏡の1つの手法である構造化照明法を用いて培養海馬神経細胞が形成するシナプス構造、特に樹状突起スパイン(スパイン)と呼ばれる数ミクロン程度のサイズの「とげ」のような構造の画像を取得しました。得られた画像からスパインの表面を決定し、表面形状をメッシュと呼ばれる立体形状のモデルとして表現しました。この手法でスパイン形状をまず取得し、同じ細胞を電子顕微鏡で観察することにより、得られた立体形状の信頼性を確認したところ、電子顕微鏡で検出できたスパインの微細な凹凸が光学顕微鏡のデータからも再現できることが分かりました。このようにして得られたスパインの立体形状から形に関する多数のパラメーターを測定して、データサイエンスの手法や機械学習の手法を用いてスパインを自動分類し、さらに時間経過に伴う形態変化の特徴などを解析しました。この手法を用いることで数千個のスパインの形状データを短時間で自動的に解析することが可能となり、実際に遺伝子改変動物のスパインの形態変化を感度良く検出することに成功しました。さらに実験的に神経細胞にシナプス可塑性を誘導し、その前後でのスパインの形の変化を詳細に解析しました。シナプスの結合が強くなる際にスパインの形が大きく変化して、その頭部の凹み(図2)が大きくなること、この変化にはシナプスで働く接着分子の相互作用が必要であることを発見しました。この凹みの部分はスパインの結合相手である軸索の膜と広く接触しており、膜と膜の間の結合を増強することでその後のシナプスの安定化に貢献していると考えられます。また、今回開発した手法は主に培養細胞での形態解析に利用しましたが、それ以外に脳の切片などのより生体に近い標本での解析にも利用可能なことも明らかにしました。
これまでの死後脳などの解析から、精神疾患や発達障害などの疾患ではシナプスの密度や形態に違いが生じていること、特にスパインのサイズや形態に違いがあることが示唆されています。このような変化は疾患のバイオマーカーとして活用することが可能ですが、シナプスの形の変化を客観的かつ定量的に評価するのは困難で、電子顕微鏡による微細形態の立体再構築などに頼らざるを得ないのが大きな問題点でした。今回開発した光学顕微鏡によるシナプスのナノスケールでの形態解析手法は、従来の方法よりも高効率であり、数千個のシナプスの構造を短時間で定量的かつ客観的に評価することが可能です。自動化された薬物投与システムなどと組み合わせることにより、本手法は精神疾患の薬物スクリーニングにおいて重要な役割を果たすことが期待されます。
<参考図>
![]()
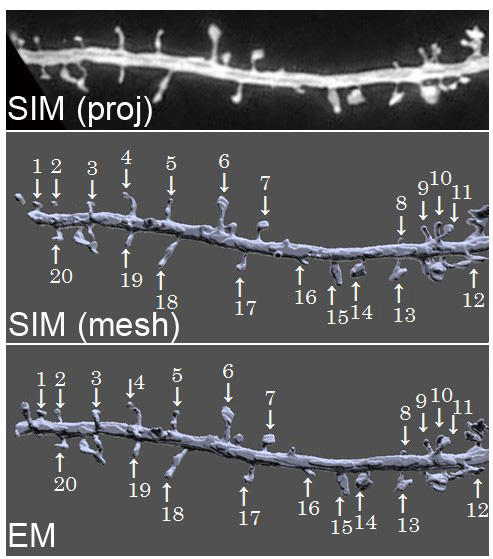
図1
SIM(proj)超解像顕微鏡の生画像。SIM(mesh)超解像顕微鏡のデータから細胞表面の形状を再構成して、スパイン一個一個に番号を付けた画像。
EM電子顕微鏡の画像から細胞表面の形状を立体再構築した画像。1から20の番号は超解像顕微鏡の画像のスパインと対応している。個々のスパインの形状が良く一致している。
![]()
図2
A.構造化照明で画像化した軸索(GFP:緑:細い神経突起)と樹状突起(DiI:紫:太い神経突起)。両者がつながりシナプスを形成している場所を矢印で示す。
B.樹状突起スパインの画像を元に表面形状を再構築した画像。
C.軸索の画像と樹状突起の画像から両者が結合した場所を再構築した画像。
D.樹状突起スパインの表面曲率を疑似カラー表示した画像。凹んだ場所は青色(中央の溝状の部分)で表示されており、凹面と軸索との接触部位が一致している。
<用語解説>
- 注1)超解像顕微鏡
- 従来の光学顕微鏡の持つ分解能の限界は光をどれだけ収束できるのか、というレンズの性質(回折限界)に依存していたが、この限界を超えるイメージングの方法がいくつか考案されており、これらの技術をまとめて超解像顕微鏡法と呼ぶ。具体的には誘導放出抑制顕微鏡法、光活性化局在性顕微鏡法、構造化照明顕微鏡法などを含む。従来の光学顕微鏡では平面内での解像度が200ナノメートル程度であったが、超解像顕微鏡法では100ナノメートル以下、場合によっては数ナノメートルの解像度を達成できる。
- 注2)構造化照明法
- 超解像顕微鏡法の1つ。縞状の光を試料に照射し、試料自体が持つ縞構造との間に生じるモアレ縞の画像を取得する。得られたモアレ縞の情報と、照射した縞状の光の情報を基に、試料の持つ構造を再構築する手法である。通常の光学顕微鏡のおよそ2倍、100ナノメートル程度の分解能を得ることができる。
- 注3)樹状突起スパイン(スパイン)
- 神経細胞同士が情報をやり取りする場所をシナプスと呼び、情報を送り出す側をシナプス前部、受け取る側をシナプス後部と呼ぶ。多くの場合にシナプス前部は軸索と呼ばれる神経の突起に形成され、シナプス後部は樹状突起と呼ばれる突起に形成される。特に大脳皮質や海馬においては樹状突起に形成されるシナプス後部は数ミクロン程度の小さな「とげ」の上に作られる場合が多く、この小さなとげのことを樹状突起スパイン(スパイン)と呼ぶ。スパインはさまざまな大きさと形状を持ち、神経回路の活動に応じてその形を変化させる。さらに精神疾患や発達障害などの脳の疾患においてスパインの数、密度、大きさなどが変化するとされており、これらの疾患の原因にスパインの機能障害が存在するという仮説も提唱されている。
- 注4)シナプス可塑性
- シナプスを介しての情報のやり取りは、それぞれのシナプスの活動に応じて長期的に増強されたり(長期増強)、減弱されたり(長期減弱)することが知られている。シナプス結合がシナプスの活動に応じてその強弱を調節されることが、神経回路の中に情報を蓄える上で重要であり、記憶や学習などを脳が制御する際にもシナプス可塑性が用いられる。シナプスが強くなる長期増強の際にはスパインの形が大きくなり、逆にシナプスが弱くなる長期減弱の際にはスパインの形も小さくなる。長期増強により大きくなったスパインは機械的にも安定化され、スパインが長期間安定して維持されることにも関係していると考えられている。
<論文情報>
タイトル:“Computational geometry analysis of dendritic spines by structured illumination microscopy”
著者名:Yutaro Kashiwagi, Takahito Higashi, Kazuki Obashi, Yuka Sato, Noboru H. Komiyama, Seth G. N. Grant, Shigeo Okabe
DOI:10.1038/s41467-019-09337-0
<お問い合わせ先>
<研究に関すること>
岡部 繁男(オカベ シゲオ)
東京大学 大学院医学系研究科 分子細胞生物学専攻 神経細胞生物学分野 教授
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
<報道担当>
東京大学 医学部 総務係
科学技術振興機構 広報課