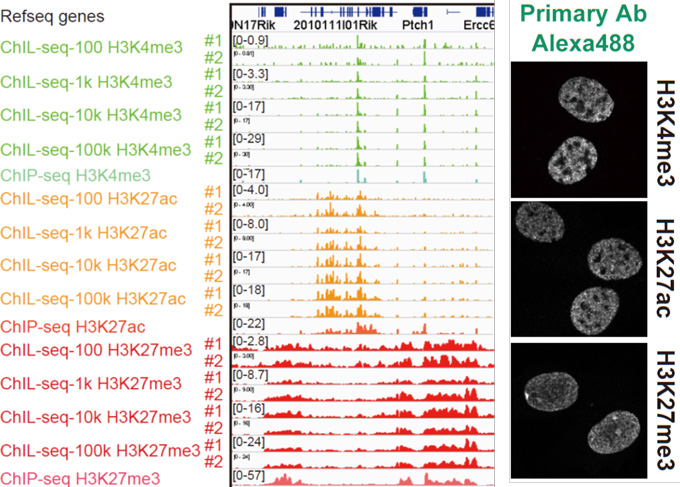
2018-12-10 理化学研究所,埼玉大学
理化学研究所(理研)創発物性科学研究センター創発生体工学材料研究チームの上田一樹研究員、伊藤嘉浩チームリーダー、埼玉大学工学部の廣瀬卓司教授らの共同研究チームは、両親媒性ポリペプチド[1]とリン脂質を共集合させることで、温度に応じて内包分子を放出できるナノカプセルの開発に成功しました。
本研究成果は、がん治療をはじめとするさまざまな薬剤体内輸送用カプセルや有機反応・生物反応の効率を高めるナノリアクター[2]への応用が期待できます。
リポソーム[3]はリン脂質二重膜の人工カプセルであり、これまでさまざまな膜機能が解明されてきましたが、構造的に不安定であるという問題がありました。
今回、共同研究チームは、疎水部にαヘリックス構造[4]を持つ両親媒性ポリペプチドとリン脂質を共集合させ、直径75ナノメートル(nm、1nmは10億分の1メートル)の球状ナノカプセルを作製しました。この共集合ナノカプセルは、ペプチド膜とリン脂質膜が相分離[5]した構造をしています。そのため、「構造安定性や形状均一性」といったペプチド集合体としての機能と、「温度に応じて相転移を起こす」というリポソームとしての機能を併せ持っています。実際に、相転移温度(38℃)以下でこの共集合ナノカプセルに分子を内包させ、それを38℃以上に加熱したところ、リン脂質膜のゲートから内包分子が放出されることが示されました。
本研究は、米国の国際科学雑誌『Journal of the American Chemical Society』に掲載されるのに先立ち、オンライン版に近日掲載予定です。
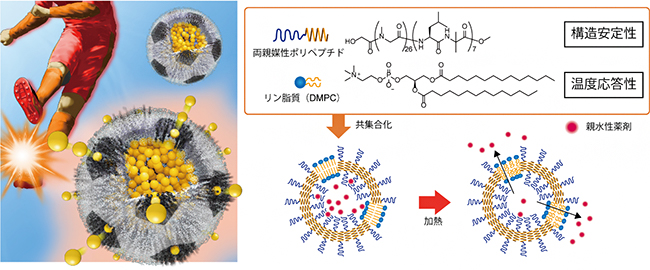
図 加熱により内包分子を脂質ゲートから放出するナノカプセル
背景
ナノサイズの構造体を形成する分子集合体材料は、ナノ材料としてドラッグデリバリーシステム[6]やナノリアクターなど、さまざまな分野で応用が期待されています。特に、細胞膜の主成分であるリン脂質膜で構成されるリポソームは有名で、さまざまな膜機能が解明され、さらに人工的な機能化などについても多く研究されてきました。しかし、リポソームは構造的に不安定であり、そのユニークな膜機能を維持したまま構造を安定化することが課題でした。
安定な分子集合体は、疎水性と親水性の部位を併せ持つ両親媒性ポリマーを用いることで達成されていましたが、合成されたポリマーによる集合体に天然の細胞膜のような複雑な機能を持たせることは困難でした。そこで共同研究チームは、ポリマー分子膜とリン脂質膜を共存させた分子集合体を調製することで、構造安定性と膜機能性を両立できるのではないかと考えました。
生体の細胞膜(脂質膜)には膜タンパク質が存在します。この膜タンパク質は疎水性のαヘリックス構造を複数個持っており、それらが束を形成した状態で、脂質膜の中に存在していることにヒントを得ました。これまで、伊藤嘉浩チームリーダーらは、疎水性のαヘリックス構造を持つ両親媒性分子が束を形成して安定な膜を構成できることを報告してきました注1)。そこで今回、それらの両親媒性ポリペプチドとリン脂質で共集合を行い、それぞれの機能を持った分子集合体の調製を試みました。
注1) Ueda, M.; Seo, S.; Müller, S.; Md. Rahman, M.; Ito, Y., Integrated Nanostructures Based on Self-Assembled Amphiphilic Polypeptides. Advances in Biosinpired and Biomedical Materials, volume 1, 2017, 19–30. ed by Yoshihiro Ito, Xuesi Chen and Inn-Kyu Kang, American Chemical Society.
研究手法と成果
共同研究チームはまず、疎水部にαヘリックス構造を持つ両親媒性ポリペプチドと共集合し、カプセル構造を形成できるリン脂質の選別を行いました。その結果、両親媒性ポリペプチドと炭素14個のリン脂質であるDMPC[7]を1:1~1:4の比率で混合すると、直径が75ナノメートル(nm、1nmは10億分の1メートル)の均一な球状カプセル構造になることが分かりました(図1)。
この共集合ナノカプセルを4℃で30日間低温保存したところ、安定した形状・分散を保つことが分かりました。このようなサイズ均一性や長期構造安定性は、一般的なリポソームでは見られません。両親媒性ポリペプチドは、ペプチド同士が束を作ることで、非常に硬く、安定なペプチド膜を作り、サイズ均一な構造体を形成することが分かっています。したがってこの結果は、ペプチド膜の性質が色濃く出ているといえます。
一方で、DMPCよりもアルキル鎖の長いリン脂質DPPC[7](炭素16個)やDSPC[7](炭素18個)を用いた場合は、部分的な共集合は見られましたが、ポリペプチドだけからなる集合体やリン脂質だけからなる集合体が多く見られました。この結果から、アルキル鎖の長さにより共集合性が異なることが分かりました。
次に、作製した共集合ナノカプセルについて、蛍光共鳴エネルギー移動(FRET)[8]による分光学的評価(蛍光スペクトルの形状およびFRET効率)を行ったところ、共集合ナノカプセルはFRET効率が高く、ペプチド膜と脂質膜が均一に混和した均一混和膜ではなく、それぞれが相分離して存在している相分離膜であることが分かりました(図2)。さらに、円偏光二色性[9]測定により、共集合ナノカプセル中でペプチドの束が形成されていること、Laurdanテスト[10]による膜流動性評価により、共集合ナノカプセル内に流動性の低い膜と高い膜が共存することが示されました。これらも、共集合ナノカプセルが相分離膜であることを示す結果です。
また、示差走査熱量測定[11]により、共集合ナノカプセルは38℃付近でゲル状態(結晶)から液晶状態(液体に近い状態)へと相転移を起こすことが分かりました(図3)。通常、両親媒性ポリペプチドが形成する集合体は、14~46℃の範囲では相転移挙動を示さず、DMPCからなる分子膜(リン脂質)はゲル-液晶相転移(22℃付近)を示すことから、共集合ナノカプセルの相転移は構成する脂質膜由来の機能であると考えられます。相転移温度が高温にシフトした理由としては、共集合ナノカプセル中の脂質膜部位のサイズが小さいこと、脂質膜を取り囲むペプチド膜が硬いこと、脂質膜への少量のペプチドの混入などが挙げられます。
脂質膜はゲル状態では分子を通さず、液晶状態では透過させやすいという性質を持っています。そこで、最後に、共集合ナノカプセルの相転移温度前後(37℃と42℃)において、カプセルに内包した蛍光分子の外部液への放出量を調べました。その結果、内包分子としてFITC-PEG2K[12]を用いた場合、相転移温度が22℃のDMPCリポソームでは、37℃、42℃のいずれにおいても70~100%近い放出率が見られましたが、共集合ナノカプセルでは、37℃では放出は抑えられ、42℃において80%近い放出が確認されました(図4)。これは、脂質膜が温度応答性のゲートとして働いており、内包分子がそのゲートを通って放出されていることを示しています。
さらに、FITC-PEG2Kよりも大きいFITC-PEG5K[12]を内包分子として用いたところ、42℃においても共集合ナノカプセルからの放出が抑制されることが分かりました(図4)。これは、脂質ゲートのサイズが小さいからだと考えられます。
今後の期待
これまで脂質の集合体であるリポソームが非常にさまざまな分野の研究に用いられてきました。本研究の両親媒性ポリペプチドとリン脂質の共集合体はペプチド膜によって構造安定性を高めると同時に、リン脂質膜をそのまま持っているという特徴があります。脂質膜の機能は、膜融合や膜分裂、チューブレーション(管化)、刺激応答性など数多く報告されており、本研究成果は、生体膜機能を持つ安定な新しいナノ材料としての産業利用が加速するものと期待できます。
原論文情報
Md. Mofizur Rahman, Motoki Ueda, Takuji Hirose, Yoshihiro Ito, “Spontaneous Formation of Gating Lipid-Domain in Uniform-Size Peptide Vesicle for Controlled Release”, Journal of the American Chemical Society, 10.1021/jacs.8b09362
発表者
理化学研究所
創発物性科学研究センター 創発生体工学材料研究チーム
研究員 上田 一樹(うえだ もとき)
チームリーダー 伊藤 嘉浩(いとう よしひろ)
埼玉大学大学院 理工学研究科
教授 廣瀬 卓司(ひろせ たくじ)
報道担当
理化学研究所 広報室 報道担当
埼玉大学 広報渉外室
補足説明
-
- 両親媒性ポリペプチド
- 親水性と疎水性を示す部位を持つポリマー分子であり、水中において疎水性相互作用により分子集合体を形成する。本研究では親水部に26量体のポリサルコシン、疎水部にL-ロイシンとアミノイソ酪酸の交互配列12量体からなる両親媒性ポリペプチドを合成して用いている。
-
- ナノリアクター
- 生体反応や化学反応をはじめとするさまざまな反応は、ナノ空間のような狭い領域で行うことで、格段に高効率・高選択的になることが知られており、自然界では起こりづらい反応も起こすことが可能である。このナノ空間で反応を行うというシステムをナノリアクターという。
-
- リポソーム
- リン脂質は水中において、親水性部分を外側に疎水性部分を内側に向けて集合し脂質二重層の膜構造を形成する。膜構造の端は疎水性部分を露出しないように、閉じた微小なカプセル構造を形成し、これをリポソームと呼ぶ。カプセル構造になることで、外部と仕切られた内水相を持つ。生体膜構造に似ているため、生体膜のモデル系としての利用や薬物輸送システムとして、さまざまな医療分野で実用化されている。
-
- αヘリックス構造
- タンパク質の二次構造の共通モチーフの一つで、バネのような右巻きらせんの形をしている。
-
- 相分離
- 2種以上の物質を混合した際、均質に混ざり合わず各成分に分離する現象を相分離という。
-
- ドラッグデリバリーシステム
- 薬物送達システムの総称。組織や細胞、また病変部などへ、直接に適時適量の薬剤などを運搬する方法。
-
- DMPC、DPPC、DSPC
- 一般的なリン脂質であり、アルキル鎖(炭素鎖)の長さの違いで異なる名前が付けられている。DMPCは炭素14個のジミリストイルホスファチジルコリン、DPPCは炭素16個のジパルミトイルホスファチジルコリン、DSPCは炭素18個のジステアロイルホスファチジルコリンである。
-
- 蛍光共鳴エネルギー移動(FRET)
- 近接した2個の蛍光分子の間で、一方の蛍光分子(ドナー)が受けた励起エネルギーが、電磁波にならず電子の共鳴により直接もう一方の蛍光分子(アクセプター)に移動する現象。この現象は2個の蛍光分子間の距離が離れるとともに減衰するため、アクセプターの蛍光強度から距離を見積もることが可能である。FRETはFluorescence Resonance Energy Transferの略。
-
- 円偏光二色性
- 物質が円偏光を、吸収する際に左円偏光と右円偏光に対して吸光度に差が生じる現象のこと。キラリティを持った分子や、ヘリックスのような右巻きあるいは左巻きなどのようにらせん性(ヘリシティ)に偏りがある場合に見られる。
-
- Laurdanテスト
- Laurdanは、細胞膜のリン脂質二重層の膜質を調べるために使用される蛍光色素である。特に、色素周辺の水の存在に高い感受性を示し、Laurdanが発する蛍光波長と強度は膜の流動性を示す一つの指標として用いられる。
-
- 示差走査熱量測定
- 測定試料に発熱・吸熱の現象が起こると、熱量に変化が起こる。例えばゲル状態から液晶状態への相転移では、その状態変化により多くの熱エネルギーを必要とする。測定試料と基準物質との熱量の差を測定することで、測定試料の相転移現象に伴う熱量や転移温度を直接知ることができる。
-
- FITC-PEG2K、FITC-PEG5K
- 蛍光分子のフルオレセインイソチオシアネート(FITC)と水溶性ポリマーのポリエチレングリコール(PEG)を結合させた分子。蛍光分子FITCによって分光学的に放出量を測定することができ、PEGポリマーの長さによって分子のサイズを変えることができる。FITC-PEG2K,FITC-PEG5Kは、PEGの分子量がそれぞれ2000、5000である。
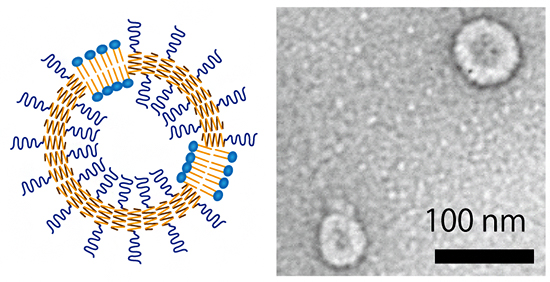
図1 共集合ナノカプセルの電子顕微鏡像
両親媒性ポリペプチドとリン脂質DMPCを1:1~1:4の割合で混合すると、均一な球状カプセル構造となった。図はネガティブ染色像
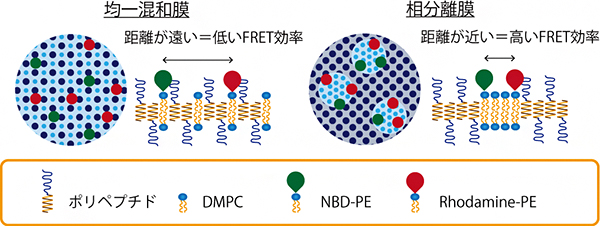
図2 ニつの膜モデルと蛍光共鳴エネルギー移動(FRET)効率
本研究ではドナーとしてNBD-PE(緑)、アクセプターとしてRhodamine-PE(赤)を用いている。それぞれ、リン脂質部と蛍光分子部が結合した形をとっており、蛍光分子が選択的にリン脂質と同じ場所に集まる。リン脂質とペプチドが均一混合膜を形成している場合、リン脂質(水色)はナノカプセル全体に存在するため、NBD-PEおよびRhodamine-PEは必然的に距離が離れ、FRET効率が低くなる。一方で、相分離膜を形成している場合、リン脂質は局在しており、NBD-PEおよびRhodamine-PEの距離は近くなり、FRET効率が高くなる。
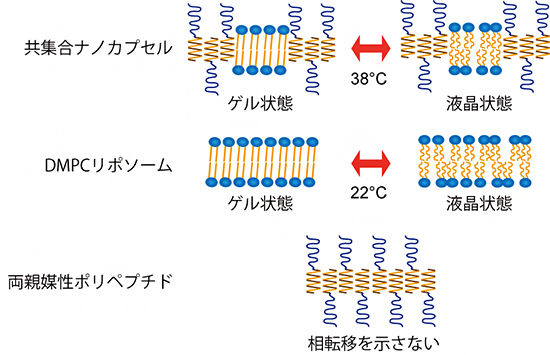
図3 示差走査熱量測定の結果と共集合ナノカプセルの相転移の模式図
共集合ナノカプセルは38℃付近で、ゲル状態から液晶状態への相転移を起こした。一方で、DMPCリポソームの分子膜(リン脂質)は22℃付近で相転移を起こし、両親媒性ポリペプチドは14~44℃の範囲では相転移を起こさない。
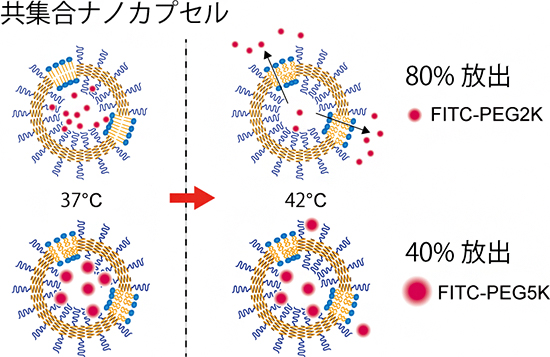
図4 共集合ナノカプセルにおける内包分子の温度応答放出挙動
左:相転移温度38℃の共集合ナノカプセルに内包分子としてFITC-PEG2Kを用いた場合、42℃では約80%が放出された。
右:内包分子としてFITC-PEG2Kよりも大きなFITC-PEG5Kを用いた場合、42℃、4時間後に約40%しか放出されなかった。