抗うつ剤が制御性T細胞を増やし脳梗塞の症状を緩和
2019/01/03 慶應義塾大学医学部,日本医療研究開発機構
慶應義塾大学医学部微生物学・免疫学教室の吉村昭彦教授、伊藤美菜子特任助教らの研究グループは、マウスモデルを用いた実験により、脳梗塞後の慢性期に新たに発見された免疫細胞が働き、神経症状の回復に寄与することを発見しました。さらに、既にうつ病治療薬として使われている薬剤がその免疫細胞の増殖を促すことで神経症状を回復させ、新たな治療薬になる可能性を明らかにしました。
脳梗塞は主な死因、寝たきりの原因になっています。しかし、現在存在する脳梗塞の治療法は発症初期のみに限られており、発症後時間が経過した慢性期における有効な新たな治療薬の開発が望まれています。本研究グループは、これまで脳梗塞発症後数日間の急性期におけるマクロファージを中心とした炎症プロセスを明らかにしてきました。しかし発症1週間目以降、炎症は収束し病態に免疫は関与しないと考えられてきました。
本研究グループは、脳梗塞モデルマウス(注1)を用いて、脳梗塞発症後の慢性期には獲得免疫(注2)を担うリンパ球の一種であるT細胞が大量に梗塞部位に集積すること、その中でも制御性T細胞(Tレグ)(注3)が増加し脳梗塞後の脳内の神経修復過程を制御していることを発見しました。脳Tレグは神経細胞を傷害する活性化アストロサイト(注4)を抑制し、神経症状を緩和させることがわかりました。さらに、この脳Tレグは他の組織に存在するTレグと異なり神経系に特徴的なセロトニン(注5)受容体を有しており、セロトニンによって増殖・活性化することも明らかとなりました。脳梗塞モデルマウスにセロトニンや脳内のセロトニンを増やす薬(抗うつ薬の一種)を投与したところ、脳Tレグが増加し神経症状が改善することがわかりました。脳梗塞患者においても脳内セロトニンに作用する抗うつ薬が、脳梗塞の慢性期(リハビリ期)の治療に役立つことが期待されます。
本研究成果は、2019年1月2日(グリニッジ標準時)に英国科学誌『Nature』のオンライン速報版に掲載されました。また、1月10日に同発刊誌に掲載されます。
研究のポイント
- マウスモデルにおいて脳梗塞発症後2週目以降に脳内に特殊な制御性T細胞(脳Tレグ)が集積することを発見。
- この脳Tレグは神経細胞死を誘導する過剰な脳細胞(アストロサイト)の活性化を抑制する。
- 脳Tレグはセロトニン受容体を発現し、セロトニンに応答して増加する。抗うつ剤として使用されているセロトニンを増やす薬はTレグをさらに増やし脳梗塞による神経症状を緩和した。
研究の背景と概要
平成29年度厚生労働省人口動態統計によると脳血管障害(脳卒中)は日本人の死因の第3位で年間11万人弱の方が亡くなられています。また、患者総数は100万人を超えており、今後も増加が懸念されています。脳卒中のなかでも、脳の血管が詰まるなど血流が減少することによって、酸素や栄養が不足して脳組織が壊死に至る脳梗塞が約75%を占めています(日本脳卒中データバンク報告書2018年)。脳梗塞は死亡率が高いだけでなく後遺症が重く、患者の生活の質(QOL)が非常に低下することが特徴です。発症後数時間以内の脳梗塞であれば、詰まった血管の再開通(血栓溶解または血栓除去)によって神経症状や後遺症の改善が期待できます。しかし、発症後すぐに脳梗塞に伴う症状に気づき、数時間以内に治療を開始できるケースは限られており、それ以降の有効な治療法に乏しいのが現状です。
本研究グループでは、これまでに、マクロファージを中心とした脳梗塞発症後の炎症プロセスを明らかにしてきました。発症1日目には炎症性のマクロファージが梗塞部位に浸潤し、その後約3日間で炎症が拡大し、およそ1週間でマクロファージが修復性に転換し、炎症反応が収束することがわかっています(Shichita T. et al. Nature Med. 2009, Shichita T. et al. Nature Med. 2012, Ito M. Nature Commun. 2015, Shichita T. Nature Med. 2017)。しかし、それ以降の慢性期における免疫細胞の役割についてはほとんど知られておらず、これを解明することで新しい治療法を開発できる可能性がありました。
研究の成果と意義・今後の展開
本研究グループは、脳梗塞モデルマウスを用いて、脳梗塞発症後2週目以降(慢性期:ヒトで言えばリハビリ期)の脳組織を観察したところ、獲得免疫を担うリンパ球の一種であるT細胞が予想外に多く集積していることを発見しました(図1)。T細胞の脳内集積を止める薬を投与すると運動機能を指標とした神経症状が悪化することから、脳内のT細胞は神経症状の改善あるいは悪化の防止に役立っていることがわかりました。さらに、研究グループはT細胞の中でも制御性T細胞(Tレグ)が非常に多く集積していることを発見しました(図2)。Tレグは現大阪大学教授、坂口志文博士によって発見されたリンパ球の一種で、炎症や免疫を制御し、自己免疫疾患やアレルギーを抑えている細胞であることがわかっています。通常、血液中のTレグはCD4陽性ヘルパーT細胞のうちの10~20%しか占めていないのに比較し、脳梗塞慢性期の脳Tレグは約50%を占めており大量に蓄積していると言えます。
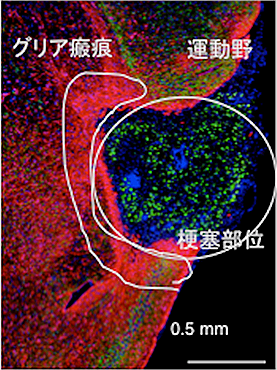
図1 脳梗塞部位へのT細胞の集積
脳梗塞慢性期には梗塞巣とその周辺にT細胞(緑)が集積している。赤はグリア細胞で梗塞巣のまわりは密なグリア細胞からなる瘢痕(グリア瘢痕)が取り囲んでいる。赤くなったグリア細胞の活性化をアストログリオーシスと呼ぶ。右上が運動機能に重要な運動野とよばれる領域。
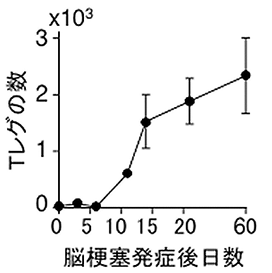
図2 脳梗塞発症後1週間目以降に脳内への制御性Tsaibou (Tレグ)の集積がみられる。
脳梗塞発症後、慢性期にTレグを除去すると、神経症状が悪化しました。また逆にT細胞が存在しないマウスにTレグを移植すると神経症状が改善されました。これらの結果から脳内に集積するTレグ(脳Tレグ)こそが脳梗塞慢性期の神経症状の改善に役立っていることが明らかになりました。
最近、脳内Tレグのように脂肪組織、筋肉、皮膚など体の様々な臓器にTレグが存在することが報告されています。これらは組織Tレグ(注6)と呼ばれ炎症のみならず代謝や損傷組織の再生や修復に重要な役割を果たすことが報告されています。しかし、正常な状態では脳内にT細胞はほとんど存在しないため、これまで脳内でのTレグの役割を解明した報告はありませんでした。本研究から脳梗塞後、脳内に集積するTレグも組織Tレグに似た性質を示し、他の組織Tレグと同様にある種のサイトカイン(注7)によって増殖することがわかりました。
しかし脳Tレグには他の組織Tレグにない脳特有の性質を有することもわかりました。脳Tレグは特殊なケモカイン(注8)に惹かれて脳内に浸潤し、通常は神経細胞に発現するセロトニン受容体の一種(セロトニン受容体7型)を発現していました。脳Tレグは、セロトニンの刺激によって活性化および増殖することが生体外の実験でわかりました。また脳梗塞慢性期のモデルマウスに、セロトニンそのものや、抗うつ薬として用いられている選択的セロトニン再取り込み阻害薬(SSRI)(注9)を投与したところ、脳Tレグが増加し、神経症状を改善させる効果が認められました(図3)。
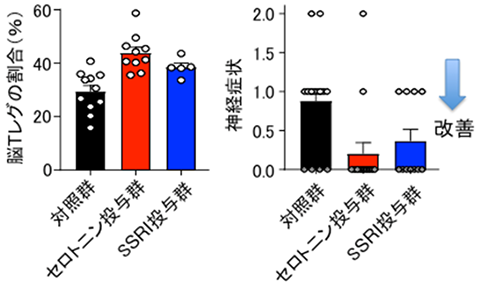
図3 セロトニンに応答した脳Tレグの増加と神経症状の改善
セロトニンSSRI(選択的セロトニン再取り込み阻害薬)を脳梗塞慢性期(発症7日後から)投与すると、脳Tレグは増殖し、神経症状も改善した。
次に、脳Tレグがどのようなメカニズムで神経症状の改善に寄与するのかを調べました。神経症状の悪化は脳の「運動野」とよばれる領域の神経細胞が死ぬことによって起こります。これにはアストロサイトと呼ばれる脳細胞の過剰な活性化が関与すると考えられています。アストロサイトの活性化はグリア瘢痕(注10)形成を誘導し(図1)、神経細胞を梗塞部位から隔離し神経を保護するために必要ですが、過剰に活性化されたアストロサイトは神経毒となる物質を産生し、むしろ神経細胞を傷害したり、神経伸長を阻害したりすることが知られています。Tレグを除去することでアストロサイトの活性化が亢進し神経毒性物質の産生が増加することから、Tレグはアストロサイトの過剰な活性化を制御することで神経細胞を保護していることが推定されました(図4)。さらに、その分子レベルでの機序を探ったところ、脳Tレグでは組織修復や細胞の成長に重要な分子であるアンフィレグリン(注11)を強く発現していることがわかりました。このアンフィレグリンがアストロサイトなどからの炎症性サイトカインの産生を抑えることでアストロサイトの過剰な活性化を抑制し、その結果神経細胞の損傷を抑えていることがわかりました(図5)。
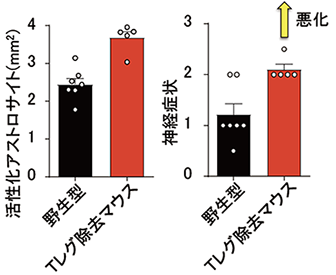
図4 Tレグ除去マウスにおいてはアソトロサイトの過剰な活性化(左)と神経症状の悪化(右)が認められた。
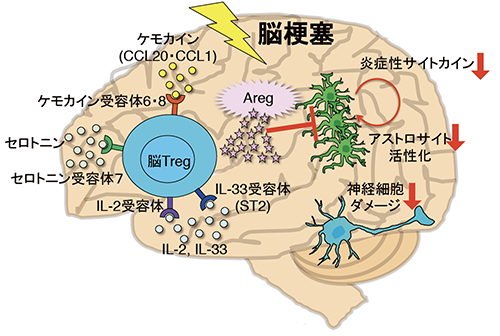
図5 脳Tレグによる神経損傷の制御メカニズム
脳Tレグ(Treg)は脳梗塞慢性期にケモカイン依存的に脳内に浸潤する。サイトカイン(IL-2、IL-33)やセロトニンによって増殖し、アンフィレグリン(Areg)を産生する。AregはIL-6などの炎症性サイトカインの産生を抑制することでアストロサイトの過剰な活性化を抑え、神経細胞を守る。
今後の展開
本研究によって、脳梗塞慢性期に制御性T細胞が脳内に集積し、アストロサイトの過剰な活性化や神経細胞の死を制御するメカニズムが明らかとなりました(図5)。従来、脳梗塞の慢性期には炎症は治まっていると考えられてきました。しかし、一見炎症反応が収束している慢性期にも、免疫系が活発に作動し重要な働きをしていることが明らかとなりました。
ヒト脳梗塞における脳Tレグの研究はこれからですが、血液中のTレグが多いほど予後が良いことも報告されています。脳梗塞発症後の時間が経過すると、現在の治療法においては再発予防やリバビリに限られていますが、すでに臨床の場で用いられている抗うつ薬の投与が新たな治療法として期待されます。
さらに、脳内炎症は脳梗塞だけではなく脊髄損傷などの脳脊髄組織の損傷でも、あるいは多発性硬化症のような自己免疫疾患やアルツハイマー病やパーキンソン病のような神経変性疾患でも起こることが知られています。これらの脳内炎症にも獲得免疫が発動され脳Tレグが浸潤、集積し、神経症状に重要な役割を果たしている可能性があります。今後脳Tレグを標的とした脳神経疾患の全く新しい治療法の開発が加速すると期待されます。
特記事項
本研究は、以下の事業・研究開発領域・研究開発課題の一環で行われました。
- 国立研究開発法人日本医療研究開発機構の革新的先端研究開発支援事業
① 研究開発課題名:「T細胞のエピジェネティク改変による免疫疾患制御」
JP18gm0510019
※本研究開発領域は、2015年4月の日本医療研究開発機構の発足に伴い、
国立研究開発法人科学技術振興機構(JST)より移管されたものです。
② 研究開発課題名:「T細胞の老化、疲弊による生体機能不全とその解除方法の開発」
JP18gm1110009 - JSPS科研費 JP17H06175
研究課題名:「炎症の終息と組織修復に関与する免疫細胞システムの解明」
論文
- 英文タイトル:Brain regulatory T cells suppress astrogliosis and potentiate neurological recovery
- タイトル和訳:脳Tレグはアストログリオーシスを抑制し神経症状回復を促す
- 著者名:Ito M, Komai K, Mise-Omata S, Iizuka-Koga M, Noguchi Y, Kondo T, Sakai R, Matsuo K,
Nakayama T, Yoshie O, Nakatsukasa H, Chikuma S, Shichita T and Yoshimura A. - 掲載誌:「Nature」オンライン速報版
- doi:10.1038/s41586-018-0824-5.
用語解説
- (注1)脳梗塞モデルマウス:
- 脳血管を閉塞させ人為的に脳梗塞をおこしたマウス。本研究では、細い塞栓糸を頚動脈から挿入して脳血管(中大脳動脈)に到達させ閉塞させる手技を用いた。
- (注2)獲得免疫:
- 免疫応答には異物の侵入によって短期間(24時間以内)に活性化される自然免疫とその後数日以上を経て活性化される獲得免疫に分けられる。T細胞とB細胞からなるリンパ球によって担われ、抗原(病原体やがん細胞)に特異的な反応が可能。
- (注3)制御性T細胞(Tレグ):
- T細胞の一種。主に胸腺や消化管で発生し、普段は自己に対する免疫応答を抑制している。炎症を抑え、アレルゲン、食物や胎児に対して免疫を発動させない機能も有するが、がん(腫瘍)に対しては腫瘍免疫を抑制しその成長を促進してしまう。
- (注4)アストロサイト:
- 脳内に存在するグリア細胞の1つで通常は神経の支持細胞であるが炎症によって活性化されて神経傷害に働くこともある。このような状態をアストログリオーシスという。
- (注5)セロトニン:
- 脳内で働く神経伝達物質のひとつで、様々な脳の機能や精神の安定に深く関わっている。セロトニンの受容体は7種類知られており、それぞれが異なった作用を持つ。
- (注6)組織Tレグ:
- 抹消組織に常在化したTレグ。組織の特殊な抗原を認識していること、インターロイキン33に応答すること、PPARγのような組織に特有の転写因子を発現すること等が知られている。それぞれの組織内で発達し、その組織に応じた機能を有すると考えられているが詳細はまだ不明なことが多い。
- (注7)サイトカイン:
- 免疫系において細胞間の情報を伝えるタンパク質の総称。
- (注8)ケモカイン:
- サイトカインの一種であり細胞を組織へ誘引するタンパク質。50種類ほど知られている。
- (注9)選択的セロトニン再取り込み阻害薬:
- 抗鬱薬の一種。シナプス間隙に貯まったセロトニンの再取り込みを阻害することによって脳内のセロトニン濃度を高く維持する薬。
- (注10)グリア瘢痕:
- 脊髄損傷や脳梗塞などにより、神経系が強く傷害されると、その周囲に存在するアストロサイトが応答して損傷部位を取り囲み炎症や壊死組織から神経細胞を守る。
- (注11)アンフィレグリン:
- 上皮細胞成長因子(EGF)の一種。マクロファージやT細胞で発現し、様々な細胞に作用する。傷を修復させる機能もある。
お問い合わせ先
研究に関すること
慶應義塾大学医学部
微生物学・免疫学教室 教授 吉村 昭彦(ヨシムラ アキヒコ)
本リリースの発信元
慶應義塾大学
信濃町キャンパス総務課 鈴木・山崎
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課