感染症やがんの生体防御に重要な免疫細胞集団を同定
2018-04-04 理化学研究所
要旨
理化学研究所(理研)生命医科学研究センター組織動態研究チームの岡田峰陽チームリーダー、石亀晴道研究員らの国際共同研究グループ※は、病原体感染やがんの生体防御に中心的な役割を果たしている記憶キラーT細胞[1]の多様性が形成される仕組みを解明しました。
本研究成果は、病原体やがんの排除に重要な免疫細胞集団を同定したものであり、生体防御能を反映する新たなバイオマーカー検索に貢献することが期待できます。
国際共同研究グループは、強い抗原刺激を受けたキラーT細胞[1]が発現するKLRG1[2]に注目し、KLRG1発現の有無と記憶キラーT細胞への分化の関係を解析する「細胞系譜追跡法[3]」を確立しました。この手法をマウスリステリア菌[4]、インフルエンザウィルス感染モデルや皮膚がんモデルに適用し、多様な記憶キラーT細胞がどのように形成されるかを調べました。その結果、記憶キラーT細胞の多様性の形成には、抗原刺激の強度が重要な役割を果たしていることが分かりました。特に、中程度の抗原刺激を受けたキラーT細胞はKLRG1を一時的に発現した後に消失し、高い細胞障害活性と増殖能を持つさまざまな種類の「exKLRG1」記憶キラーT細胞へと分化すること見いだしました。
本研究は、米国の科学雑誌『Immunity』(4月17日号)に掲載されるのに先立ち、オンライン版(4月3日付け:日本時間4月4日)に掲載されます。
国際共同研究グループ
理化学研究所 生命医科学研究センター
組織動態研究チーム
チームリーダー 岡田 峰陽(おかだ たかはる)
(旧 統合生命医科学研究センター 組織動態研究チーム チームリーダー)
研究員 石亀 晴道(いしがめ はるみち)
(旧 統合生命医科学研究センター 組織動態研究チーム 研究員)
旧 統合生命医科学研究センター 分化制御研究グループ
研究員(研究当時)米谷 耕平(こめたに こうへい)
(現 ドイツ マックスプランク研究所 研究員)
大阪大学免疫学フロンティア研究センター 分化制御
特任教授 黒崎 知博(くろさき ともひろ)
(理化学研究所 生命医科学研究センター 分化制御研究グループ グループディレクター)
特任准教授 井上 毅 (いのうえ たけし)
特任助教 新中須 亮(しんなかす りょう)
イェール大学医学部 免疫生物学部門
教授 リチャード・フラーベル(Richard A. Flavell)
研究員 デイトマー・ハンドラ-ブランドステッター(Dietmar Herndler-Brandstetter)
研究支援
本研究は、科学技術振興機構(JST)さきがけ研究「免疫・炎症研究におけるオプトジェネティクスの創生」、日本学術振興会(JSPS)科学研究費補助金新学術領域研究「癌免疫応答と免疫病態の機能的二光子イメージング」、科学研究費補助金若手研究(B)「新規細胞運命追跡法を用いたメモリーCD8T細胞分化機構の解明」の支援を受けて実施されました。
背景
細菌・ウィルスに感染した細胞やがん細胞由来の抗原を認識し、排除する免疫細胞をキラーT細胞といいます。キラーT細胞は、病原体感染やがんの発生により抗原に感作されると、エフェクターキラーT細胞へと分化し、初期生体防御において中心的な役割を果たします。抗原排除後、大部分のエフェクターキラーT細胞は炎症を終息させるために死滅しますが、その一部は「記憶キラーT細胞」に分化して長期間生存し、再度同じ抗原に出会うと迅速で効率的な二次免疫応答を誘導します。このような効率的な免疫応答を誘導する仕組みは「免疫記憶」と呼ばれ、ワクチン療法でもこの機構を利用しています。
多様な記憶キラーT細胞の形成は生体防御に重要ですが、機能的に異なる記憶キラーT細胞がどのように分化するかは不明な点が多く残されています。記憶キラーT細胞は非常に不均一で多様性のある細胞集団で、その局在・遊走能や機能により大きく三つの集団に分類されると、これまで考えられてきました。血液循環型である記憶キラーT細胞は、T細胞活性化の主な場であるリンパ節への遊走能を持つセントラル記憶キラーT細胞(Tcm)と、その能力を持たず末梢組織を循環するエフェクター記憶キラーT細胞(Tem)に区分され、体内の異なる部位を循環することで異物の侵入を絶えず監視しています。
最近、ケモカイン受容体[5]であるCX3CR1を中程度に発現する細胞群が、Tcm細胞とTem細胞のどちらの特徴も持つことが分かり、末梢記憶T細胞(Tpm)と命名されました注1)。一方、非循環型の記憶キラーT細胞は組織潜在型記憶キラーT細胞(Trm)と呼ばれ、粘膜組織の上皮や皮膚に局在し、再感染時に感染部位での迅速な免疫応答を誘導します。しかし、それぞれの記憶キラーT細胞集団も決して均一ではなく、記憶キラーT細胞の起源や多様性がどのように形成されるかは明らかになっていませんでした。 記憶キラーT細胞の分化機構を解明することは、効率的なワクチンの開発に重要です。これまでの研究では、非常に強い抗原刺激を受けたエフェクターキラーT細胞は、終末分化マーカーとして知られるKLRG1を発現し、このKLRG1陽性細胞が高い細胞障害活性を持ち、大部分が記憶キラーT細胞へ分化せずに死滅することが報告されています注2)。また、生き残ったKLRG1陽性細胞もTem細胞という限られた細胞集団にしか分化できず、終末分化に近い状態であると考えられていました。
一方、KLRG1陰性エフェクターキラーT細胞は、インターロイキン7受容体[6]を強く発現し、全ての種類の記憶キラーT細胞へ分化できる前駆細胞であるとも考えられていました。しかし、このモデルは非常に単純化されたものであり、KLRG1陰性のキラーT細胞も不均一な細胞集団であることから、異なる機能を持つ記憶キラーT細胞が同一の前駆細胞に由来するのか分かっていませんでした。さらに、KLRG1陽性キラーT細胞が、どの程度の分化可塑性[7]を維持しているか不明な点が多く残されていました。
注1)Gerlach et al. The Chemokine Receptor CX3CR1 Defines Three Antigen-Experienced CD8 T Cell Subsets with Distinct Roles in Immune Surveillance and Homeostasis. Immunity 45, 1270-1284, 2016.
注2)Joshi et al. Inflammation directs memory precursor and short-lived effector CD8+ T cell fates via the graded expression of T-bet transcription factor. Immunity. 27, 281-295, 2007.
研究手法と成果
国際共同研究グループは、マウスにおいてキラーT細胞での終末分化マーカーKLRG1発現の有無と、記憶キラーT細胞への分化の関係を詳しく解析するため「細胞系譜追跡法」という手法を確立しました(図1)。この方法は、KLRG1を一度でも発現したキラーT細胞を赤色蛍光(tdTomato)タンパク質で不可逆的に標識することができます。さらに、抗KLRG1抗体染色[8]と組み合わせることで、①KLRG1を一度も発現していない細胞(KLRG1陰性;KLRG1-tdTomato-)、②KLRG1を発現し続けている細胞(KLRG1陽性;KLRG1+tdTomato+)、③KLRG1を発現した経験はあるがその発現を消失した細胞(KLRG1-tdTomato+)を区別できます。本研究では、この手法により同定したKLRG1-tdTomato+細胞を「exKLRG1」細胞と名付け、細胞集団の特徴や機能を解析しました。
KLRG1を使った細胞系譜追跡法を用いて、リステリア菌感染後のKLRG1とtdTomatoの発現動態を観察したところ、菌体が排除され炎症応答が終息に向かう時期に、KLRG1陰性細胞やKLRG1陽性細胞に加え、exKLRG1細胞も出現することを見いだしました(図2)。このexKLRG1細胞は持続期でも確認され、循環型記憶キラーT細胞中(血液、リンパ節、脾臓)に約20~30%の割合で存在していました。さらに、非循環型記憶キラーT細胞(肺、肝臓、小腸)は全てKLRG1陰性であり、このうちexKLRG1細胞は約40~50%という非常に高い割合で存在していました。この結果は、KLRG1陽性キラーT細胞は高い分化可塑性を持ち、KLRG1発現を消失して、さまざまな記憶キラーT細胞へと分化することを示しています。
KLRG1発現経験の有無と循環型記憶キラーT細胞の分化の関係性をさらに解析した結果、exKLRG1細胞は、Tcm細胞とTem細胞から構成される不均一な細胞集団であることが分かりました。一方、KLRG1陰性細胞の多くがTcm細胞であり、KLRG1陽性細胞の大部分がTem細胞で構成されていました。さらに、exKLRG1細胞は中程度のケモカイン受容体CX3CR1を発現しており、大部分のTpm細胞はexKLRG1細胞であることも明らかとなりました。
次に、どのようなエフェクターキラーT細胞がexKLRG1細胞へと分化するのかを明らかにするために、遺伝子発現解析を行いました。その結果、KLRG1陽性細胞は細胞障害活性に関連する遺伝子が高発現しており、KLRG1陰性細胞では記憶キラーT細胞の分化促進に関連する遺伝子が強く発現していました。一方、exKLRG1細胞はこれらの遺伝子を中程度に発現しており、抗原刺激を中程度に受けたキラーT細胞がexKLRG1細胞へと分化していることが示されました。
Bach2は、記憶T細胞や記憶B細胞[9]の分化に必須の役割を果たしている転写抑制因子です。Bach2の発現がKLRG1陽性キラーT細胞に比べexKLRG1キラーT細胞で高発現していることも分かりました。そこで、生体内でBach2遺伝子をKLRG1陽性キラーT細胞で欠損させたところ、循環型exKLRG1細胞の分化が障害されました。一方、KLRG1陽性キラーT細胞でBach2の発現を誘導したところ、循環型exKLRG1細胞の分化が亢進することが分かりました。つまり、Bach2の発現強度がexKLRG1細胞の分化制御に重要であることが明らかとなりました。
最後に、細胞移入実験による肺でのインフルエンザ感染や皮膚がん(悪性黒色腫)に対するexKLRG1記憶T細胞の生体防御能について検討しました。その結果、KLRG1陽性記憶T細胞はインフルエンザ感染のみ、KLRG1陰性記憶T細胞は皮膚がんのみに効率の良い免疫応答を誘導したのに対し、exKLRG1記憶Tキラー細胞はどちらの実験モデルにおいても高い生体防御機能を発揮しました。以上の結果、exKLRG1記憶Tキラー細胞は多彩な機能を兼ね備えた細胞集団であることが明らかになりました。
今後の期待
本研究により、記憶キラーT細胞の多様性の形成には、抗原刺激の強度が重要な役割を果たしていることが分かりました。特に中程度の抗原刺激を受けたキラーT細胞はKLRG1を一時的に発現し、高い細胞障害活性と増殖能を持つさまざまな記憶キラーT細胞へと分化することで、記憶キラーT細胞の多様性の形成や生体防御に貢献していることが明らかとなりました。
今後、exKLRG1細胞の特異的マーカーや分化機構を詳細に解析することで、感染症やがんに対するキラーT細胞の生体防御能を反映する新たなバイオマーカー検索に貢献することが期待できます。
原論文情報
- Dietmar Herndler-Brandstetter, Harumichi Ishigame, Ryo Shinnakasu, Valerie Plajer, Carmen Stecher, Jun Zhao, Melanie Lietzenmayer, Lina Kroehling, Akiko Takumi, Kohei Kometani, Takeshi Inoue, Yuval Kluger, Susan M. Kaech, Tomohiro Kurosaki, Takaharu Okada & Richard A. Flavell, “KLRG1+ effector CD8+ T cells lose KLRG1, differentiate into all memory T cell lineages, and convey enhanced protective immunity”, mmunity, 10.1016/j.immuni.2018.03.015
発表者
理化学研究所
生命医科学研究センター 組織動態研究チーム
チームリーダー 岡田 峰陽
(旧 統合生命医科学研究センター 組織動態研究チーム チームリーダー)
研究員 石亀 晴道(いしがめ はるみち)
(旧 統合生命医科学研究センター 組織動態研究チーム 研究員)
報道担当
理化学研究所 広報室 報道担当
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- 記憶キラーT細胞、キラーT細胞
- キラーT細胞は、細胞表面にCD8とT細胞受容体と呼ばれる分子を発現しているリンパ球の一種。これらを介して細胞内寄生性病原体に感染した細胞やがん細胞を抗原特異的に認識することで活性化すると、標的細胞を殺傷する能力を持つエフェクターキラーT細胞へと分化する。記憶キラーT細胞は、一部のエフェクターキラーT細胞が、標的細胞を殺傷する能力を維持したまま長期間生存可能な能力を獲得したキラーT細胞。一度遭遇した特定の抗原を記憶し、再度同じ抗原に暴露されると迅速で効率の良い免疫応答を惹起する。記憶キラーT細胞の局在・遊走能や機能により、循環型記憶キラーT細胞であるセントラル記憶T細胞(Tcm)、エフェクター記憶T細胞(Tem)、末梢記憶T細胞(Tpm)、非循環型の組織潜在型記憶T細胞(Trm)に大別される。
-
- KLRG1
- リンパ球に発現する細胞表面抗原。キラーT細胞ではT細胞受容体や炎症性サイトカインの刺激を強く受け、非常に増殖したエフェクターキラーT細胞上で発現が誘導されることから、終末分化マーカーとして使用されている。KLRG1は、Killer cell lectin-like receptor subfamily G member 1 の略。
-
- 細胞系譜追跡法
- Cre-loxpシステムなどの部位特異的遺伝子組換えシステムを用いて、目的の遺伝子を発現した経験を持つ細胞を不可逆的に蛍光タンパク質などのレポーター遺伝子で標識することにより、標識された細胞の運命を追跡する手法。この手法により、目的の遺伝子がある段階で発現し、その後その発現を消失した細胞の運命も追跡することができる。
-
- リステリア菌
- 土壌や河川、家畜の糞便や乳などに含まれる、自然界に広く分布する細菌。ヒトでは、リステリア菌に汚染された加工食品を摂取することにより感染する。
-
- ケモカイン受容体
- 免疫細胞の移動を調節する生理活性物質のケモカインからのシグナルを受け取るタンパク質で、細胞表面に発現している。
-
- インターロイキン7受容体
- T細胞の発達や維持に必須であるインターロイキン7という生理活性物質からの刺激を受け取るための受容体。記憶キラーT細胞の前駆細胞のマーカーとして使用される。
-
- 分化可塑性
- 幹細胞などさまざまな種類の細胞へ分化する能力が高い細胞は、特定の細胞系列へ特殊化していくに従って分化能が低下していき、最終的には他の異なる細胞系列へ分化することができない終末分化した細胞になる。しかし、ある段階まで分化が進行した細胞がこれまで持っていた分化能を保持していた場合に、外界の刺激などによって機能や特徴の異なる細胞系列に分化することが知られており、この性質を分化可塑性と呼ぶ。
-
- 抗KLRG1抗体染色
- 蛍光標識されたKLRG1を認識する抗体(抗KLRG1抗体)を用いて、単離した免疫細胞を染色すること。KLRG1を発現し続けている細胞を検出することができる。
-
- 記憶B細胞
- B細胞は、細胞表面にB細胞受容体と呼ばれる分子を発現しているリンパ球の一種で、B細胞受容体を介して抗原を特異的に認識し、活性化すると抗体を産生する。一部の活性化したB細胞は記憶B細胞へと分化し、再度同じ抗原に暴露されると迅速で良質な抗体を大量に産生する。記憶キラーT細胞と同様に、ワクチン療法に重要な役割を果たしている。
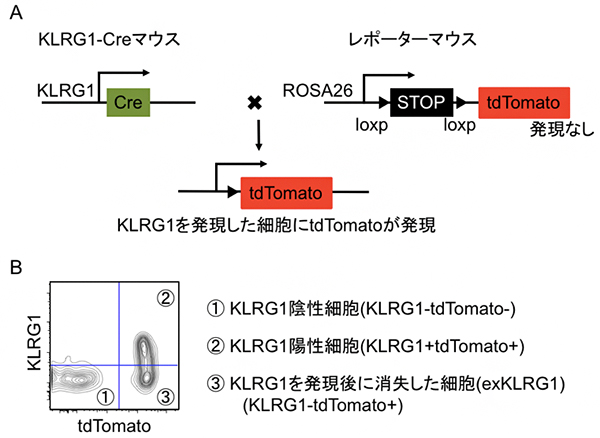
図1 細胞系譜追跡法を用いた記憶キラーT細胞分化機構の解析
(A)KLRG1遺伝子の発現制御下で、部位特異的組換え酵素のCre遺伝子が発現する遺伝子改変マウス(KLRG1-Cre)を作製した。次に、マウスの全身で構成的に発現するROSA26遺伝子に、loxp配列で挟んだSTOPカセットとtdTomato遺伝子を導入したレポーターマウスを作製し、KLRG1-Creマウスと交配した。得られたマウスでは、KLRG1が発現した細胞だけにCre遺伝子が発現し、loxp配列を認識してSTOPカセットが除去され、tdTomatoが発現する。
(B)細胞系譜追跡法と抗KLRG1抗体による細胞染色を組み合わせることにより、①KLRG1を一度も発現していない細胞(KLRG1陰性;KLRG1-tdTomato-)、②KLRG1を発現し続けている細胞(KLRG1陽性;KLRG1+tdTomato+)、③KLRG1を発現した経験があるがその発現を消失した細胞(exKLRG1細胞:KLRG1-tdTomato+)を区別できる。
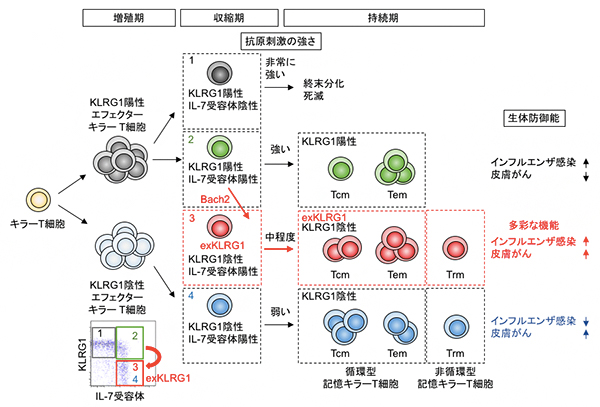
図2 KLRG1陽性細胞の分化可塑性による記憶キラーT細胞の多様性形成の模式図
記憶キラーT細胞の多様性の形成には、抗原刺激の強度が重要な役割を果たしている。特に、中程度の抗原刺激を受けたキラーT細胞は分化終末マーカーKLRG1を一時的に発現した後消失し、転写抑制因子であるBach2依存的にexKLRG1細胞へと分化する(赤矢印)。exKLRG1細胞は、高い細胞障害活性と増植能を特徴とするさまざまな種類の記憶キラーT細胞(Tcm、Tem、Trm)へと分化する能力を持ち(赤矢印)、exKLRG1記憶キラーT細胞は、肺でのインフルエンザ感染や皮膚がん(悪性黒色腫)に対する高い生体防御機能を発揮する。