2020-11-24 東京大学
発表のポイント
◆DNAが3次元的にパッケージングされた細胞核内で、外部の環境変化に応じて遺伝子の空間配置を変化させて発現をONにするメカニズムを解明した。
◆長年不明であった植物の細胞核の構造維持タンパク質がCRWN(クラウン)であることを証明した。また、外部環境の銅濃度変化で、銅関連遺伝子の空間位置が核膜近傍に移動し、CRWNタンパク質と結合することで遺伝子の発現がONになることがわかった。
◆環境変化に応答して遺伝子が発現するためには、遺伝子の空間配置が重要であることがわかった。遺伝子の空間配置を人為的に制御することで、環境変化に強い生物種を創り出す技術開発に貢献することが期待される。
発表概要
遺伝子は3次元的にDNAがパッケージングされた細胞核内で、空間に配置(注1)されています。そのため、遺伝子が細胞核内の3次元的配置を変化させて、遺伝子発現のON/OFFを調節することが知られていましたが、その詳細なメカニズムは不明なままでした。
大阪大学大学院理学研究科の坂本勇貴助教と東京大学大学院新領域創成科学研究科の松永幸大教授らは、CRWN(注2)が長年不明であった植物の細胞核を裏打ちするタンパク質であることを証明しました。さらに、銅環境の変化(注3)に合わせて銅関連遺伝子の空間配置が変化し、銅関連遺伝子がCRWNに結合することで遺伝子の発現がONになることを明らかにしました。最新のイメージング技術や生化学的手法を用いることで、外部環境の変化に応じて遺伝子の空間配置を変化させる分子メカニズムが明らかになりました。この研究成果は、空間的な遺伝子発現制御メカニズム研究の扉を開くとともに、遺伝子の空間配置を人為的に制御することで、環境変化に強い生物種を創り出す新しい分子育種技術の開発に貢献すると期待されます。
本研究は、文部科学省科学研究費・新学術領域「植物の成長可塑性を支える環境認識と記憶の自律分散型統御システム」(15H05955、15H05962)、「先端バイオイメージング支援プラットフォーム」(16H06280)、若手研究(18K14743)、基盤研究B(19H03259)、三菱財団自然研究科学研究助成、ノバルティス科学振興財団研究奨励金、笹川科学研究助成などのもとで実施されました。
発表内容
DNAは3次元的にパッケージングされた細胞核内で、空間配置を取ります。その空間配置は固定されているのではなく、遺伝子の発現に合わせて、ダイナミックに変化することが最近わかってきました。その配置が変化するレベルは微小な移動だけではなく、細胞核の内側から細胞核膜の直下まで大規模に変化することが、ライブイメージングの研究で明らかにされてきました。しかし、そのような大規模な遺伝子の空間配置の変化と遺伝子発現の関係やそのメカニズムは不明でした。
今回、モデル植物シロイヌナズナの細胞核膜に局在するタンパク質CRWN(クラウン)に注目して研究を進めました。まず、CRWNの細胞核の存在場所を電子顕微鏡で調べると、核膜の内側直下に多く存在していました。また、超解像顕微鏡STED(注4)によりイメージングすることで、CRWNは核膜の内側でメッシュ状の構造を取ることがわかりました(図1)。このような構造をとるものとして、動物の核膜の裏打ちタンパク質のラミンが知られていますが、CRWNとラミンにはアミノ酸の相同性はなく、植物ゲノムにラミン遺伝子がないことから、植物の細胞核の裏打ちタンパク質は長年、その実体が不明でした。今回、CRWNがメッシュ状の構造を作り、植物の核膜を裏打ちするタンパク質であることを証明することができました。
次に、CRWNの機能を失わせた変異体(CRWN変異体)を調べると、興味深いことに、銅関連タンパク質CAの遺伝子発現量が低下していることがわかりました。このCA遺伝子は11個の相同遺伝子配列が連なったクラスターを形成しており、そのうちの5個のCA遺伝子の発現量が減っていました。そこで、銅耐性を調べると、CRWN変異体は銅に対する耐性が著しく低下していることがわかりました。
さらに、ChIL法(注5)によってCRWNとCA遺伝子クラスター領域の相互作用を調べたところ、クラスター内の特定の領域がCRWNと相互作用することがわかりました。そこで、FISH法(注6)によってCA遺伝子クラスターを可視化して、細胞核内の配置を調べました。その結果、銅濃度が高い環境になると、CA遺伝子クラスターは細胞核内側から核膜近辺の外側に移動することが明らかになりました。一方、CRWN変異体では、この移動が見られなくなりました。このことから、CA遺伝子の空間ポジションが内側から核膜近傍に変化することで、CRWNと結合してCA遺伝子の転写が行われ、銅耐性を示すことがわかりました(図2)。これらの結果から、植物の核膜付近には、CRWNを基盤とした転写活性化領域があると推測しています。
今回の研究成果は、遺伝子の空間配置を変化させて遺伝子を発現させる分子メカニズム研究の突破口を開くとともに、従来の遺伝子発現制御に空間配置の概念を導入した画期的な発見と言えます。CRWNと相同的な機能を持つラミンは動物に広く存在することから、動植物を問わず、新しい遺伝子発現制御法の開発につながると期待されます。また、遺伝子の空間配置を制御するという概念を導入することで、環境変化に強い農作物を開発する新しい分子育種に貢献することが期待されます。
発表雑誌
雑誌名:Nature Communications(オンライン版:11月20日)
論文タイトル:Subnuclear gene positioning through lamina association affects copper tolerance
著者:Yuki Sakamoto, Mayuko Sato, Yoshikatsu Sato, Akihito Harada, Takamasa Suzuki, Chieko Goto, Kentaro Tamura, Kiminori Toyooka, Hiroshi Kimura, Yasuyuki Ohkawa, Ikuko Hara-Nishimura, Shingo Takagi and Sachihiro Matsunaga*
DOI番号:10.1038/s41467-020-19621-z
発表者
坂本 勇貴(大阪大学大学院理学研究科生物科学専攻 助教)
佐藤 繭子(理化学研究所環境資源科学研究センター質量分析・顕微鏡解析ユニット 技師)
佐藤 良勝(名古屋大学トランスフォーマティブ生命分子研究所ライブイメージングセンター 特任准教授)
原田 哲仁(九州大学生体防御医学研究所トランスオミクス医学研究センター 助教)
鈴木 孝征(中部大学応用生物学部応用生物化学科 准教授)
後藤千恵子(東京大学大学院農学生命科学研究科/日本学術振興会特別研究員:研究当時)
田村謙太郎(静岡県立大学食品栄養科学部 准教授)
豊岡 公徳(理化学研究所環境資源科学研究センター質量分析・顕微鏡解析ユニット 上級技師)
木村 宏 (東京工業大学科学技術創成研究院細胞制御工学研究センター 教授)
大川 恭行(九州大学生体防御医学研究所トランスオミクス医学研究センター 教授)
西村いくこ(甲南大学 特別客員教授/京都大学名誉教授)
高木 慎吾(大阪大学大学院理学研究科生物科学専攻 教授)
松永 幸大(東京大学大学院新領域創成科学研究科先端生命科学専攻 教授/東京理科大学 客員教授)
用語解説
(注1)遺伝子の空間配置
遺伝子は3次元的に折りたたまれて細胞核に収納されている。折りたたまれたままでは遺伝子発現ができないので、遺伝子発現の時には、折りたたみ構造が解かれたり、細胞核内の位置を変えたりすることが知られている。しかし、遺伝子の空間配置の制御システムは未解明なままである。
(注2)CRWN(クラウン)
植物の細胞核を裏打ちするタンパク質である。正式名称はCRWDED NUCLEI。CRWNタンパク質が欠損すると細胞核が丸くなる。このことから、細胞核の形を核膜の裏側から支える構造タンパク質と考えられてきたが、その構造パターンはわからなかった。今回初めてメッシュ構造を超解像顕微鏡で明らかにした。
(注3)銅環境の変化
銅は植物の必須元素のひとつである。しかし、過剰な銅が存在すると植物の発育が悪くなる。そのため、植物は銅関連タンパク質による銅耐性のメカニズムを備えている。
(注4)超解像顕微鏡STED
2014年にノーベル化学賞の対象となった超解像顕微鏡Stimulated Emission Depletionのこと。従来のコンフォーカル顕微鏡よりも更に高解像度に解析することが可能であり、今回、CRWNのメッシュ状構造を明らかにすることに威力を発揮した。
(注5)ChIL法
クロマチン挿入標識 Chromatin Integration Labelingのこと。タンパク質が結合するDNA領域を決定する手法 である。
(注6)FISH法
蛍光in situ hybridization (Fluorescence in situ hybridization)のこと。細胞核や染色体の中に含まれる特異的なDNAをハイブリダイゼーションにより可視化する方法である。
添付資料
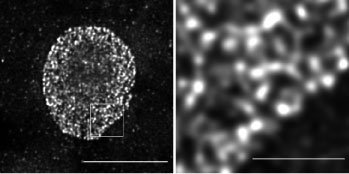
図1 超解像顕微鏡により明らかになった核膜におけるCRWNタンパク質の局在
左の写真はシロイヌナズナの細胞核を示す。CRWNに蛍光タンパク質を繋ぎ、蛍光タンパク質に対して免疫染色を行い、超解像顕微鏡でSTED像を得ると、右の写真のようにCRWNはメッシュ状構造をとっていることがわかる。左と右のスケールバーは5 mmと 1 mmを示す。
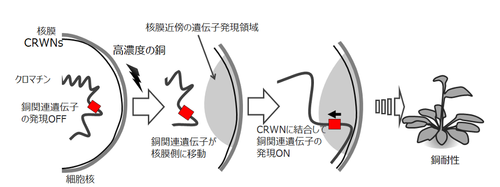
図2 銅関連遺伝子の空間配置制御
銅関連遺伝子が核膜から離れた位置にあるときは遺伝子の発現は起こらない。高濃度の銅を与えると、銅関連遺伝子が核膜側に移動し、銅関連遺伝子がCRWNに結合して遺伝子発現が起こる。その結果、植物は銅耐性を示すようになる。植物の核膜近傍にはCRWNをプラットホームとした遺伝子発現をONにする領域(遺伝子活性化領域)が存在する可能性がある。