2021-03-03 東京大学
1.発表者
- 岡本 晃充(東京大学 先端科学技術研究センター 生命反応化学分野 教授)
- 森廣 邦彦(東京大学 大学院工学系研究科 化学生命工学専攻 助教)
2.発表のポイント
- 酸素濃度が低い環境下の腫瘍細胞を殺す「ミニ核酸」を開発しました。
- 強力な抗腫瘍効果が現れます。
- 従来の抗がん剤に代わる化学療法として大きく期待されます。
3.発表概要
従来の抗がん剤は腫瘍細胞だけでなく健康な細胞にも作用するものが多く、これらによって引き起こされる悪心や脱毛、肺炎などの副作用が治療中止や患者のクオリティ・オブ・ライフ(Quality of Life:QOL)低下をもたらすため、がん細胞に選択的に働く抗がん剤が求められています。また悪性のがん組織では過剰な細胞の増殖により酸素濃度が低い環境を部分的に作り出されますが、低酸素環境(注1)に順応したがん細胞はさらなるがんの悪性化に関わるので、このようながん細胞を撃退する抗がん剤が必要です。
東京大学先端科学技術研究センターの岡本晃充教授と大学院工学系研究科の森廣邦彦助教は、従来抗がん剤として使用されてきたフロクスウリジン(Floxuridine)を6分子連結させて、低酸素環境下でのみ除去できる分子構造を付加し、高い腫瘍ターゲティング能を持った「ミニ核酸医薬」を開発しました。このミニ核酸医薬をヒトの腫瘍細胞に加えたとき、酸素濃度が低い環境でのみ抗がん活性を示し、ミニ核酸医薬の静脈注射でも固形腫瘍の増大を効果的に抑制しました。
この強力な抗腫瘍効果と低酸素環境選択性を併せもつミニ核酸医薬は、従来の抗がん剤に代わる化学療法として大きな期待が寄せられます。
4.発表内容
日本人の死因の第一位は長年の間がん(悪性新生物)であり、その効果的な治療法の開発は急務です。なかでも抗がん剤を用いた化学療法は外科手術や放射線療法とともに現在のがん治療の基本戦略となっており、根治はもちろんのこと、外科手術や放射線療法の補助としての利用や延命目的など非常に重要な役割を果たしてきました。しかしこれまでに世界中で開発され現在臨床現場で利用されている多くの抗がん剤のほとんどは、腫瘍細胞だけでなく健康な細胞も攻撃するため、患者が副作用に苦しみ、治療の中止やQOLの低下を招いてしまうことが問題となっています。また高い薬効を保ったまま副作用を低減させることは非常に困難であり、有効かつ安心・安全な抗がん剤の開発は現在医療においても喫緊の課題となっています(注2)。
抗がん剤の副作用の問題を解決する手法として、腫瘍細胞のターゲティング(標的化)が有効であると考えられています。腫瘍細胞の内部や周辺の化学環境は健康な正常細胞とは大きく異なるため、抗がん剤が攻撃する細胞を区別するためのマーカーとしてその違いが利用でき、特に低酸素はほぼ全ての固形腫瘍に見られる特徴的な環境であることから、多様ながん種に対応したターゲティングが期待されています。しかし同時に低酸素環境下では腫瘍細胞が薬剤耐性(注3)をもつことも報告されており、従来とは異なるメカニズムによる強力な抗腫瘍効果の発現が必要となります。
本研究では細胞内の酵素による還元反応を利用することで、低酸素環境下で選択的に腫瘍細胞を殺すことができる人工「ミニ核酸医薬」を開発しました。ここで言うミニ核酸とは、従来抗がん剤として使用されてきたフロクスウリジンを数個連結したオリゴ核酸(注4)を指します。細胞内に侵入したミニ核酸はヌクレアーゼ(注5)によってバラバラに分解され、活性体であるモノリン酸体(注6)を直接放出するため、フロクスウリジンと比較して非常に高い抗腫瘍効果を示すことが知られていますが、正常細胞に対する副作用の大きさが懸念されていました。
本研究においては、まず、ミニ核酸上に低酸素環境下で除去できる保護基を有機化学的に搭載することで、腫瘍ターゲティング能を付与しました。合成したミニ核酸医薬は通常の酸素濃度下では細胞内で安定に存在して無毒である一方、低酸素環境下では保護基が除去され、細胞内に存在するヌクレアーゼによって分解されることで非常に強力な細胞殺傷能力を発揮することが分かりました(図1)。すなわち、腫瘍環境選択的な抗がん剤として非常に有用な薬剤であることが期待できます。さらに実践的に薬効を評価するべく、ヒト腫瘍細胞を移植したマウスにミニ核酸医薬を投与したところ薬剤を投与しなかった群と比較するとミニ核酸医薬投与群では腫瘍の増大が有意に抑制され、動物個体内の腫瘍においても優れた抗がん活性を示すことが明らかになりました(図2)。
今回研究チームは、高い抗がん効果をもつミニ核酸にこれまでにない手法によって腫瘍環境選択性を付与することに成功しました。開発した低酸素環境応答性のミニ核酸医薬は、従来の核酸医薬と全く異なるメカニズムによって腫瘍細胞のみを殺傷するため、がん化学療法の副作用の問題を一挙に解決できる可能性があります。さらに、本研究での分子設計方法を応用することで他種の核酸医薬に腫瘍ターゲティング能を付与することも可能であり、従来の核酸医薬の利用範囲を大幅に拡大することが期待されます。また、研究チームは現在低酸素以外の腫瘍環境によって活性化する核酸医薬の開発研究にも取り組んでおり、本研究の成果と併せて利用することでより効果的で副作用の小さい抗がん剤の開発に応用する計画を進めています。
本研究成果は、米国化学会誌「Journal of the American Chemical Society」に掲載されました。
この研究は、日本学術振興会科学研究費助成事業(18H03931、18H05504、19K22245)および公益財団法人東京生化学研究会研究奨励金によって支援されました。
5.発表雑誌
雑誌名:Journal of the American Chemical Society
論文タイトル:Floxuridine Oligomers Activated under Hypoxic Environment
著者:K. Morihiro, T. Ishinabe, M. Takatsu, T. Osawa, and A. Okamoto
DOI:10.1021/jacs.0c10732
6.問い合わせ先
東京大学先端科学技術研究センター
教授 岡本 晃充(おかもと あきみつ)
7.用語解説
(注1)低酸素環境
固形がんでは過剰な増殖に伴う不完全な血管構築や血流不全によって酸素の供給が不足しており、健康な組織と比較して酸素濃度が低下している。通常組織の平均酸素濃度が約9%である一方、例えば乳がんでは平均酸素濃度は約4%に低下している(局所的には0%と極度な低酸素領域も存在する)。
(注2)参照情報
厚生労働省 https://www.mhlw.go.jp/toukei/saikin/hw/jinkou/suii09/deth1.html
国立がん研究センター https://ganjoho.jp/public/dia_tre/treatment/drug_therapy/dt02.html
(注3)薬剤耐性
腫瘍細胞が抗がん剤に対してもつ抵抗性。低酸素環境下では様々な遺伝子の発現量が変化して、腫瘍細胞の薬剤耐性獲得に寄与している。
(注4)オリゴ核酸
DNAやRNAの構成要素であるヌクレオシドがリン酸を介して数個から数十個程度連結した短い核酸化合物。
(注5)ヌクレアーゼ
核酸を分解する酵素。核酸の末端から順番に分解していく「エキソヌクレアーゼ」や核酸の途中を切断する「エンドヌクレアーゼ」に分類される。
(注6)モノリン酸体
ヌクレオシドにリン酸1分子が付加した状態。フロクスウリジンは細胞内でリン酸が付与されることで高い薬効を発揮する。
8.添付資料

図1. ミニ核酸医薬の低酸素環境選択的な薬効発現メカニズム
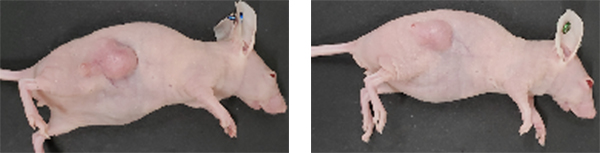
図2. マウス内腫瘍に対するミニ核酸医薬の抗がん活性評価(左:薬剤投与なし 右:ミニ核酸医薬投与)