2021-03-03 理化学研究所,鹿児島大学,東京慈恵会医科大学,東京大学
理化学研究所(理研)脳神経科学研究センター分子精神遺伝研究チームの大西哲生副チームリーダー、吉川武男チームリーダー、生命機能科学研究センター分子配列比較解析チームの門田満隆技師、鹿児島大学医歯学総合研究科の城山優治助教、東京慈恵会医科大学の有馬史子臨時研究職員、東京大学医科学研究所の真鍋俊也教授らの共同研究グループは、代表的な精神疾患である統合失調症[1]の病因に転写調節因子[2]のLDB2タンパク質が関与する仕組みを明らかにしました。
本研究成果は、精神疾患の発症メカニズムの理解に向けた取り組みに貢献すると期待できます。
共同研究グループは、均衡型染色体転座[3]を持つまれな統合失調症症例において、LDB2遺伝子が染色体切断点の近くに存在することを報告しています。本研究では、Ldb2を破壊したマウスが精神疾患に類似する行動異常を示すこと、LDB2タンパク質が、脳において神経活動の調節に関わること、転写因子のEGRタンパク質[4]と協調して遺伝子の発現を調節する可能性があることを見いだしました。これにより、LDB2-EGR系の発現調節機構の破綻が精神疾患の発症に関連することが明らかになりました。
本研究は、科学雑誌『EMBO Molecular Medicine』オンライン版(3月3日付)に掲載されます。
背景
統合失調症は生涯罹患率が人口の約1%と高く、国内の総患者数は70万人以上と推定されています注1)。多くは10代後半から青年期に発症し、患者のその後の人生に大きな影響を与えることになります。現在、その治療の中心は神経伝達物質の働きを抑える薬剤の投与による薬物療法です。しかし、効果が不十分な場合も多く、疾患の病因を分子レベルで解明し、それに基づく治療法や予防法の開発が求められています。
統合失調症の発症には、環境要因とともに遺伝要因が大きく関与していることが判明しています。遺伝要因に関しては、現在まで極めて多数の遺伝子との関連が示唆されてきましたが、その遺伝学的効果も生物学的効果も微小なものが多く、根本的な病因解明は困難でした。
本研究では、単一の遺伝的変化と発症原因の連結が比較的容易であると考えられるごくまれな統合失調症症例に着目しました。共同研究グループは4番染色体と13番染色体との間の「均衡型染色体転座」を持つこの症例注2)において、4番染色体側の切断点近くにLDB2遺伝子が存在すること、その一方で13番染色体側の切断点近くには既知の遺伝子がないことを2020年に明らかにしました注3)。今回、今まで不明であったLDB2遺伝子の機能と、その遺伝子が統合失調症発症に果たす役割をさまざまなアプローチを用いて明らかにすることを目指しました。
注1)平成23年(2011年)患者調査の概況(厚生労働省)(外部サイト)」
注2)Itokawa et al. Psychiatry Clin. Neurosci. 58: 333-7, 2004
注3)Horiuchi et al. Hum. Genome Var. 7: 31, 2020
研究手法と成果
共同研究グループはまず、LDB2タンパク質(図1A)に対する抗体を作製して、マウス脳においてこのタンパク質がどのような空間的発現パターンを示すかを調べました。その結果、LDB2タンパク質が大脳皮質の一部、扁桃体[5]、海馬といった脳領域の神経細胞に分布すること、そして細胞の中では核に選択的に存在することが分かりました。
次に、均衡型染色体転座を持つ患者からiPS細胞[6]を作製して調べたところ、LDB2遺伝子の発現が減少していたことから、患者では均衡型染色体転座によりLDB2遺伝子の働きが減弱していると考えられました。
そこで、この遺伝子を破壊したマウス(Ldb2 KOマウス)で、どのような行動が見られるかを詳しく調べました。その結果、過剰な活動性(図1B)、連合学習機能や注意力の異常を疑わせる恐怖条件付け課題(特に聴覚性恐怖条件付け課題[7])における異常(図1C)、などが認められました(図1)。また、シナプス[8]において神経伝達物質[8]のドーパミンの濃度を上昇させるメチルフェニデートや、グルタミン酸の受容体に対する阻害効果を示すMK-801といった薬剤に、過剰な応答性を示すことが判明しました(図1D)。これらの行動異常の一部は、統合失調症の治療薬クロザピン(図1E)や双極性障害[9]の治療薬のリチウムで緩和されることも分かりました(図1F)。
これらのことは、Ldb2 KOマウスが統合失調症を含む精神疾患に関連する生物学的特性を持つこと、均衡型染色体転座を持つ患者においてはLDB2遺伝子の機能低下が統合失調症の発症に大きく関与した可能性を示しています。
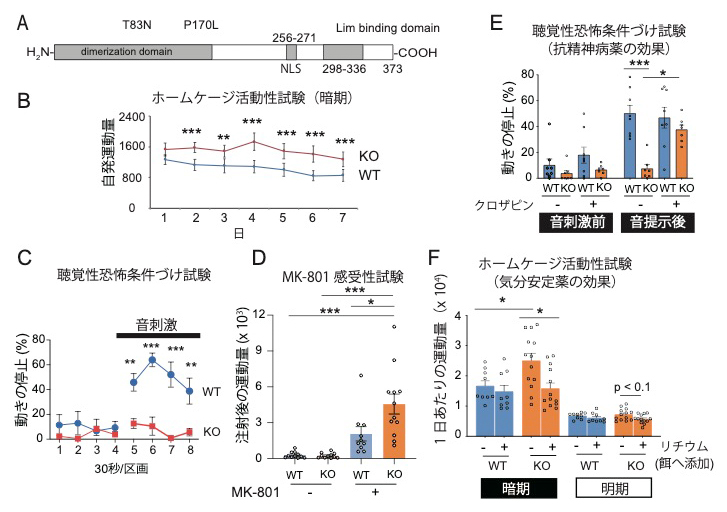
図1 LDB2タンパク質の構造とLdb2 KOマウスに見られる精神疾患関連行動変化
A.LDB2タンパク質の基本構造。Dimerization domain(二量体化ドメイン)、NLS(核移行シグナル)、Lim-binding domain(LIMドメインを持つタンパク質が結合すると予測されるドメイン)などからなるが、DNA結合ドメインはない。
B.ホームケージ活動性試験で見られるLdb2 KOマウスの過活動性。
C.聴覚性恐怖条件付け試験。Ldb2 KOマウスは、聴覚刺激と電気ショックの同時提示による連合学習課題に異常を示し、条件づけ後、音を提示してもすくみ行動を起こさない。
D.Ldb2 KOマウスは、グルタミン酸受容体を阻害するMK-801に対する感受性が野生型マウスよりも高い。
E.統合失調症の治療に使われる抗精神病薬クロザピンを事前投与すると、Cで見られる行動異常が改善した。
F.気分安定薬のリチウム塩(炭酸リチウム)の長期投与により、Bで見られる過剰な活動性が改善した。
Ldb2 KOマウスに見られるさまざまな行動異常の中でも、聴覚性恐怖条件付け課題の成績低下が特に著しかったことから、この行動において中心的役割を果たす扁桃体の外側核(LA)(図2A)におけるLDB2タンパク質の役割に着目しました。神経活動依存的にその発現量が上昇しシナプス機能の調節に関わるArc遺伝子[10]の発現を、Venusタンパク質から生じる蛍光強度としてモニターできるArc-Venus-トランスジェニックマウス[11]を利用して解析しました。その結果、Ldb2遺伝子を破壊すると、音と電気ショックで処置した場合のLA内Venus蛍光陽性細胞の数とその蛍光強度が野生型に比べて増加すること(図2B)、過剰なARCタンパク質の発現はシナプスでの神経伝達効率を減弱させること、が判明しました。これらの結果より、通常の状態ではLDB2タンパク質はARC遺伝子の発現を抑制することで神経伝達を調節していると考えられました。
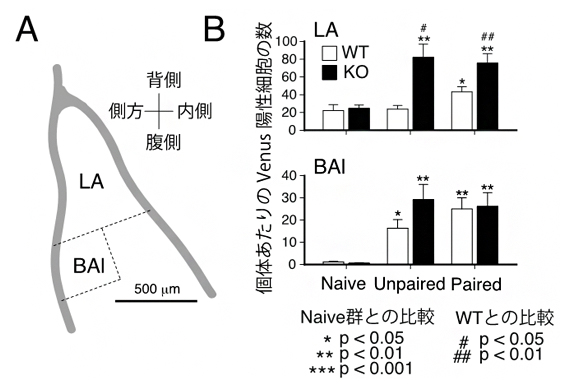
図2 Ldb2 KOマウスに見られる扁桃体の異常
A.扁桃体の模式図。扁桃体内のLA領域、BAl領域の場所を示す。
B.Arc-Venus陽性細胞の数。Naive; 無処置マウス、Unpaired; 音刺激と電気ショックを個別に8回ずつマウスに提示したもの、Paired; 音刺激と電気ショックのペアを同時に8回提示したもの。WTは野生型マウス、KOはLdb2 KOマウスを示す。
前述のように、LDB2タンパク質は神経細胞の核内に存在していることと、近縁分子のLDB1タンパク質は転写調節因子として働くことが報告されていることから、LDB2タンパク質は何らかの方法で遺伝子の発現を調節しているのではないかと考えられました。実際に、どのような遺伝子の発現がLDB2タンパク質により制御されるのかを明らかにするため、ヒトのiPS細胞から作製したニューロスフェア[12](神経細胞やグリア細胞に分化誘導可能な神経幹細胞に富む)において、抗LDB2抗体を用いたクロマチン免疫沈降シークエンシング(ChIP-seq)解析[13]を行いました。
その結果、LDB2タンパク質はゲノム上の1万カ所以上に結合可能であることが判明し、さらにはその結合部位の多くにはEGRファミリーと呼ばれる既知の転写因子の結合モチーフが存在することが分かりました(図3A)。EGRタンパク質に対する抗体でChIP-seq解析を行った結果が、公共データベースに報告されています。そのデータと照合することで、LDB2タンパク質とEGRタンパク質が共通に結合する領域を持つ遺伝子が多数存在し、その数は3,000以上あることが分かりました。その中には、上述のARC遺伝子のプロモーター領域[14]が含まれていました(図3B)。LDB2タンパク質とEGRタンパク質が協調して発現を制御すると考えられる遺伝子には、ARC遺伝子以外にもシナプス機能調節因子[15]の遺伝子が多く含まれていました。
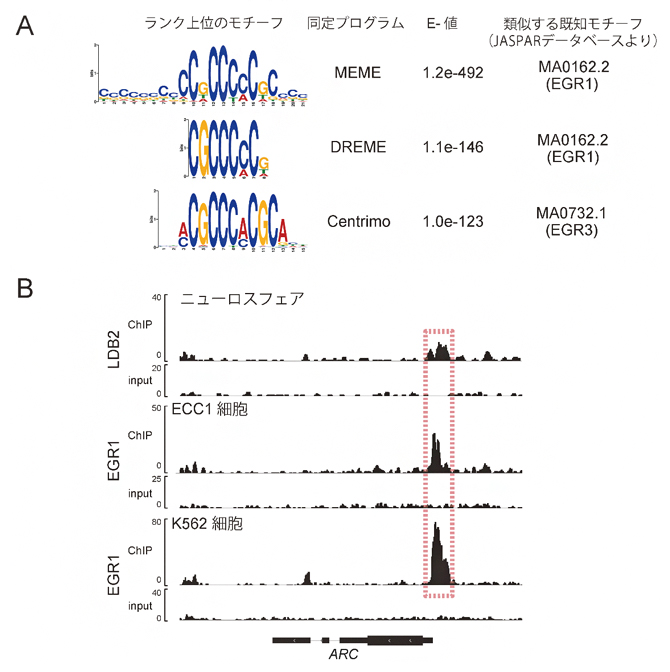
図3 LDB2抗体によるChIP-seq解析
A.抗LDB2抗体を用いてChIP-seq解析を行い、結合領域にどのような転写因子の結合モチーフがあるかを解析した結果。
B.EGR1に対する抗体でChIP-seq解析を行った結果(2段目、3段目は公共データベース)と今回の抗LDB2抗体によるChIPの結果(1段目)を比較。ARC遺伝子のプロモーター領域において、両者のピークが重なることが分かる(赤点線で囲んだ領域)。
共同研究グループは、2007年に一般症例を用いた遺伝学的解析により、EGRファミリーが統合失調症に関連することを報告していました注4)。本研究の成果と合わせて考えると、LDB2-EGR遺伝子発現調節系の異常は、シナプス機能の調節を介して、統合失調症をはじめとした精神疾患の発症につながる可能性が見えてきました(図4)。
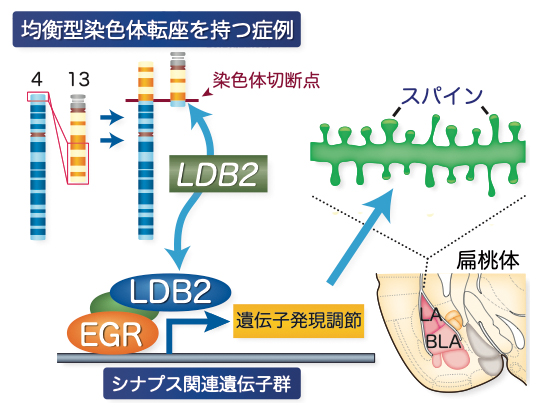
図4 本研究において提案する統合失調症発症に関わるメカニズム
4番染色体と13番染色体の均衡型染色体転座を持つ症例の、染色体切断点近くに位置する遺伝子として同定されたLDB2遺伝子の産物は、EGR転写因子群と機能的複合体を形成し、神経細胞においてさまざまな遺伝子の発現を調節し、扁桃体においてはARCなどのシナプス機能調節遺伝子の発現を介してシナプス機能(特にスパイン)に関わると考えられた。Ldb2 KOマウスの聴覚性恐怖条件づけ異常などの行動異常は、シナプス機能調節遺伝子の発現異常が関与している可能性がある。LDB2-EGR系を介した遺伝子発現調節系が、統合失調症をはじめとする精神疾患の原因に関連している可能性があり、今後の研究が待たれる。
注4)2007年2月20日プレスリリース「統合失調症の発症関連遺伝子群を日本人で発見(PDF 694.5KB)![]() 」
」
今後の期待
本研究では、染色体異常をもつ統合失調症症例を出発点にして、LDB2-EGR系の遺伝子発現調節系がシナプス機能の調節を介して統合失調症の発症に関与する可能性が示されました。今後、この遺伝子発現系を標的とした薬剤を開発することは、一般の症例の治療戦略として有効なアプローチとなり得ると期待できます。
共同研究グループは、LDB2タンパク質のアミノ酸を変化させる変異を双極性障害で複数発見しており注2)、Ldb2 KOマウスの過活動性が双極性障害治療薬のリチウムで改善されたことから、LDB2タンパク質は統合失調症だけではなく、双極性障害にも関与している可能性があり、今後の研究の展開が待たれます。
補足説明
1.統合失調症
代表的な精神疾患の一つで、幻覚や妄想、意欲の低下、感情の平坦化などが主要な症状で社会的機能も低下する。発症には、複数の遺伝的要因と環境要因が複雑に関与していると考えられている。遺伝的要因については、多数の遺伝子において遺伝子多型が報告されているが、個々の遺伝子多型の影響は大きくないといわれている。
2.転写調節因子
プロモーターやエンハンサーといった転写制御領域に結合することなどにより、RNAポリメラーゼによる遺伝子の転写を活性化あるいは不活性化する一連の核内タンパク質。DNAの特定の塩基配列(モチーフ)に結合するもの(転写因子)も含まれる。
3.均衡型染色体転座
染色体異常にはさまざまなタイプのものがあるが、その中でも複数の染色体が関与し、ある染色体の一部が破断して別の染色体に入り込んだ状態を転座という。転座が起きてもゲノム全体としては染色体量が変化しない(大きな欠失や重複がない)ものを特に均衡型染色体転座という。このような転座によって転座点付近に存在する遺伝子の機能に異常を来すことで、疾患の原因になることがある。
4.EGRタンパク質
前初期遺伝子群(immediate early genes: IEGs)にコードされる核タンパク質であり、転写因子として機能する。EGR1、EGR2、EGR3、EGR4の4種類が知られている。
5.扁桃体
側頭葉の内側に存在し、情動機能の制御に関与する。また、情動表出を伴う刺激の学習・記憶にも関与しており、特に本論文で用いた聴覚性恐怖条件付けは、扁桃体内の外側核(LA)が強く関与している。
6.iPS細胞
個体から採取した皮膚、血液などに含まれる分化した細胞を、人為的に受精卵のような未分化の状態にしたもの。京都大学の山中博士らのグループによって作製法が考案された。iPS細胞は、培養条件を調整することで、脳を構成する細胞など目的の細胞に分化させることができる。
7.聴覚性恐怖条件付け課題
げっ歯類に電気ショックと音を提示することで条件づけすると、次回からは音だけを提示しても「すくみ行動」が見られるようになる。これは扁桃体がその成立に強く関与する連合学習課題の一種で、注意力、集中力などに異常がある動物においてもその成績が低下する。
8.シナプス、神経伝達物質
神経細胞は別の神経細胞とシナプスという構造で接続しており、そのわずかな間隙において一連の神経伝達物質と呼ばれる物質で情報のやり取りをしている。脳の興奮性神経細胞の樹状突起といわれる領域には、スパインと呼ばれる微小な突起が形成されておりその部位に別細胞からの入力を受けるシナプスが存在する。
9.双極性障害
精神疾患の一種で、躁状態の期間とうつ状態の期間の両方が現れる。リチウム塩など一連の気分安定薬と呼ばれる薬剤による治療により気分の波が穏やかになる。
10.Arc遺伝子
細胞に増殖シグナルや分化シグナルなどが入力すると一時的かつ急速に転写される前初期遺伝子(Immediate-early gene)の一種で、神経細胞において神経活動依存的に発現することでシナプスにおける神経伝達強度を調節している。
11.トランスジェニックマウス
特定の遺伝子の機能や発現パターンを解析することを目的として、種々の遺伝子操作を行い、外来性遺伝子を導入したマウス。DNA断片を受精卵にマイクロインジェクションで導入して作製する。
12.ニューロスフェア
神経幹/前駆細胞の増殖因子であるEGFとbFGFを含む無血清培地中でiPS細胞を浮遊培養することで産生できる細胞塊。この方法によって、未分化能を維持したまま神経幹/前駆細胞を選択的に増殖させることができる。
13.クロマチン免疫沈降シークエンシング(ChIP-seq)解析
着目するタンパク質に特異的に結合する抗体を用いたクロマチン免疫沈降法と次世代シークエンスを組み合わせ、そのタンパク質がゲノム上のどの領域に結合しているかを網羅的に解析する技術。
14.プロモーター領域
ゲノムDNA上でRNAに書き写される領域の一番上流にあり、遺伝子を発現させる機能を持つ部分。プロモーター配列ともいう。
15.シナプス機能調節因子
神経伝達の場であるシナプスは、遺伝子の発現、タンパク質の活性調節などを介してその機能が動的に調節されている。ARCは代表的なシナプス機能調節因子である。
共同研究グループ
理化学研究所
脳神経科学研究センター
分子精神遺伝研究チーム
チームリーダー 吉川 武男(よしかわ たけお)
副チームリーダー 大西 哲生(おおにし てつお)
研究員 豊島 学(とよしま まなぶ)
研究員 島本(光山) 知恵(しまもと・みつやま ちえ)
研究員 前川 素子(まえかわ もとこ)
研究員 シャビーシュ・バラン(Shabeesh Balan)
研究員 豊田 倫子(とよた ともこ)
テクニカルスタッフ 大羽 尚子(おおば ひさこ)
テクニカルスタッフ 渡辺 明子(わたなべ あきこ)
テクニカルスタッフ 野崎 弥生(のざき やよい)
生体物質分析ユニット
専門技術員(研究当時) 岩山 佳美(いわやま よしみ)
局所神経回路研究チーム(旧理研脳科学総合研究センター)
ユニットリーダー(研究当時) 細谷 俊彦(ほそや としひこ)
テクニカルスタッフ(研究当時) 黒川 留美(くろかわ るみ)
リサーチリソースセンター
テクニカルスタッフ(研究当時) 山田 一之(やまだ かずゆき)
生命機能科学研究センター 分子配列比較解析チーム
チームリーダー 工樂 樹洋(くらく しげひろ)
技師 門田 満隆(かどた みつたか)
テクニカルスタッフ(研究当時) 田中 かおり(たなか かおり)
鹿児島大学 大学院医歯学総合研究科 生化学・分子生物学分野
教授 奥野 浩行(おくの ひろゆき)
助教 城山 優治(きやま ゆうじ)
東京慈恵会医科大学 総合医科学研究センター 臨床医学研究所
臨時研究職員 有馬 史子(ありま ふみこ)
東京都医学総合研究所 統合失調症プロジェクト
參事研究員・副所長 糸川 昌成(いとかわ まさなり)
プロジェクトリーダー 新井 誠(あらい まこと)
主席研究員 堀内 泰江(ほりうち やすえ)
主席研究員 宮下 光弘(みやした みつひろ)
主任研究員 鳥海 和也(とりうみ かずや)
研究員(研究当時) 市川 知恵(いちかわ ともえ)
研究員 鈴木 一浩(すずき かずひろ)
研究員 吉川 茜(よしかわ あかね)
東京大学
医科学研究所 神経ネットワーク分野
教授 真鍋 俊也(まなべ としや)
技術専門職員 小川 糸音(おがわ いとね)
大学院新領域創成科学研究科 メディカル情報生命専攻
特任教授 中谷 明弘(なかや あきひろ)
大学院医学系研究科 神経生化学教室
教授 尾藤 晴彦(びとう はるひこ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「DISC-Mが制御する遺伝子ネットワークの同定と精神疾患発症機序解明への応用(代表:大西哲生)」、同「Ldb2(Disc-M)ノックアウトマウスの表現型と統合失調症の病理解明への応用(代表:大西哲生)」、同「脳の高次機能発現と精神疾患関連転写調節複合体の機能(代表:大西哲生)」、同「新規遺伝子発現調節メカニズムLDB2-EGR/ARC系と精神疾患(代表:大西哲生)」、同「神経活動のプロファイリングを通じた扁桃体機能解析(代表:城山優治)」、同新学術領域研究(研究領域提案型)「新学術領域研究マルチスケール精神病態の構成的理解(領域代表者:林(高木)朗子)」、同若手研究(B)「統合失調症脆弱性に関わる候補遺伝子の多型および死後脳解析(代表:新井誠)」、同基盤研究(S)「神経伝達物質放出の修飾機構解明のための分子生理学的研究(代表:真鍋俊也)」、同新学術領域研究(研究領域提案型)「マイクロエンドフェノタイプによる精神病態学の創出(代表:喜田聡)」、同基盤研究(B)「細胞内カルシウム動態調節によるシナプス可塑性のシナプス部位特異的制御機構の解明(代表:真鍋俊也)」、同新学術領域研究(研究領域提案型)「脳・生活・人生の統合的理解にもとづく思春期からの主体価値発展学(代表:笠井清登)」による支援を受けて行われました。
原論文情報
Tetsuo Ohnishi, Yuji Kiyama, Fumiko Arima-Yoshida, Mitsutaka Kadota, Tomoe Ichikawa, Kazuyuki Yamada, Akiko Watanabe, Hisako Ohba, Kaori Tanaka, Akihiro Nakaya, Yasue Horiuchi, Yoshimi Iwayama, Manabu Toyoshima, Itone Ogawa, Chie Shimamoto-Mitsuyama, Motoko Maekawa, Shabeesh Balan, Makoto Arai, Mitsuhiro Miyashita, Kazuya Toriumi, Yayoi Nozaki, Rumi Kurokawa, Kazuhiro Suzuki, Akane Yoshikawa, Tomoko Toyota, Toshihiko Hosoya, Hiroyuki Okuno, Haruhiko Bito, Masanari Itokawa, Shigehiro Kuraku, Toshiya Manabe, Takeo Yoshikawa, “Cooperation of LIM domain-binding 2 (LDB2) with EGR in the pathogenesis of schizophrenia”, EMBO Molecular Medicine, 10.15252/emmm.202012574
発表者
理化学研究所
脳神経科学研究センター 分子精神遺伝研究チーム
副チームリーダー 大西 哲生(おおにし てつお)
チームリーダー 吉川 武男(よしかわ たけお)
生命機能科学研究センター 分子配列比較解析チーム
技師 門田 満隆(かどた みつたか)
鹿児島大学 大学院医歯学総合研究科 生化学・分子生物学分野
助教 城山 優治(きやま ゆうじ)
東京慈恵会医科大学 総合医科学研究センター 臨床医学研究所
臨時研究職員 有馬 史子(ありま ふみこ)
東京大学 医科学研究所 神経ネットワーク分野
教授 真鍋 俊也(まなべ としや)
報道担当
理化学研究所 広報室 報道担当
鹿児島大学 医歯学総合研究科 総務課 庶務係
東京慈恵会医科大学 広報課
東京大学医科学研究所 国際学術連携室(広報)