2021-03-26 京都大学
京都大学アイセムス(物質-細胞統合システム拠点)の鈴木淳教授、圓岡真宏特定助教、Daniel Packwood講師らの研究グループは、京都大学生命科学研究科の原田浩教授、徳島大学の小迫英尊教授と協力し、生体内において不要な細胞を除去する分子メカニズムを明らかにしました。この成果は、3月15日に米国科学雑誌モレキュラーセル誌(セルプレス)にてオンライン公開され、4月1日号に掲載されます。
<概要>
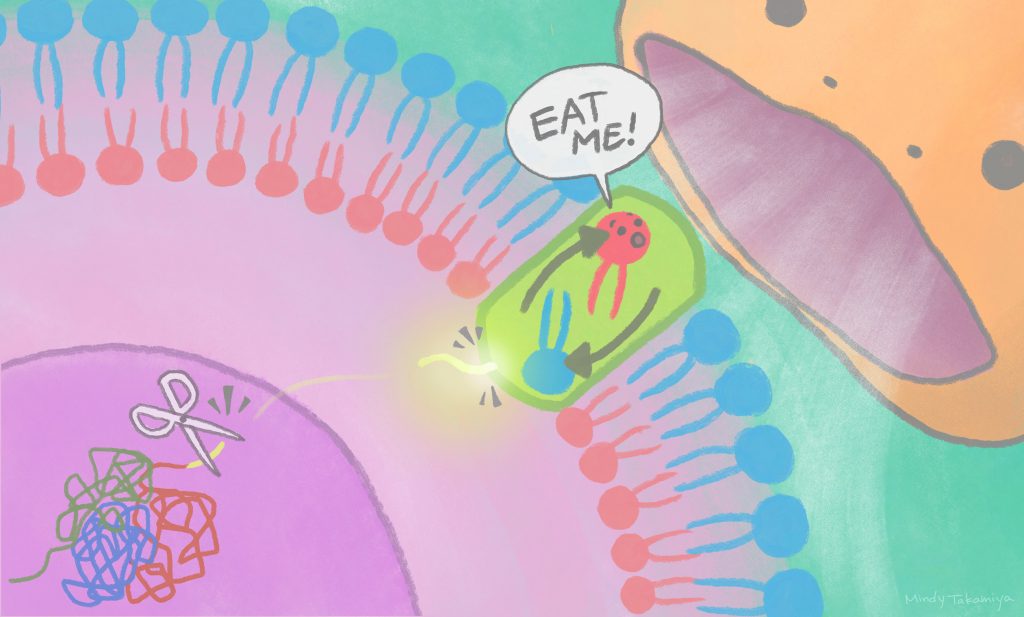
毎日、生体内では10-100億個の細胞がプログラムされた細胞死(アポトーシス)を起こしています。細胞死を起こした細胞が生体内に残存すると、細胞内容物が漏出し、これが免疫細胞を活性化させることで、炎症を引き起こしてしまいます。そのため、死んだ細胞は自分自身が適切に処理されるための目印を細胞表面に提示し、マクロファージ等の食細胞により認識され、貪食により除去されています。死んだ細胞はスクランブラーゼというタンパク質を用いて細胞膜を構成する脂質の一つホスファチジルセリン(PS)を“死んだ目印”として細胞表面に提示しますが、スクランブラーゼがどのように活性化するのか、その詳細な機構は分かっていませんでした。
今回、アイセムスの研究グループは、ゲノム編集技術であるクリスパーCas9を用いたリバイバルスクリーニングという独自のスクリーニング法を開発し、スクランブラーゼの活性化因子を同定しました。驚くことに、この活性化因子は通常は核内に存在しDNA修復に関与しており、カスパーゼとよばれる酵素によって切断されることでその一部が細胞質内に放出され、細胞膜中のスクランブラーゼに直接結合することでスクランブラーゼを活性化させることがわかりました。今回対象としたスクランブラーゼは脳の神経細胞で強く発現しており、脳内において不要な細胞の除去により神経変性疾患を防ぐなど脳の健康維持に関与していると考えられています。今後、見出された不要細胞除去システムを活用することで、脳内における不要細胞を除去し脳の健康を維持する新しい技術の開発が期待されます。
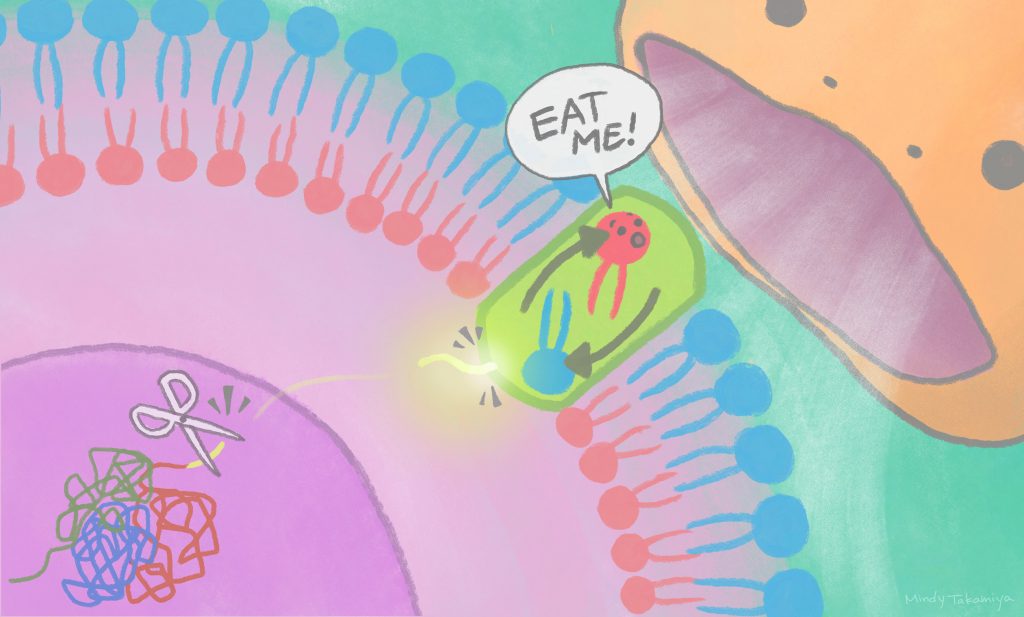
切断されたXRCC4タンパク質の一部が、細胞核から細胞膜へ移動してスクランブラーゼを活性化することで、細胞貪食のシグナルが細胞表面に出る。(©高宮ミンディ/京都大学アイセムス)
書誌情報
論文タイトル:“Caspase cleavage releases a nuclear protein fragment that stimulates phospholipid scrambling at the plasma membrane”
(参考訳:核内タンパク質の断片が細胞膜のリン脂質スクランブルを活性化する)
著者:Masahiro Maruoka, Panpan Zhang, Hiromi Mori, Eiichi Imanishi, Daniel Packwood, Hiroshi Harada, Hidetaka Kosako, Jun Suzuki