スプライソスタチンAの強い抗がん活性の解明に迫る
2021-03-30 理化学研究所
理化学研究所(理研)環境資源科学研究センターケミカルゲノミクス研究グループの吉田稔グループディレクター、芳本玲特別研究員(研究当時)、チピ・シュレスタ・ジャガット特別研究員、ティルマン・シュナイダー・ポッチュ研究員、開拓研究本部岩崎RNAシステム生化学研究室の岩崎信太郎主任研究員、生命医科学研究センター細胞機能変換技術研究チームの鈴木治和チームリーダー、古野正朗上級研究員(研究当時)らの共同研究グループは、スプライシング[1]調節化合物の「スプライソスタチンA(SSA)」が、細胞内のRNAに未成熟切断とポリA付加(アデノシンが複数連続した配列の付加)を引き起こすことを発見しました。
本研究成果は、抗がん作用のあるSSAをはじめとするスプライシング調節化合物の作用機序の解明や、非コードRNA[2]の新機能の解明に貢献すると期待できます。
SSAはスプライシングに必要なSF3b複合体と結合し、スプライシングを阻害し、前駆体メッセンジャーRNA(mRNA)の蓄積を引き起こします。
今回、共同研究グループはトランスクリプトーム解析[3]を行い、SSAがスプライシングの阻害に加えて、長鎖非コードRNA[4]である「MALAT1」と一部のmRNAに未成熟切断およびポリA付加を引き起こすことを発見しました。
本研究は、科学雑誌『Cell Chemical Biology』の掲載に先立ち、オンライン版(3月29日付:日本時間3月30日)に掲載されます。
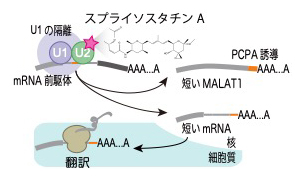
スプライソスタチンAによるMALAT1と一部のmRNAの未成熟切断およびポリA付加誘導
背景
「スプライシング」は、DNAから転写されたメッセンジャーRNA(mRNA)前駆体に含まれるタンパク質合成に不必要な部分(イントロン[5])を除き、必要な部分(エキソン)を連結する反応です。スプライシングは酵母からヒトまで高度に保存されており、遺伝子が正しく機能する上で最も重要な反応の一つと見なされています。一方、イントロン配列の変異やスプライシング因子の変異が原因によるスプライシングの異常は、がんや精神・神経疾患の原因となることから、スプライシングを標的とする遺伝子治療が注目されています。
吉田稔グループリーダーらは2007年に、スプライシング調節作用を持つ抗がん活性物質の一つである「スプライソスタチンA(Spliceostatin A:SSA)」を世界に先駆けて発見しました注1)。SSAは、スプライシング因子U2と呼ばれる低分子核内リボヌクレオタンパク質のサブユニットSF3bに特異的に結合し、スプライシング反応を阻害します。SSAをはじめとするSF3bを標的とするスプライシング調節化合物のなかには、骨髄異形成症候群や急性骨髄性白血病の治療薬としての可能性を持つものがあり、臨床試験が行われています。しかし、スプライシング調節化合物が持つスプライシング調節活性と抗がん活性との関係はまだ完全には解明されていません。
注1)Kaida D et al., Spliceostatin A targets SF3b and inhibits both splicing and nuclear retention of pre-mRNA.Nat Chem Biol 3, 576-583 (2007)
研究手法と成果
スプライシングが阻害されるとイントロンを含んだ異常なmRNA前駆体が蓄積しますが、これらの大部分は核内にとどまり、分解機構によって取り除かれると考えられています。ところが芳本玲特別研究員らは、SSAが核・細胞質のRNAに与える影響を調べる目的でトランスクリプトーム解析(RNA-Seq[6])を行ったところ、異常なmRNA前駆体の一部が分解機構をすり抜けて、細胞質に移行することを見いだしていました注2)。しかし、mRNA以外の非コードRNAについては調べられていませんでした。
そこで共同研究グループは、核内長鎖非コードRNA(lncRNA)の解析を行ったところ、その一つである「MALAT1」の著しい減少が見られました。MALAT1は予後の悪い非小細胞肺がんをはじめとする多くのがんにおいて発現上昇が見られるlncRNAであり、がんとの関係が示唆されています。
通常のmRNA前駆体はイントロンが取り除かれて成熟すると、不要な末端が切断され、そこにアデノシン(A)が複数連続したポリA配列が付加されます。しかし、スプライシングが完了する前に切断とポリA付加が起きることがあり、これを「未成熟切断およびポリA付加(PCPA)」と呼びます。通常PCPAは、U1と呼ばれる低分子核内リボヌクレオタンパク質によって阻害されています(図2左)。MALAT1は、スプライシングもポリA付加を受けない長いRNA(約8kb)として存在しますが、SSAを添加するとPCPAが引き起こされ、短いMALAT1のアイソフォーム(約6kbのポリA付加を受けたRNA)を生じることが明らかになりました(図1)。
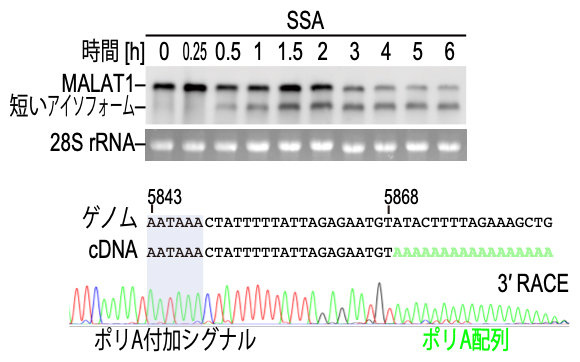
図1 MALAT1の未成熟切断およびポリA付加による短いアイソフォームの出現
上:スプライソスタチンA(SSA)処理細胞におけるMALAT1 RNAの経時変化。SSAの処理時間に応じて短いアイソフォームが出現する。
下:MALAT1の短いアイソフォームの末端配列を調べた。下流の末端にはゲノムには存在しないポリA配列(緑)が含まれることから、上流にあるポリA付加シグナル(AAUAAA)が認識され、未成熟切断およびポリA付加(PCPA)が起こっていることが分かった。
次に、SSAがPCPAを引き起こすメカニズムについて詳細に調べました。その結果、(1)SSAはU2内のSF3bに結合することで機能不全U2を生じること、(2)機能不全U2がmRNA前駆体-U1-U2複合体を安定化することでスプライシング因子のリサイクルを阻害すること、(3)リサイクル阻害により核内の利用可能なU1の濃度が不足し、PCPAを抑え切れなくなってMALAT1は切断され、ポリA付加が引き起こされることが分かりました(図2右)。
最後に、MALAT1以外にSSAによってPCPAが誘発されるRNA種を網羅的に探索しました。その結果、mRNAの一部において、主に第一イントロン中の潜在的ポリA付加部位でのPCPAが起こり、第一エキソンとイントロンからなる短いRNAが生じて細胞質へと輸送されていることが分かりました(図2右)。さらに、それらがタンパク質に翻訳されるかどうかをリボソームプロファイリング法[7]によって網羅的に解析したところ、この短いRNAの翻訳が見られたことから、SSA処理した細胞の中では、イントロン由来の配列を持った新奇タンパク質が生じていることが分かりました(図2右)。
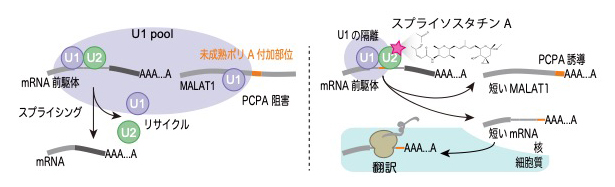
図2 通常のスプライシング(左)とスプライソスタチンAによるPCPA誘導(右)
左:通常、mRNA前駆体はイントロンが取り除かれて成熟すると、不要な末端が切断され、そこにポリAが付加される。未成熟切断およびポリA付加(PCPA)は、スプライング因子U1によって阻害されている。MALAT1は、スプライシングもポリA付加も受けない長鎖非コードRNAとして核内に存在する。
右:スプライソスタチンA(SSA)を添加すると、スプライシング因子のU2に結合し(赤星印)、U2が機能不全となる。すると機能不全U2がmRNA前駆体-U1-U2複合体を安定化し、U1とU2のリサイクルが阻害される。これにより、核内の利用可能なU1の濃度が不足し、PCPAを抑え切れなくなってMALAT1は切断され、ポリA付加される。これとは別に、核内では短いRNAが生じ、それが細胞質へ移行して、新奇タンパク質が合成されることも分かった。
注2)Yoshimoto R et al., Global analysis of pre-mRNA subcellular localization following splicing inhibition by spliceostatin A. RNA 23, 45-57 (2017)
今後の期待
SSAによって生じるMALAT1の短いアイソフォームやイントロンの翻訳によって生じる新奇タンパク質は、これまでその存在が知られていなかったことから、がん細胞に対してどのように働くのかはまだ分かっていません。抗がん作用を持った新しいタンパク質が生産されたり、免疫の攻撃を受けやすくするタンパク質ができたりするなど、さまざまな可能性が考えられ、今後の研究が待たれます。
また、多くの動物種においてMALAT1のポリA部位が保存されていますが、その意味は分かっていません。MALAT1のポリA部位には、まだ知られていない重要な機能があるのかもしれず、その解明も望まれます。
補足説明
1.スプライシング
遺伝子発現のためには、最初に遺伝子がタンパク質翻訳の鋳型であるmRNAへと転写される。転写直後のmRNAは前駆体の状態にある。真核生物の場合、多くの遺伝子はエクソンとイントロンと呼ばれる2種類の領域を含んでいるが、このうちイントロンはタンパク質配列を指定しない領域で、最終的にはmRNAから取り除かれる必要がある。このイントロン除去過程をスプライシングと呼ぶ。スプライシングは核内で起こり、イントロンが除去された成熟mRNAは核外へ運ばれ、タンパク質に翻訳される。
2.非コードRNA
ゲノムから転写されるRNAには、タンパク質合成の鋳型となるmRNAに対して、そのような鋳型となる領域を含まないRNAがあり、これを非コード(ノンコーディング)RNAと呼ぶ。
3.トランスクリプトーム解析
トランスクリプトームとは、対象とした細胞・器官などに存在している全ての遺伝子転写産物の集合・総体を意味する。トランスクリプトーム解析は、生体内における遺伝子の発現状況を網羅的に調べることを主な目的としている。
4.長鎖非コードRNA
非コードRNAの中でも特に長いものを総称したもの。短い非コードRNAに対して機能不明なものが多い。
5.イントロン
mRNA前駆体に存在するタンパク質に翻訳されない領域。スプライシングの結果、イントロン配列は、それぞれ投げ縄構造を形成し、mRNA前駆体から除去される。
6.RNA-Seq
いわゆる「次世代シークエンサー」による実験によって取得された、RNAの配列断片データ。これをもとに、遺伝子などの転写産物の発現量や配列、スプライスバリアントなどが解析できる。
7.リボソームプロファイリング法
組織からリボソームを抽出し、リボソームと結合しているRNA配列を同定することにより、どの遺伝子がどの程度の効率で翻訳されているかを知る解析法。リボソームは大きな複合体であるため、一定のmRNA領域を覆うように結合する。これらのリボソームとmRNAの複合体に対してRNA分解酵素で処理すれば、リボソームが保護するmRNA断片だけが分解されず回収できる。
共同研究グループ
理化学研究所
環境資源科学研究センター ケミカルゲノミクス研究グループ
特別研究員(研究当時) 芳本 玲(よしもと れい)
(現摂南大学 農学部 講師)
特別研究員 チピ・シュレスタ・ジャガット(Jagat K. Chhipi-Shrestha)
研究員 ティルマン・シュナイダー・ポッチュ(Tilman Schneider-Poetsch)
グループディレクター 吉田 稔(よしだ みのる)
開拓研究本部 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(いわさき しんたろう)
生命医科学研究センター 細胞機能変換技術研究チーム
チームリーダー 鈴木 治和(すずき はるかず)
上級研究員(研究当時) 古野 正朗(ふるの まさあき)
北海道大学大学 薬学研究院
教授 中川 真一(なかがわ しんいち)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(S)「革新的化学遺伝学による内在性代謝物の新機能の解明と応用(研究代表者:吉田稔)」、新学術領域研究(研究領域提案型)「ケモテクノロジーが拓くユビキチンニューフロンティア(領域代表者:佐伯泰)」などの支援を受けて行われました。
原論文情報
Rei Yoshimoto, Jagat K. Chhipi-Shrestha, Tilman Schneider-Poetsch, Masaaki Furuno, A. Maxwell Burroughs, Shohei Noma, Harukazu Suzuki, Yoshihide Hayashizaki, Akila Mayeda, Shinichi Nakagawa, Daisuke Kaida, Shintaro Iwasaki, and Minoru Yoshida, “Spliceostatin A interaction with SF3B1 limits U1 snRNP availability and causes premature cleavage and polyadenylation”, Cell Chemical Biology, 10.1016/j.chembiol.2021.03.002
発表者
理化学研究所
環境資源科学研究センター ケミカルゲノミクス研究グループ
特別研究員(研究当時) 芳本 玲(よしもと れい)
(現 摂南大学 農学部 講師)
特別研究員 チピ・シュレスタ・ジャガット(Jagat K. Chhipi-Shrestha)
研究員 ティルマン・シュナイダー・ポッチュ(Tilman Schneider-Poetsch)
グループディレクター 吉田 稔(よしだ みのる)
開拓研究本部 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(いわさき しんたろう)
生命医科学研究センター 細胞機能変換技術研究チーム
チームリーダー 鈴木 治和(すずき はるかず)
上級研究員(研究当時) 古野 正朗(ふるの まさあき)
報道担当
理化学研究所 広報室 報道担当