2021-12-01 京都大学iPS細胞研究所
ポイント
- 女性のX連鎖性鉄芽球性貧血(XLSA)注1)の患者さんからiPS細胞を樹立、病態モデルを作製した。
- アザシチジン(AZA)は女性XLSAの新規治療薬となる可能性が示唆された。
1. 要旨
森本 有紀 研究員、蝶名林 和久 助教(京都大学大学院医学研究科血液・腫瘍内科学、CiRA 増殖分化機構研究部門)、高折 晃史 教授(京都大学大学院医学研究科血液・腫瘍内科学)および吉田 善紀 准教授(CiRA 増殖分化機構研究部門)らの研究グループは、X連鎖性鉄芽球性貧血(XLSA)の患者さんから作製したiPS細胞により、XLSAにおける赤芽球注2)成熟障害を再現し、病態モデルを作製しました。さらにこのモデルを用いて、アザシチジン(AZA)が女性のXLSA患者さんから作製した細胞の赤血球生成を改善し、治療薬となり得ることを示しました。
XLSAは赤血球型5-アミノレブリン酸合成酵素(ALAS2)遺伝子の変異が原因で発症し、およそ半数にあたる患者さんに対しては、効果的な治療法がありません。女性のXLSAは重度の貧血が成人中期以降に発症することが多く見られます。これはALAS2遺伝子がX染色体上にあり、女性では2本あるX染色体の不活性化に偏りが生じ、正常なALAS2遺伝子よりも、変異したALAS2遺伝子が活性化された細胞が多くなることが原因です。
研究グループはALAS2の変異によりXLSAを発症した3名の女性の末梢血単核細胞から、iPS細胞を誘導し、変異したALAS2遺伝子が不活性化された野生型iPS細胞(WT-iPS細胞)、正常なALAS2遺伝子が不活性化された変異型iPS細胞(MT-iPS細胞)をそれぞれ作製することに成功しました。MT-iPS細胞は赤血球へと分化する能力が乏しく、ほとんどが未熟な赤芽球の形態となり、一部では鉄沈着が見られ、XLSAの病態を再現していました。
このMT-iPS細胞から誘導した造血前駆細胞にAZAを投与すると、不活性化されていた正常なALAS2遺伝子が再活性化され、赤血球への分化能力が改善されました。これにより、AZAが女性XLSAの新規治療薬となる可能性が示唆されました。
この研究成果は2021年11月15日に「Blood Advances」で公開されました。
2. 研究の背景
私達の体の中では、赤血球の中にあるヘモグロビンが酸素と結合をすることで、体中の隅々まで酸素を行き渡らせることができています。ヘモグロビンには鉄が含まれていますが、何らかの理由で鉄を使ってうまくヘモグロビンが作れなくなると、赤血球のもととなる赤芽球に鉄が沈着してしまい、鉄芽球と呼ばれる状態になります。
先天的な遺伝子の変異によりこうした鉄芽球が出来てしまい、酸素がうまく運べなくなる、貧血状態になる病気が遺伝性鉄芽球性貧血です。最も頻度が高いものがX連鎖性鉄芽球性貧血(XLSA)で、X染色体上にあるALAS2遺伝子の変異により発症します。XLSAは男性の方に多くみられ、無症状や軽度の貧血症状のみであることが多いですが、4分の1程度の患者さんは女性であり、男性の場合とは異なり、成人中期から後期にかけて、しばしば重篤な貧血症状で発症します。女性の場合はX染色体が2本あるため、細胞ごとにランダムにどちらかのX染色体が不活性化されています。通常は、一方のALAS2遺伝子に変異があっても、もう一方の正常な遺伝子が働く細胞が多く存在するので貧血にはならないのですが、加齢などによりX染色体の不活性化に偏りが生じ、変異のある遺伝子が働く細胞の割合が多くなると、重篤な貧血症状を来します。
治療法の一つとして、ピリドキシンの大量投与がありますが、約半数の患者さんには効果がないことが分かっています。現在までの所、他に有効な治療薬はなく、新たな治療法が求められています。
これまでに、男性型のXLSAを再現した細胞や動物のモデルは開発されていました。しかし、女性型のXLSAを再現したモデルは作られていませんでした。そこで、研究グループでは、女性型のXLSA患者さんからiPS細胞を作製し、赤芽球へと分化させることで、病態モデルの構築を試みました。
3. 研究結果
XLSA女性患者から2種類のiPS細胞の作成
3人の患者さんの末梢血単核細胞(PBMC)注3)からiPS細胞を作製しました。ALAS2遺伝子はX染色体上に存在するため、女性の患者さんでは2つのALAS2遺伝子のうち1つがランダムに不活性化されています。そこで、ALAS2が変異したX染色体が不活性化された野生型iPS細胞(WT-iPS細胞)と、ALAS2が正常なX染色体が不活性化された変異型iPS細胞(MT-iPS細胞)を同じ患者さんから作製しました(Fig. 1)。
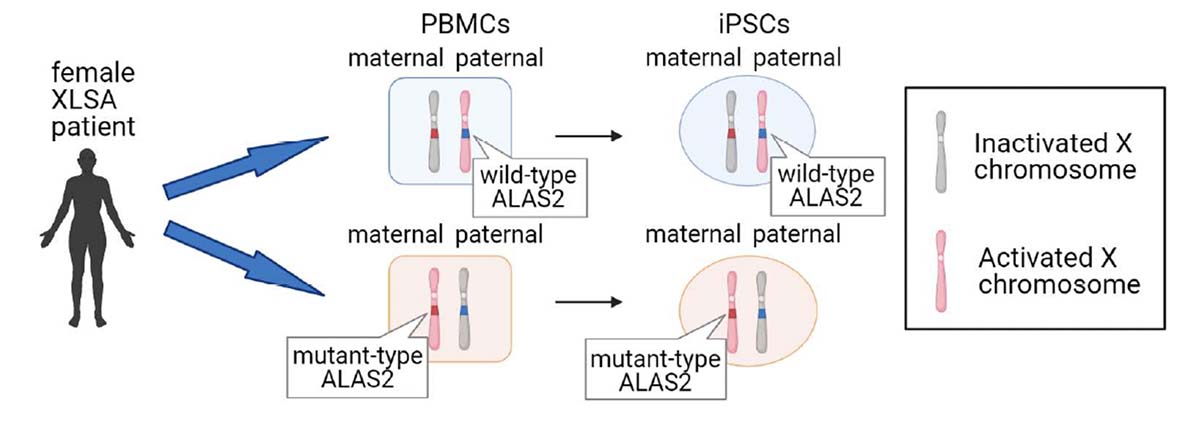
Fig. 1 XLSA女性患者さんから2種類のiPS細胞を作製する流れ
XLSA患者さんではMT細胞の割合が多い
3人の患者さんから採取したPBMCについて、WT細胞とMT細胞の割合をHUMARAアッセイ注4)を用いて調べると、50%ずつではなくMT細胞の方が多く、偏りが生じていることが分かりました。また、3人の患者さんからそれぞれ、58株、94株、47株のiPS細胞株を樹立し、WTとMTの割合を調べると、いずれも大半がMT細胞であり、患者さんのPBMCと同様に偏りがあることが分かりました(Fig. 2)。
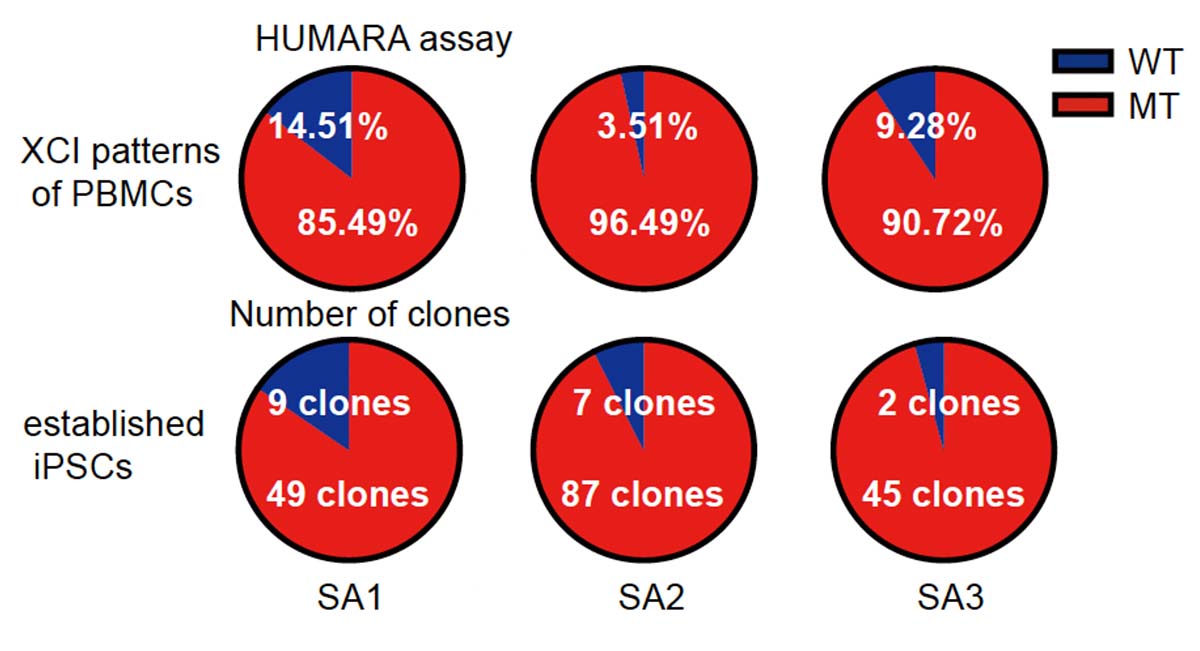
Fig. 2 PBMCと樹立したiPS細胞の中でのWT細胞とMT細胞の割合
MT-iPS細胞では赤血球へうまく分化しない
WT-、MT-iPS細胞それぞれを赤芽球へと分化させました。WT細胞由来の赤芽球のペレットは、正常な赤色でしたが、MT細胞由来の赤芽球のペレットは白色でした(Fig. 3 左)。また、鉄染色を行ったところ、MT赤芽球ではXLSAで見られる特徴の一つである環状鉄芽球(矢印で示した部分)が確認されましたが、WT赤芽球では確認されませんでした(Fig. 3 右)。
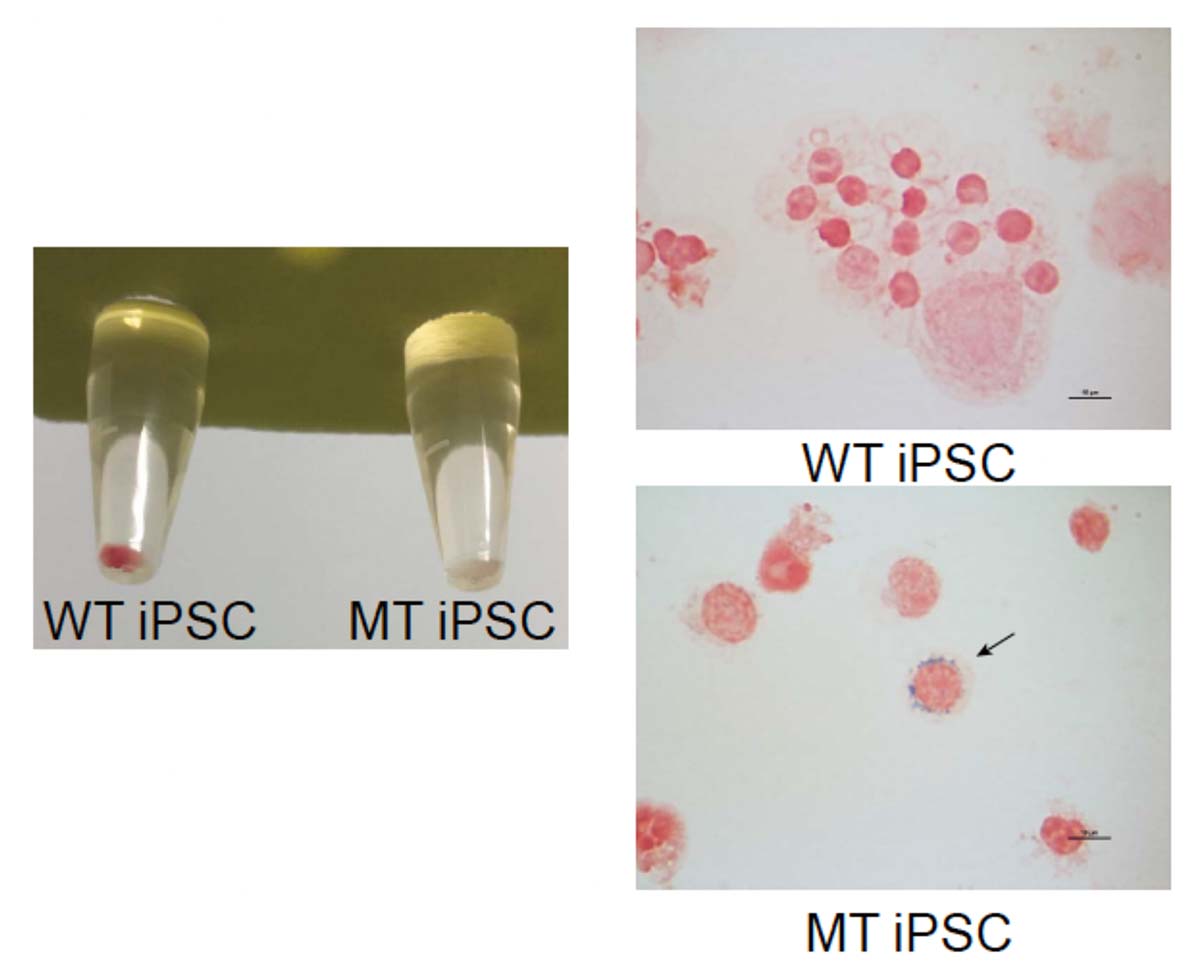
Fig. 3 赤芽球のペレット(左)と鉄染色(右)
アザシチジン投与によりMT細胞の赤血球分化能が改善する
研究グループは、MT細胞で不活性化されている正常なALAS2遺伝子を、薬剤で活性化することで赤芽球成熟障害が改善されるのではないかと考え、X染色体の不活性化を解除できるDNA脱メチル化剤であるアザシチジン(AZA)に注目しました。iPS細胞由来造血前駆細胞から赤芽球へと分化させる過程でAZAを投与したところ、AZAを投与していないMT細胞(DMSO)のペレットは白色でしたが、AZAを投与したMT細胞(AZA)のペレットは赤色でした(Fig. 4)。このことから、AZA処理により、赤血球生成不全が改善することがわかりました。

Fig. 4 MT-iPS細胞から作製した赤芽球のペレット
4. まとめ
本研究では、女性のXLSA患者さんから野生型と変異型のiPS細胞株を樹立しました。このiPS細胞を用いて、変異型の細胞では、女性のXLSAに類似した赤芽球の成熟障害を引き起こすことを示しました。さらに、脱メチル化剤であるAZAが、不活性化されていた正常なALAS2遺伝子を再活性化することで、女性XLSAで見られる赤血球生成不全などを改善することを明らかにしました。AZAは一部のがん患者さんを対象に治療法の一つとして使用されており、DNA脱メチル化剤は女性XLSA患者の新たな治療法として有望であると考えられます。
5. 論文名と著者
- 論文名
Azacitidine is a potential therapeutic drug for pyridoxine-refractory female X-linked sideroblastic anemia - ジャーナル名
Blood Advances - 著者
Yuki Morimoto1,2, Kazuhisa Chonabayashi1,2*, Hiroshi Kawabata2,4, Chikako Okubo1, Makiko Yamasaki-Morita3, Misato Nishikawa1, Megumi Narita1, Azusa Inagaki1, Kayoko Nakanishi3, Miki Nagao3, Akifumi Takaori-Kondo2, and Yoshinori Yoshida1* - 著者の所属機関
- 京都大学iPS細胞研究所
- 京都大学大学院医学研究科血液・腫瘍内科学
- 京都大学医学部附属病院検査部
- 国立病院機構 京都医療センター 血液内科・稀少血液疾患科
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- AMED再生医療実現拠点ネットワークプログラム
- AMED次世代がん医療創生研究事業(P-CREATE)
- 公益財団法人持田記念医学薬学振興財団
- 公益財団法人安田記念医学財団
- 公益財団法人小林がん学術振興会
- 公益財団法人第一三共生命科学研究振興財団
- Leducq Foundation
- iPS細胞研究基金
7. 用語説明
注1)X連鎖性鉄芽球性貧血(XLSA)
先天的な遺伝子の変異により赤血球のもととなる細胞に鉄が沈着した鉄芽球ができ、貧血状態になる病気が遺伝性鉄芽球性貧血。その中でも最も頻度が高いものがX連鎖性鉄芽球性貧血(XLSA:X‒linked sideroblastic anemia)で、X染色体上にある遺伝子(ALAS2:erythroid-specific 5-aminolevulininate synthase2)の変異により発症します。
注2)赤芽球
赤血球へと分化する過程の途中の段階にある細胞。骨髄中に存在する。
注3)末梢血単核細胞(PBMC: Peripheral Blood Mononuclear Cells)
体を循環している血液(末梢血)から分離される、核を1つ持った細胞のあつまり。単球やT細胞、 B細胞、NK細胞などのリンパ球が含まれる。
注4)HUMARAアッセイ
X染色体上に存在するHUMARA(human androgen receptor)と呼ばれる遺伝子のメチル化状態をもとに、X染色体の不活性化・活性化状態を判定できる。