2018-05-31 滋賀医科大学,京都大学,慶應義塾大学,日本医療研究開発機構
ポイント
- 筋萎縮性側索硬化症の異常凝集体を除去する治療抗体の開発に成功しました。
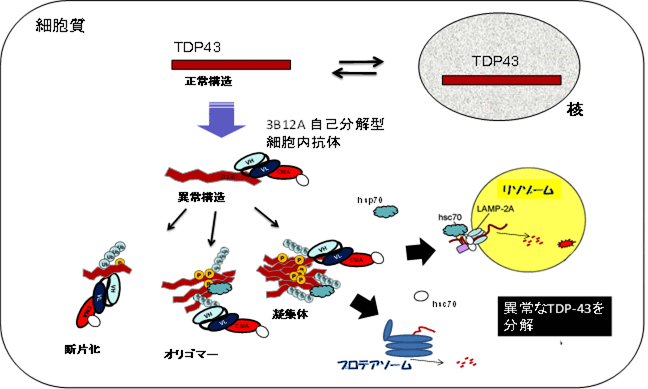
- 自己分解型細胞内抗体は、細胞内でALSの治療抗体を作らせるシステムで、発症に関わるTDP-43の異常構造のみと結合して分解を進めますが、正常に働いているTDP-43とは反応しません。
- 自己分解型細胞内抗体はプロテアソームとオートファジーという2大分解経路での分解を促す2つのシグナルを有しており、細胞内で作られた後、速やかに分解されます。
- 自己分解型細胞内抗体は培養細胞におけるTDP-43の異常凝集体を減少させ、細胞死を著明に抑制しました。
- 自己分解型細胞内抗体は胎児マウス脳においてもTDP-43の異常凝集体を著明に減少させ、さらに脳内で細胞内抗体を作らせた胎仔マウスは正常に出産、発育をしました。
要旨
滋賀医科大学内科学講座神経内科 漆谷真教授、玉木良高 特別研究学生(現 病院助教)らの研究グループは、京都大学大学院医学研究科神経内科 高橋良輔教授、慶應義塾大学理工学部 古川良明准教授との共同研究により、筋萎縮性側索硬化症(ALS)の原因蛋白質であるTDP-43注1の異常凝集体注2を除去する新たな治療抗体の開発に成功しました。ALSは全身の筋肉が萎縮し力が入らなくなくなる重篤な神経難病で、進行とともに全身の運動ニューロンが消失します。進行を遅らせる治療の開発は徐々に進んでいるものの、根治的な治療法はまだありません。長らく原因は不明でしたが、本来細胞の核内に存在するTDP-43というRNA結合蛋白質が、ALS患者の運動ニューロンの核から消失し細胞質で異常な凝集体を形成していること、さらにこの凝集体によって神経細胞死に至る様々な有害事象が起こることが判明し、TDP-43の異常な凝集体を除去することがALSの根治治療に直結するという可能性が注目されています。
漆谷教授らは2012年、異常構造をとったTDP-43のみを認識し正常な核内のTDP-43には結合しない、モノクローナル抗体3B12Aを滋賀医科大学にて開発しました。本研究では、この抗体を細胞内の異常蛋白質を除去する遺伝子治療薬とするため、3B12A抗体分子の中で抗原と結合する重鎖、軽鎖由来の可変領域遺伝子をクローニングし、2つを繋いで一本鎖抗体(single chain variable fragments; scFv)注3を作り出す人工遺伝子を作製、さらに凝集体をオートファジーで効率よく分解するため、シャペロン介在性オートファジー(CMA)シグナルというタンパク質分解シグナル遺伝子をscFvに付与し、自己分解型細胞内抗体を発現するベクター遺伝子(3B12A scFv-CMA)を作製しました。その結果、自己分解型細胞内抗体は培養細胞で異常なTDP-43のみと結合し、凝集体を減少させ、さらに凝集体によって生じる細胞死を著明に抑制しました。興味深いことに3B12A scFv-CMAと異常凝集体との結合によってheat shock protein 70(HSP70)という分子シャペロン注9が誘導され、TDP-43の異常凝集体を解きほぐすことで減少させる(リフォールド)効果も認めました。3B12A scFv-CMAの凝集体減少効果は培養細胞のみならず、子宮内電気穿孔法注10という手法を用いて遺伝子を導入した胎児マウス脳においても、TDP-43凝集体の著明な抑制効果を認め、脳の発育に明らかな有害事象を認めませんでした。この自己分解型細胞内抗体は、結合する凝集体が存在しない細胞では速やかに分解されてしまうため抗体蓄積による有害事象の懸念も少なく、分子標的治療として極めて有望です。今後ALSにおける運動ニューロンへのTDP-43異常凝集体を再現するALSモデルマウスでの効果確認や、サルなどの霊長類での安全性確認実験が必要ですが、オートファジーとプロテアソーム注4という2つの分解系での自己分解能を付与した抗体を使って細胞内の凝集体を除去するというユニークなアプローチで難病ALSの根治治療の道を開く成果です。
この研究成果は 2018年4月16日10時(英国時間:日本時間4月16日18時)に英国科学誌「Scientific Reports」でオンライン公開されました。
1.背景
筋萎縮性側索硬化症(ALS)は脳が意図する筋肉の運動を司る「運動ニューロン」が脳と脊髄で徐々に死滅することで、全身の筋力が低下し、筋萎縮が進行する神経難病です。呼吸に必要な神経も障害されるため、発症から3~5年で自ら呼吸することが困難になり、人工呼吸器による補助が必要となります。長らく原因が不明でしたが、遺伝性ALSにおいて原因遺伝子が次々と発見され、遺伝しない孤発性ALSではTAR DNA-binding protein 43 kDa(TDP-43)という、本来細胞の核の中に存在するRNA結合蛋白質が、核外の細胞質に異常な局在をし、凝集体を形成する原因物質であることが発見されました。さらにTDP-43が細胞質で異常な凝集体を形成することで、①核内TDP-43が喪失して機能低下を来したり、②蛋白質の分解を障害したり、③細胞の生存にとって必須の蛋白質を合成するためのRNAへの作用が障害される、など様々な有害事象が生じることが明らかとなり、このTDP-43凝集体を除去することはALSの根本的な治療になりうると注目されています。しかし治療上の大きな問題点として、細胞生存にとって重要である、正常なTDP-43への影響を避けること、そして細胞内のTDP-43の異常構造をできるだけ初期に捉えて除去することが困難であるという2点がありました。
2.研究手法・成果
蛋白質の正常・異常の間のわずかな構造変化を見分ける物質として抗体は非常に有望です。我々は以前、正常な核内のTDP-43には結合せず、異常構造をとったTDP-43のみを認識するモノクローナル抗体3B12Aの開発に成功しました。TDP-43の異常な凝集体はリン酸化をうけるため、リン酸化TDP-43に対する抗体を用いれば、正常なTDP-43との区別は可能ですが、TDP-43のリン酸化は比較的の構造変化と考えられるため、治療標的としては遅きに失する可能性があります。
また、抗体分子は非常に大きいため、そのまま血中や髄液など細胞の外から加えても神経細胞内に効率よく取り込まれることは期待できません。また凝集体との結合が得られても、その後凝集体が除去されることを意味するわけではありません。
研究手法
我々は、以前に滋賀医科大学で作製したモノクローナル抗体3B12Aを産生するハイブリドーマ細胞から抗原と結合する2つの可変領域と言われる構造(VH,VL)の遺伝子を取り出し(クローニング)し、VHとVLを連結した一本鎖抗体(single chain variable fragments; scFv)の人工遺伝子を作製しました。遺伝子配列の解析からVHの中に細胞内のタンパク質分解の場であるプロテアソームへの移行を促す信号(PEST)配列注4が含まれていることが分かりました。さらに凝集体をオートファジー注7での分解を促すため、シャペロン介在性オートファジー(CMA)シグナルという分解シグナルをもつscFv遺伝子をデザインし、細胞の中で自己分解型細胞内抗体を発現するベクター遺伝子(3B12A scFv-CMA)を作製しました。ヒト不死化培養細胞やマウスの神経系培養細胞に正常なTDP-43や、さらにマウスの胎仔脳においてALS凝集体モデルを遺伝導入によって発現させた様々なALSモデルに対し、3B12A scFv-CMAの同時発現による凝集体の除去効果、細胞死抑制効果、脳初期発生に及ぼす影響について検討しました。
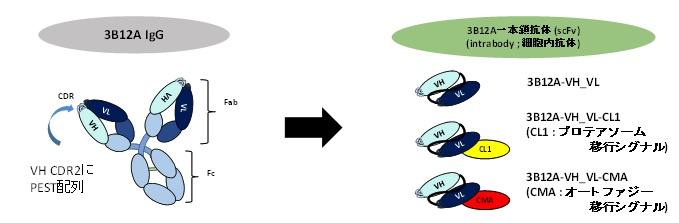
図1 3B12A 全長抗体(IgG)から一本鎖抗体の合成を説明した図
抗体には抗原と結合する可変領域と呼ばれる構造があり、長い重鎖由来のVHと短い軽鎖由来のVLがあります。3B12Aを産生する細胞(ハイブリドーマ)のメッセンジャーRNAからVHとVLをコードする遺伝子を同定しVHとVLを連結して一本鎖抗体(scFv)を作製しました。VH内の抗原結合部位の一つであるCDR2はプロテアソーム移行シグナルPEST配列を有していました。さらにscFvの自己分解性を高めるために、プロテアソーム移行シグナル(CL1)とシャペロン介在性オートファジーでの分解シグナルCMAを連結したscFvも合成しました。
成果
1.3B12A scFv-CMAは病原構造特異的にTDP-43と結合した
ヒト腎臓細胞由来のHEK293A細胞にTDP-43(野生型、細胞質型、凝集体形成型)と3B12A scFvを過剰発現させ蛍光二重免疫染色を行いました。3B12A cFvは細胞質型、凝集体形成型のみと共染色され野生型TDP-43とは共染色されませんでした(図2)。免疫沈降法注5-ウェスタンブロッティング法でも3B12Aは、野生型TDP-43とは共沈降されず、異常TDP-43のみと共沈降された。さらにサンドイッチELISA法注6による定量評価では、3B12Aは細胞質型、凝集体形成型に加え家族生ALSの原因遺伝子として同定されている変異型TDP-43に対しても野生型に比べ高い反応性を示しました。
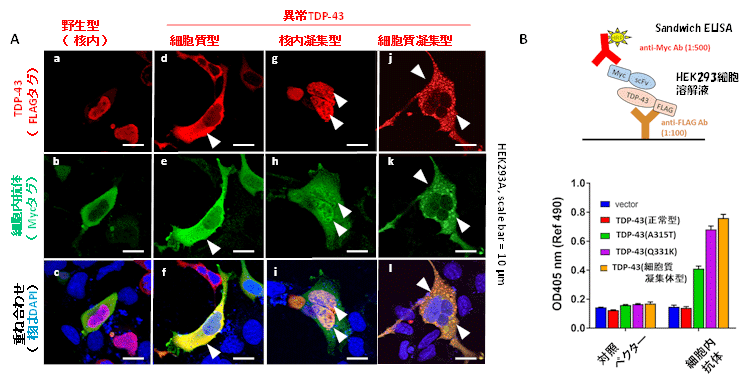
図2 A. HEK293A細胞にTDP-43(正常型)と3つの異常型(朱:細胞質型、核内凝集型、細胞質凝集型FLAGタグで標識)と3B12A scFv細胞内抗体(緑:Mycタグで標識)を遺伝子導入によって同時に発現させました。48時間後に細胞を固定し、FLAG抗体とMyc抗体を用いて免疫染色し、顕微鏡で観察しました。緑色で染まる細胞内抗体は、細胞質型、凝集体型のみTDP-43の信号と一致しています。B.サンドイッチELISA法によるTDP-43とscFvの結合性の定量解析。細胞内抗体が異常なTDP-43のみと高い吸光度(OD405nm)を認めます。
2.3B12A scFv-CMAはプロテアソームとオートファジーの両者で分解された
3B12AはPEST配列を有するため、培養細胞に遺伝子導入して後10時間後に著明に減少したが、プロテアソーム阻害薬によって分解が抑制されました。さらにCMAシグナルを付加することによって、プロテアソームのみならずオートファジー分解阻害薬による分解阻害を受けたことからプロテアーム注4とオートファジー注7の両者での分解を促進する細胞内抗体であることを確認しました。
3.3B12A scFv-CMA細胞内抗体は凝集体形成型TDP-43の分解を促進した
TDP-43蛋白質にHaloタグという標識を付加し、培養細胞に発現させました。Haloタグ注8を用いたパルスチェース法により、3B12A scFv-CMAは異所性局在型、凝集体形成型TDP-43のみ分解を促進し、野生型TDP-43には影響を与えませんでした(図3)。この分解促進効果はプロテアソーム阻害薬やオートファジー阻害薬によって抑制されました。
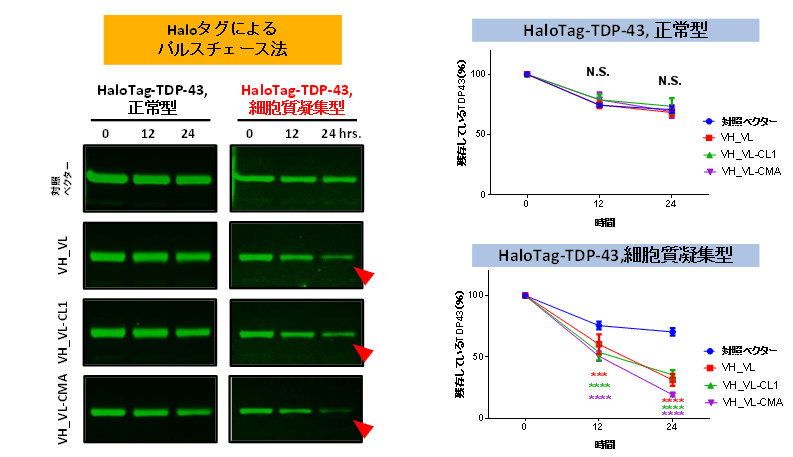
図3 3B12A scFvによるTDP-43の分解効効率に対する影響を調べたデータ
HEK293A細胞に、Haloタグを標識したTDP-43と3B12A scFvの同時に発現させ、蛍光リガンドであるdiAcFAMを培養培地に15分間投与した後、直後(0)12、24時間後に0時間後に比べ何%のTDP-43が残存しているかを示したデータ。3B12 scFvはいずれも対照ベクターに比べて細胞質凝集型TDP-43の分解を有意に促進していますが、その効果はCMAシグナル(VH_VL-CMA)において最も著明に見られます。
4.3B12Aは培養細胞においてTDP-43異常凝集体を減少させ細胞死を抑制した
HEK293AにGFPタグを標識した凝集体型TDP-43を発現させ、タイムラプス蛍光顕微鏡を用いて経時観察しました。凝集体形成TDP-43は時間と共に細胞内のTDP-43凝集体を有する細胞が増加、凝集体サイズも増大しましたが、3B12A scFv-CMAを同時発現させると凝集体形成が著明に抑制されました。さらにヘキスト33342という試薬で生細胞の核染色を行ったところ3B12A scFv-CMA群では残存細胞数の減少が著明に抑制されました(図4)。マウス神経の不死化細胞Neuro2A細胞にTDP-43(野生型、細胞質型、凝集体形成型)と3B12A scFv(分解シグナルなし、プロテアソーム移行シグナル(CL1)、オートファジー分解シグナル(CMA))を同時に発現させ、TDP-43の凝集体形成による細胞生存率の低下と毒性の増強効果が、さまざまな分解シグナルを持つ3B12Aの間で比べたところいずれも細胞の保護と細胞死抑制効果を認めましたが、CMAシグナルを付加したscFvが最も高い効果を示しました。
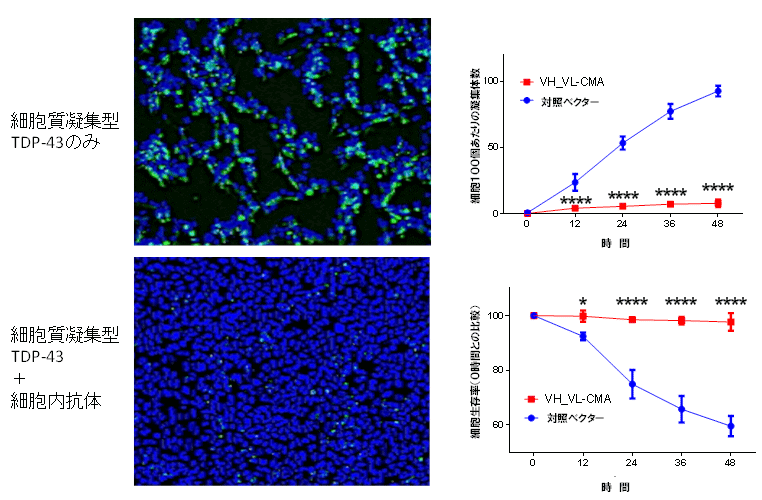
図4 TDP-43の細胞質凝集体毒性に対する3B12A scFv-CMAの効果
HEK293A細胞にGFPタグを付加したTDP-43と3B12AscFv-CMA(VH_VL-CMA)あるいは対照ベクターを同時発現させ、経時的な凝集体数と生存率を解析したデータです。凝集体は緑色に発色され、生存細胞は青色の色素(ヘキスト33342)として計測しました。細胞質凝集型TDP-43は経時的に細胞死を誘導し、凝集体数の増加を来しますが3B12A scFv-CMAの同時投与によって生存細胞数の増加と凝集体数の減少効果が認められます。
5.3B12A scFv-CMAはTDP-43凝集体との結合によってHSP70を誘導し凝集体減少効果が増大した
HEK293A細胞にTDP-43(野生型、細胞質型、凝集体型)と3B12A scFv(シグナルなし、CL1, CMAシグナル)を様々な組み合わせで同時に発現させ、分子シャペロン注9であるheat shock protein 70(HSP70)の蛋白質発現量をウェスタンブロッティング法、転写の誘導を定量的PCR法で検討したところ、CMAシグナルを有するscFvと凝集型TDP-43の組み合わせにおいてRNA、蛋白質両者が有意に誘導され、免疫蛍光観察と免疫沈降法によって、凝集体と細胞内抗体にHSP70が結合していることが確認されました。さらにHSP70を凝集型TDP-43と同時に発現させると界面活性剤を含む細胞抽出液(バッファー)に溶解せず沈殿する不溶性成分が減少することが示され、CMAシグナルを有する細胞内抗体が凝集体と結合すると分解が促進されると共に凝集体を解きほぐすことで構造を整える(リフォールド)する効果があることを確認しました(図5)。
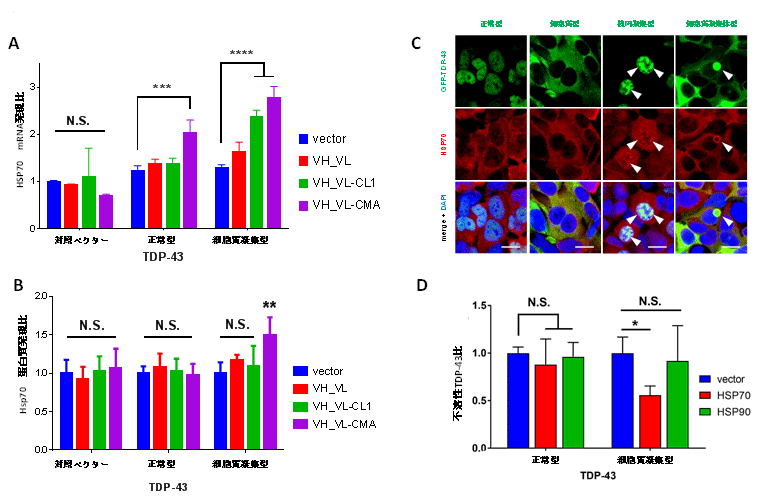
図5 3B12A scFv-CMAのHsp70の誘導効果
A,B;HEK293A細胞にTDP-43(正常型と細胞質凝集体形成型)とscFv(分解シグナルなし、CL1シグナル、CMAシグナル)を同時に発現させ、HSP70のmRNAレベルを定量的PCRで、蛋白質の発現をウェスタンブロッティングで調べたデータ。mRNAはTDP-43にscFv-CMAを同時に発現させた細胞で有意に上昇しますが、HSP70蛋白質は凝集型TDP-43とscFv-CMA(VH_VL-CMA)の同時発現時のみ有意に上昇しました。C. TDP-43凝集体と3B12A scFvにHSP70が共存していることを示す共焦点レーザー顕微鏡写真。D. HEK293A細胞にTDP-43(野生型と細胞質凝集型)とHSP70あるいはHSP90を同時に発現させ、界面活性剤不溶性の凝集型TDP-43のタンパク量に対する影響を示したデータ。HSP70の過剰発現によって不溶性のTDP-43が減少しています。
6.3B12A scFv-CMAはマウス胎仔脳におけるTDP-43異常凝集体を有意に減少させ、脳の初期発生に明らかな影響を与えなかった
培養細胞における自己分解型細胞内抗体の効果が確認できたため、次の個体脳における効果を確認した。妊娠13.5日目のマウスに吸入麻酔し子宮内胎仔脳の脳室にTDP-43と3B12A scFvの各発現ベクターを注入、子宮内電気穿孔法注10という方法を用いて遺伝子を胎仔脳に導入し再び妊娠を継続させました。妊娠16.5日目に胎仔マウス脳を固定し脳切片を顕微鏡観察したところ、大脳皮質から皮質下にTDP-43の凝集体が形成されましたが、3B12A scFv-CMAの同時投与によって凝集体数は有意に減少しました。野生型TDP-43は脳内で明らかな凝集体を形成せず、3B12A scFv-CMAの同時投与による変化は認めませんでした(図6)。細胞内抗体の脳発育に対する悪影響の有無を見るため、一部のマウスは出産後21日まで観察を続けましたが、正常に出産、発育し、21日目における脳組織の観察に於いて抗体が発現している部位に於いて明らかな神経細胞の減少やグリオーシスなどは認めませんでした。
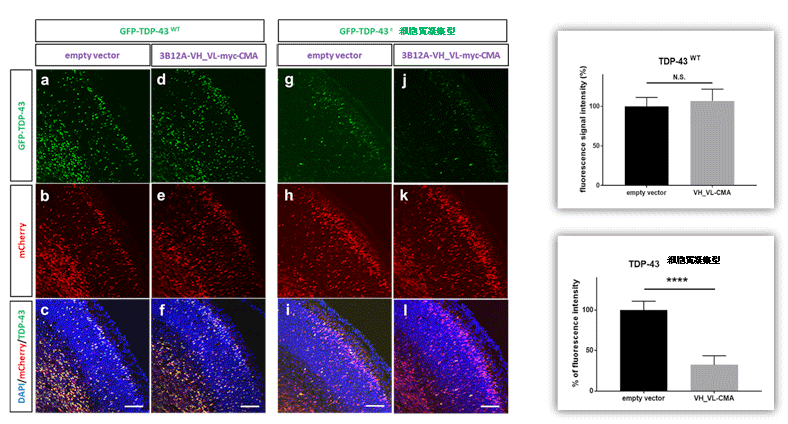
図6 マウス胎仔脳におけるTDP-43凝集体に対する3B12A scFv-CMA
子宮内電気穿孔法によって妊娠13.5日齢マウスの子宮内の胎仔脳に凝集型TDP-43と3b12A scFv-CMAあるいは対照ベクターを発現させ、scFvのTDP-43分解効果を検討したデータ。3B12A scFv-CMAの同時投与によってTDP-43の凝集体は有意に減少しました。遺伝子導入効率が均等であることは内部標準ベクターmCherry(赤)を同時に導入することで確認しています。
3.波及効果
本来生理的な役割を持つ蛋白質が、細胞内で異常な構造をとって疾患を引き起こす様々な疾患には、アルツハイマー病、パーキンソン病、多系統萎縮症など様々な神経難病があります。今回の研究成果はALSに対する新たな治療法の可能性を提唱するのみならず、そうした他の神経変性疾患にも応用できる可能性があります。今後はTDP-43の凝集体を発現するALSのモデル動物を用いて効果を確認し、さらに安全性についての確認することが必要です。
論文名と著者
- 論文名
- Elimination of TDP-43 inclusions linked to amyotrophic lateral sclerosis by a misfolding-specific intrabody with dual proteolytic signals
- ジャーナル名・巻・号・DOI
- Scientific Reports, 8:6030(doi: 10.1038/s41598-018-24463-3)
- 著者
- Yoshitaka Tamaki1,2, Akemi Shodai1, Toshifumi Morimura3, Ryota Hikiami1,2, Sumio Minamiyama1,2, Takashi Ayaki2, Ikuo Tooyama3, Yoshiaki Furukawa4, Ryosuke Takahashi2, Makoto Urushitani1,3
- 滋賀医科大学医学部内科学講座神経内科
- 京都大学大学院医学研究科臨床神経学
- 滋賀医科大学神経難病研究センター
- 慶應義塾大学理工学部
本研究への支援
本研究はAMED 難治性疾患実用化研究事業「筋萎縮性側索硬化症の病原タンパク質に対する自己分解型細胞内抗体の実用化に向けた前臨床研究」による支援を受けました。
用語解説
- 注1 TAR DNA-binding protein-43(TDP-43):
- ALSの脳脊髄病巣で蓄積することが知られていたユビキチン化された異常封入体の主要な構成蛋白質。RNA結合蛋白質であり、RNAの安定化、蛋白質の発現や細胞外のストレスに対する細胞内の適応に重要な役割を果たす。本来核内に存在するが、ALSでは異常なリン酸化と、切断を受けた短い断片が蓄積しており、現在ALSを引き起こす原因蛋白質の一つである。
- 注2 蛋白質凝集体:
- 蛋白質は一次構造であるアミノ酸配列により立体構造を形成して機能を果たす。蛋白質が正しい立体構造をとる過程は折りたたみ(フォールディング)と呼ばれ、何らかの理由で正しくフォールディングされなかった(ミスフォールディング)異常構造の蛋白質は通常ユビキチン・プロテアソーム系(後述)で分解される。分解されなかったミスフォールディング蛋白質は蓄積、凝集して毒性を示すと考えられており、異常な構造の蛋白質が原因となる一群の疾患は蛋白質ミスフォールディング病と呼ばれる。ALSをはじめ様々な神経変性疾患で認められる封入体形成蛋白質は異常構造を示しており、蛋白質ミスフォールディング病と考えられている。
- 注3 Single chain variable fragment(scFv):
- 抗原を認識する役割を担う抗体分子内の可変領域(variable fragment; Fv)を構成する必要最小単位である重鎖(heavy chain; VH)および軽鎖(light chain; VL)の両者を、可動性のあるペプチドリンカーで人工的に結合させた一本鎖抗体可変領域分子である。
- 注4 PEST配列:
- ユビキチンという小さな蛋白質を標識に用いて、標的となる蛋白質(基質)を特異的に分解する蛋白質分解機構。基質は特定のユビキチンリガーゼにより選択的にユビキチンで標識され、プロテアソームによって分解される。
- 注5 免疫沈降法:
- 可溶性の抗原をセファローズビーズやプロテインGなどの担体に結合させた抗体と特異的に反応させ、不溶化し沈殿させる反応を用いることで、目的の抗原を検出・分離する実験手法。沈殿物質を適当なバッファーで洗浄し、遠心分離をすることで非特異的に吸着する成分を取り除くことができる。この手法を用いることで、抗体の抗原となるタンパク質と複合体を形成するなど相互作用をきたす別のタンパク質との複合体を回収することが可能である。
- 注6 サンドイッチELISA法:
- 捕捉抗体と検出抗体の2種類の抗体を用いて試料をはさみこむことで目的の抗原を検出し、定量する実験手法。捕捉抗体の抗原となるタンパク質と複合体を形成する別のタンパク質を検出抗体で同定することで、異なるタンパク質同士の結合性を検証することができる。
- 注7 オートファジー:
- 主要な細胞内分解機構の一つであり、細胞質で不要となった成分をリソソームに輸送し分解する現象である。
- 注8 Haloタグを用いたパルスチェース法:
- Haloタグは外来性のTDP-43タンパク質に対する標識で、リガンドと呼ばれる低分子物質を一時的に共有結合させると、リガンドが結合したTDP-43の寿命(細胞内の残量)を追跡することが可能。
- 注9 Heat shock protein(HSP:熱ショックタンパク質):
- HSPは、熱などのストレスによって誘導されるタンパク質の総称で、細胞内でタンパク質の正常な折り畳み構造(フォールディング)を維持したり、ミスフォールドしたタンパク質の異常な折り畳み構造をときほぐして正常な構造に戻す働きをする。細胞内タンパク質の品質管理において重要な役割を担っている。分子量により、HSP70, HSP90などが存在する。
- 注10 子宮内電気穿孔法:
- マウスなどの子宮内胎仔に子宮外から胎仔脳室にDNAを注入したのち、子宮壁の外側から胎仔の頭部を電極で挟み込んで電気穿孔をすることで、胎生期マウスの神経幹細胞に目的遺伝子を導入する実験手法。マウスの成熟とともに遺伝子導入を行った神経幹細胞が神経細胞へと発達することで、導入した遺伝子の発現が生体における神経細胞において確認することができる。
お問い合わせ先
漆谷 真(うるしたに まこと)
滋賀医科大学医学部 内科学講座 神経内科教授
京都大学 総務部 広報課 国際広報室
古川 良明(ふるかわ よしあき)
慶應義塾大学理工学部化学科 准教授
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課