2022-03-02 東京大学,日本医療研究開発機構
発表者
河村 大輔 (東京大学大学院医学系研究科衛生学分野 助教)
石川 俊平 (東京大学大学院医学系研究科衛生学分野 教授)
発表のポイント
- 人工知能技術を用いてがんの病理組織画像の特徴を数値化することに成功しました。
- 病理組織画像の特徴の数値化により、類似症例の検索や定量的な病理組織学的分類、がん遺伝子変異予測など、病理組織像の定量的データとしての扱いが可能になりました。
- 技術を実装したウェブシステムとスマートフォンアプリケーション『Luigi』を開発しました。顕微鏡用デジカメシステム等の高価な機器を必要としないことにより、発展途上国等の医療機関を含め、広く病理診断(注1)の高度化・均てん化が期待されます。
発表概要
東京大学 大学院医学系研究科 衛生学分野の河村大輔 助教、石川俊平 教授らの研究グループは、人体病理学・病理診断学分野の牛久哲男 教授、深山正久 教授(研究当時)、消化管外科学の瀬戸泰之 教授、東京大学医学部附属病院 免疫細胞治療学講座の垣見和宏 特任教授、日本大学医学部外科学系消化器外科学分野 山下裕玄 教授らのグループと共同で、人工知能技術の一つである深層ニューラルネットワーク(注2)を用いて、がん病理組織画像の組織学的特徴を数値化する技術を開発しました。
通常、がんの診断は顕微鏡を用いて病理組織像を観察する病理診断により行われますが、基本的に個別の病理医の経験知に基づいています。組織像の客観的な記載や数値化は難しいため、多くの症例情報の集積、他の臨床データとの定量的な比較、類似症例の検索、といったデータとしての扱いが容易ではありませんでした。
本研究では、深層ニューラルネットワークを用いて組織画像からディープテクスチャ(注3)と呼ばれる情報を抽出したところ、がんの病理組織像の特徴を表現するのに適していることを見いだしました。それは例えれば、絵画における「画風」に相当する情報です。この技術を用いることで、病理組織像の特徴が定量的データとして扱えるようになり、組織学的特徴に基づくがんの再分類や、過去の症例からの類似画像の検索、一部のがんの遺伝子変異の予測を含む様々なアプリケーションに応用可能になり、がん研究や医療が促進されることが期待されます。
本研究成果は、3月1日に米科学誌「Cell Reports」にオンライン掲載されました。
発表内容
背景
がんなどの組織病理診断は、基本的に個別の病理医の経験知に基づいて行われています。顕微鏡で観察される組織学的形態は客観的な記載や数値化が難しく、通常の臨床データのように多数の症例の蓄積や他のデータとの比較が極めて困難でした。同様に病理医が遭遇した症例と類似した症例を見つけるための、検索エンジン等を用いた用語検索のような簡便な手段はありませんでした。
研究方法・成果
そこで、研究チームは近年画像認識の分野で優れた性能を発揮している深層学習技術を用いて、病理組織画像の特徴を捉える数値化技術の開発を行いました。がんは、単一の細胞を起源に持ち、同じ性質を持つ細胞が増殖する疾患です。そのため、がんの病理組織画像は明確な「かたち」を持つ犬や猫などの一般的な画像とは異なり、模様(テクスチャ)のようなものと考えられます。そこで、絵画の画像から描かれている「対象物」と「画風」とを分離するのに用いられる「バイリニア畳み込みニューラルネットワーク(注4)」という特殊な深層ニューラルネットワークを用いて病理組織画像をディープテクスチャ(図1)と呼ばれる1024次元の数値ベクトルに変換したところ、がんの組織学的特徴が極めてよく表現されることを見いだしました。使用するニューラルネットワークの構造やパラメータによってその性能が異なるため、数値と病理医の評価を比較して検証を行った結果、病理組織像の評価に最適なネットワークと層の組み合わせを見出しました。
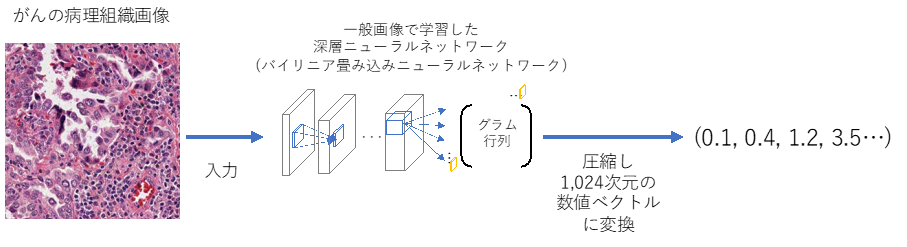 図1 ディープテクスチャによるがん病理組織画像の数値化
図1 ディープテクスチャによるがん病理組織画像の数値化
本技術の有用性は、臨床的に重要と考えられる以下の3通りのアプローチで検証されました。
- ①がん病理組織画像の組織学的特徴に基づく分類と可視化
- 本技術を用いると、がん病理組織画像を組織学的な類似性に基づくグルーピングや組織学的に近い症例が近くに配置されるような可視化が可能です。国際がんゲノムプロジェクト The Cancer Genome Atlas(TCGA)の32がん種7175症例の組織画像をその類似性に基づいて2次元に配置すると、類似した形態を持つがん種同士が近くに配置されることが確認されました(図2A)。また、まだサンプル数が少なく今後の検証は必要ですが、胃癌において免疫チェックポイント阻害薬の効果と関連するような、これまで知られていなかった組織学的特徴を発見しました。
- ②類似症例検索
- 本技術により数値ベクトル同士の距離を計算することで、過去の症例と組織学的に類似した症例を高速かつ正確に検索することが可能になりました(図2B)。病理医による評価との同等性も確認できました。
- ③がん遺伝子変異の予測
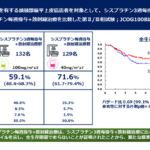
- 本技術と一般的な教師あり機械学習技術を組み合わせることで、病理組織画像のみから309種類のがんと遺伝子変異の組み合わせが一定の精度で予測できることが示されました(図2C)。
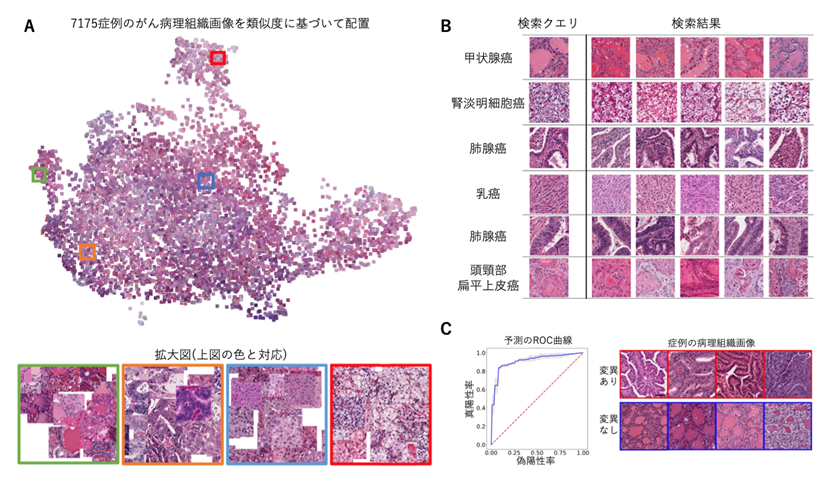 図2 A.32がん種7175症例の病理組織画像の可視化。病理組織画像のディープテクスチャが類似している症例を近くになるように配置している。拡大図:組織学的に類似した症例が近くに配置されている。B. 類似症例検索の一例。様々ながん種で類似した組織画像が検索できているC. ディープテクスチャに基づく甲状腺癌のBRAF変異の予測。AUC(注5)が0.91の精度で変異の有無を予測できている。
図2 A.32がん種7175症例の病理組織画像の可視化。病理組織画像のディープテクスチャが類似している症例を近くになるように配置している。拡大図:組織学的に類似した症例が近くに配置されている。B. 類似症例検索の一例。様々ながん種で類似した組織画像が検索できているC. ディープテクスチャに基づく甲状腺癌のBRAF変異の予測。AUC(注5)が0.91の精度で変異の有無を予測できている。
さらに、本技術を利用した類似症例の検索機能および遺伝子変異の推定機能はウェブシステム(Luigi: Large Scale HistoPathological Image Retrieval System )やiPhone/iPad向けアプリケーション(App Store:検索ワード「luigi pathology」)として誰でも利用できるよう公開しました(図3)。このツールは顕微鏡像をスマートフォン等で直接撮影するので、顕微鏡用デジカメシステム等の高価な機器を持たない中規模以下の医療機関や発展途上国の病院でも利用可能で、病理診断の高度化・均てん化を促進すると考えられます。
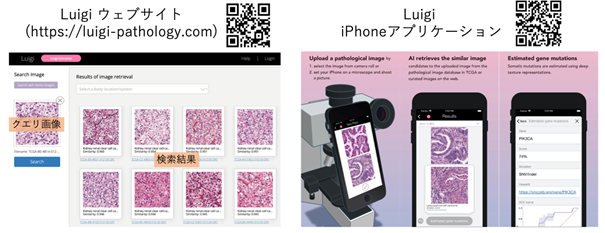
図3 LuigiのウェブサイトおよびiPhoneアプリケーション。
展望
本技術により、がんの病理組織画像を血液検査などの臨床データと同じように扱えるため、これまでにない大規模ながんの組織形態の解析が可能になると期待されます。
また、本研究で開発したウェブサービスやスマートフォンアプリケーションは、高度なゲノム解析技術へのアクセスや顕微鏡用デジカメシステム等の高価な機器を持たない多くの中規模以下の医療機関や発展途上国の病院でも利用可能であり、病理診断の高度化、均てん化を促進すると考えられます。
今後はさらなる精度の向上や類似症例検索のデータベースの拡充、医療機関での利用を想定した検証実験などを進めていく予定です。
研究費
本研究は、以下の事業の支援のもとで行われました。
- 日本医療研究開発機構(AMED)革新的がん医療実用化研究事業 領域1「がん病理組織情報の構造化によるがん精密医療の均てん化」JP 21ck0106640(研究開発代表者:石川俊平)
- 日本医療研究開発機構(AMED)次世代治療・診断実現のための創薬基盤技術開発事業 「がん免疫モニタリングによる患者層別化を行う基盤技術の開発」 JP21ae0101074(研究開発代表者:上田龍三)
- 日本学術振興会 科学研究費補助金 科学研究費助成事業 基盤B 「深層テクスチャを用いたがん病理組織像の大規模解析基盤の構築と検証」JP21H03836(研究代表者:河村大輔)
発表雑誌
- 雑誌名
- 「Cell Reports」(オンライン版:2022年3月1日)
- 論文タイトル
- Universal Encoding of Pan-cancer Histology by Deep Texture Representations
- 著者
- Daisuke Komura, Akihiro Kawabe, Keisuke Fukuta, Kyohei Sano, Toshikazu Umezaki, Hirotomo Koda, Ryohei Suzuki, Ken Tominaga, Mieko Ochi, Hiroki Konishi, Fumiya Masakado, Noriyuki Saito, Yasuyoshi Sato, Takumi Onoyama, Shu Nishida, Genta Furuya, Hiroto Katoh, Hiroharu Yamashita, Kazuhiro Kakimi, Yasuyuki Seto, Tetsuo Ushiku, Masashi Fukayama, Shumpei Ishikawa*
- DOI番号
- https://doi.org/10.1016/j.celrep.2022.110424
- アブストラクトURL
- https://www.cell.com/cell-reports/fulltext/S2211-1247(22)00148-6
用語解説
- (注1)病理診断
- 手術や生検などで採取した組織を薄く切り、染色した後に顕微鏡で観察し、細胞や組織の形態から病気を診断する行為。通常病理医が行い、これによってがんであるかどうかの診断が確定する。
- (注2)深層ニューラルネットワーク
- 人工知能技術の一つで、人間の神経回路を模した構造を持つ。
- (注3)ディープテクスチャ
- 画像から絵画における「画風」に相当する情報を抽出したもので、本研究では1枚の病理画像から1,024個の数値ベクトルが得られる。画像の中に描かれているものの相対的な位置関係が変わってもディープテクスチャはあまり変わらないという特徴がある。画像の認識に適した深層ニューラルネットワークである畳み込みニューラルネットワークの中間層の出力を用いて計算される。
- (注4)バイリニア畳み込みニューラルネットワーク
- 畳み込みニューラルネットワークを、画像の模様を表現するのに適したかたちに改良した技術。
- (注5)AUC(Area Under the ROC Curve)
- 検査の有用性を評価する際に用いる指標で、横軸に偽陽性率、縦軸に真陽性率をプロットしたROC(Receiver Operating Characteristic)曲線の下部の面積のこと。0から1までの値をとり、値が1に近いほどその検査法は有用であると言える。
お問い合わせ先
研究に関するお問い合わせ先
東京大学 大学院医学系研究科 衛生学分野
教授 石川 俊平 (いしかわ しゅんぺい)
AMED事業に関するお問い合わせ先
日本医療研究開発機構 (AMED)
疾患基礎研究事業部 疾患基礎研究課 革新的がん医療実用化研究事業