炎症抑制を介したがん耐性機構の一端を解明
2022-03-31 熊本大学,東京大学医科学研究所,広島大学,岩手医科大学,日本医療研究開発機構
ポイント
- がん化しにくい齧歯類ハダカデバネズミは、発がん性物質による強い発がん誘導を行っても全くがん化しないことを明らかにしました。
- ハダカデバネズミでは、発がん過程の促進に重要な役割を果たす炎症応答がマウスと比べ著しく減弱していることがわかりました。
- 炎症誘導性の細胞死“ネクロプトーシス※1”に重要な遺伝子が機能を失っていることが、炎症応答減弱・がん耐性の一因だと考えられます。
概要説明
熊本大学大学院先導機構/同大学院生命科学研究部老化・健康長寿学講座の岡香織学振特別研究員、藤岡周助大学院生(当時)、河村佳見助教、三浦恭子准教授らの研究グループは、熊本大学大学院生命科学研究部の菰原義弘教授、富澤一仁教授、押海裕之教授、同大学生命資源研究・支援センターの荒木喜美教授、東京大学医科学研究所先進病態モデル研究分野の山田泰広教授、京都大学iPS細胞研究所の山本拓也准教授、広島大学大学院統合生命科学研究科の坊農秀雅特任教授、岩手医科大学医歯薬総合研究所の清水厚志教授らと共同で、がん耐性齧歯類ハダカデバネズミの化学発がん物質への強い発がん耐性とその耐性機構の一端を明らかにしました。ハダカデバネズミは、最大寿命37年以上の最長寿齧歯類であり、その長い生涯のあいだ、がんを含む老化関連疾患が起こりにくいことが知られています。これまで、ハダカデバネズミの細胞レベルでのがん耐性機構は盛んに研究されてきましたが、ハダカデバネズミの生体レベルでのがん耐性機構はほとんど明らかになっていませんでした。今回、本研究グループは、ハダカデバネズミの生体を用いて、発がん剤投与による化学発がん誘導実験を実施することで、ハダカデバネズミが人為的な強い発がん誘導に対しても全くがん化しないことを示しました。さらに、ハダカデバネズミはマウスと比べて発がん促進に重要な炎症応答を起こしにくく、その一因として“ネクロプトーシス”と呼ばれる強い炎症を引き起こすタイプの細胞死に必須の遺伝子が、ハダカデバネズミでは機能を失っていることを明らかにしました。今後、ハダカデバネズミの生体におけるがん耐性機構をさらに研究することで、ヒトのがんを防ぐ新たな方法の開発に貢献することが期待されます。
本研究成果は、科学雑誌「Communications Biology」に2022年3月30日19時(日本時間)に掲載されました。本研究は、日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」、「再生医療実現拠点ネットワークプログラム(幹細胞・再生医学イノベーション創出プログラム)」、文部科学省科学研究費助成事業などの支援を受けて実施したものです。
説明
背景
ハダカデバネズミは、アフリカのサバンナの地下に生息する、マウスと同程度の大きさの齧歯類です(図1)。最大寿命37年以上の最長寿齧歯類であり、その生涯にわたって、がんをはじめとする老化関連疾患が起こりにくい顕著ながん・老化耐性を持つことが知られています。

図1 ハダカデバネズミ熊本大学大学院先導機構/同大学院生命科学研究部で飼育されているハダカデバネズミ。長寿命・がん耐性・老化耐性があることで知られている。
近年、ハダカデバネズミは医学生物学分野の新たなモデル動物として注目を集めています。しかしこれまでハダカデバネズミのがん耐性に関しては、観察研究における自然発がん例の少なさや、ハダカデバネズミの培養線維芽細胞を用いた解析しか行われておらず、ハダカデバネズミの生体が実際にどの程度強いがん耐性を持っているのか、また、生体が発がん刺激に対してどういった応答をするのかはほとんど明らかになっていませんでした。
生体におけるがんの発生は、がん細胞自身の性質だけでなく、その周囲の微小環境の変化によっても制御されます。そこで本研究では、ハダカデバネズミへ化学発がん誘導実験を行い、がんの発生頻度や発がん刺激に対する組織の応答を、がんになりやすいマウスと比較解析しました。
研究の内容
発がん剤である3-メチルコラントレン※2あるいはDMBA/TPA※3を用いた2種類の化学発がん誘導実験を行った結果、ハダカデバネズミは2年以上の長期にわたって1例もがん発生が見られず、化学発がんに対する強い耐性を持つことが明らかになりました(図2)。発がん剤の投与によって、ハダカデバネズミでもマウスと同様にDNA傷害や細胞死が生じていました。しかし、発がんの促進に重要な炎症応答は、ハダカデバネズミでは低く抑えられていることがわかりました(図3)。この特徴は、発がん剤だけでなく、皮膚がんの原因となる紫外線照射のような発がん刺激に対しても観察されました。
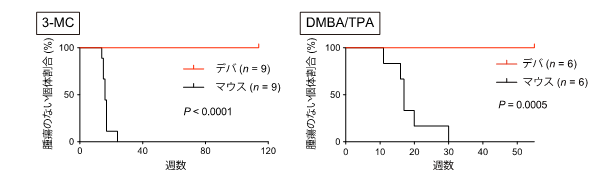
図2 3-メチルコラントレンあるいはDMBA/TPAを用いた発がん誘導実験ハダカデバネズミ(デバ)およびマウスに、3-メチルコラントレン(3-MC、左)あるいはDMBA/TPA(右)を用いた発がん実験を行った。マウスは24~30週以内に腫瘍ができるのに対し、デバは長期にわたって腫瘍が確認されない。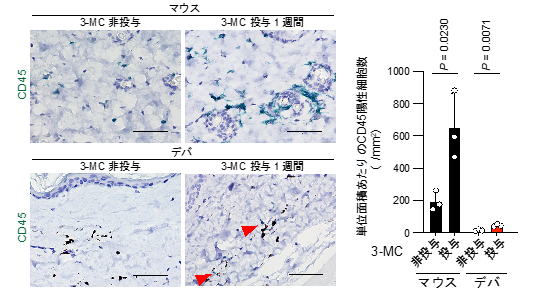
図3 3-メチルコラントレンを投与した皮膚における炎症応答の比較3-メチルコラントレン(3-MC)投与1週間後の皮膚をサンプリングし、炎症応答の指標として白血球マーカーであるCD45の免疫組織化学染色を行った(左、スケールバー:50 µm)。緑色はCD45陽性細胞、青色は細胞核を表す。ハダカデバネズミ(デバ)では、CD45陽性細胞(左、赤矢印)の数が3-メチルコラントレン投与後も著しく少ない(右)。
発がん誘導時の遺伝子発現を比較した結果、3-メチルコラントレンあるいは紫外線処置時に、マウスでのみ“ネクロプトーシス”と呼ばれる細胞壊死経路が活性化していました。ネクロプトーシスはプログラムされた細胞壊死で、細胞膜の破裂と細胞内容物の放出を伴うため、強い炎症応答を誘導します。ハダカデバネズミでは、この経路に必須であるRIPK3※4とMLKL※5という遺伝子がフレームシフト変異※6を起こしており、ネクロプトーシスを誘導する機能を失っていることがわかりました(図4)。
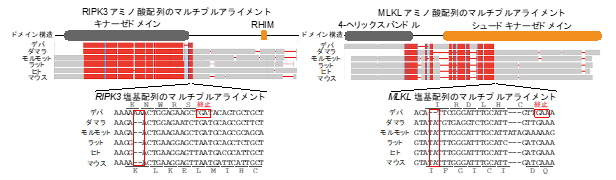
図4. ネクロプトーシスに必須のRIPK3とMLKL遺伝子の配列比較RIPK3(左)とMLKL(右)のアミノ酸配列および塩基配列の多種間比較(デバ:ハダカデバネズミ、ダマラ:ダマラランドデバネズミ、ハダカデバネズミの近縁種)。ハダカデバネズミのRIPK3とMLKLは2塩基の挿入あるいは欠失を持ち、早期に終止コドンが入ってしまうため、機能することが出来ない。塩基挿入・欠失および早期終止コドンの位置を赤枠で囲んでいる。
ネクロプトーシス能の喪失とがん耐性に関連があるかを確かめるため、マウスにおいて阻害剤投与あるいは遺伝子ノックアウトを行い、Ripk3の機能を阻害しました。その結果、Ripk3阻害マウスでは、3-メチルコラントレン投与時の炎症応答が弱まり、さらにがん発生も遅延することが明らかになりました(図5)。
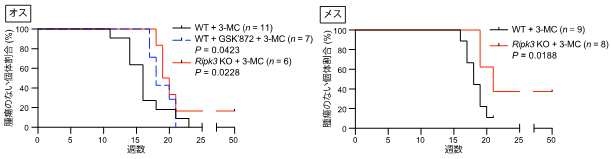
図5 Ripk3阻害マウスにおける発がんの遅延野生型マウス(WT、黒線)、Ripk3阻害剤投与マウス(WT+GSK’872、青点線)、Ripk3遺伝子ノックアウトマウス(Ripk3 KO、赤線)に3-メチルコラントレン(3-MC)を用いた発がん実験を行った。Ripk3の機能を阻害したマウスでは、通常のマウスと比べて、腫瘍形成が遅くなる。
成果
本研究により、ハダカデバネズミは自然発がんが起こりにくいのみならず、人為的な発がん誘導に対しても強いがん耐性を持つことがわかりました。さらに、ハダカデバネズミのがん耐性には発がん促進に重要な炎症応答が起こりにくいという特徴が関わっていること、その一因としてRIPK3とMLKL遺伝子の変異によるネクロプトーシス能の喪失が寄与していることが示唆されました(図6)。
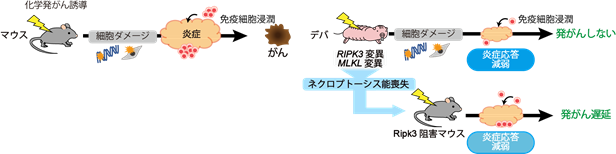
図6 今回の研究の概略発がん誘導によりハダカデバネズミ(デバ)でもマウスと同様に細胞へのダメージは生じるが、その後の炎症応答は抑制されており、発がんには至らない。この炎症応答の抑制・がん耐性の一端には、RIPK3, MLKL遺伝子の変異によるネクロプトーシス能の喪失が関わっていると考えられる。
展開
ハダカデバネズミのがん耐性メカニズムとして新たに、特有の組織応答が関与していることを発見しました。ハダカデバネズミのがん耐性の全容を理解するためには、これまで行われてきた細胞を用いた解析だけでなく、個体や組織を使った研究が重要です。今後ハダカデバネズミの組織応答や炎症応答の研究を進めることで、がん耐性機構が解明され、将来的にヒトに応用できるがん防止・抑制方法の開発につながることが期待されます。また、炎症応答やネクロプトーシスはがんだけでなく、さまざまな老化関連疾患に関わっています。本研究のさらなる進展により、ハダカデバネズミ、ひいてはヒトの老化耐性、長寿の解明にも貢献することが見込まれます。
用語解説
- ※1 ネクロプトーシス
- プログラムされた細胞死機構の1つ。さまざまなストレス刺激に応答してRIPK3およびMLKLが活性化され、細胞膜の破裂を伴う細胞壊死様の細胞死が起こる。
- ※2 3-メチルコラントレン
- 古典的に用いられる発がん物質。筋肉や皮下に投与することにより、マウス・ラット・モルモットなどで発がんを誘導することが知られている。
- ※3 DMBA/TPA
- 2段階皮膚腫瘍形成モデルに用いられる薬剤。皮膚に発がん物質であるDMBA(7,12-dimethylbenz[a]anthracene)を塗布後、炎症誘発物質であるTPA(12-O-tetradecanoylphorbol-13-acetate)を繰り返し塗布することで、腫瘍が形成される。
- ※4 RIPK3
- Receptor-interacting serine/threonine-protein kinase 3 (RIPK3)という酵素をコードする遺伝子。さまざまなストレス刺激に応答して活性化したRIPK3はMLKLをリン酸化し、ネクロプトーシスを誘導する。また、炎症性サイトカインの産生に関わることも知られている。
- ※5 MLKL
- mixed lineage kinase domain-like (MLKL)というタンパク質をコードする遺伝子。活性化したRIPK3によりリン酸化されたMLKLは、ホモオリゴマーを形成し、細胞膜を貫通する孔を作ることで、ネクロプトーシスを実行する。
- ※6 フレームシフト変異
- 遺伝子配列上で3の倍数ではない個数の塩基の挿入や欠失が生じる変異。遺伝子は3塩基ずつ読み取られるため、読み枠のずれにより終止コドンが現れるなどし、本来合成されるタンパク質は出来なくなってしまう。
論文情報
- 論文名
- Resistance to chemical carcinogenesis induction via a dampened inflammatory response in naked mole-rats
- 著者
- Kaori Oka1,2†, Shusuke Fujioka1,2†, Yoshimi Kawamura1,2†, Yoshihiro Komohara3, Takeshi Chujo4, Koki Sekiguchi1, Yuki Yamamura1, Yuki Oiwa1,2, Natsuko Omamiuda-Ishikawa1, Shohei Komaki5, Yoichi Sutoh5, Satoko Sakurai6, Kazuhito Tomizawa4,7, Hidemasa Bono8, Atsushi Shimizu5,9, Kimi Araki7,10, Takuya Yamamoto6,11,12,13, Yasuhiro Yamada13,14, Hiroyuki Oshiumi15, and Kyoko Miura1,2,7*
- 所属
- 1 Department of Aging and Longevity Research, Faculty of Life Sciences, Kumamoto University, Kumamoto 860-0811, Japan.
2 Biomedical Animal Research Laboratory, Institute for Genetic Medicine, Hokkaido University, Sapporo 060-0815, Japan.
3 Department of Cell Pathology, Faculty of Life Sciences, Kumamoto University, Kumamoto 860-8556, Japan.
4 Department of Molecular Physiology, Faculty of Life Sciences, Kumamoto University, Kumamoto 860-8556, Japan.
5 Division of Biomedical Information Analysis, Iwate Tohoku Medical Megabank Organization, Disaster Reconstruction Center, Iwate Medical University, Iwate 028-3694, Japan.
6 Department of Life Science Frontiers, Center for iPS Cell Research and Application (CiRA), Kyoto University, Kyoto 606-8507, Japan.
7 Center for Metabolic Regulation of Healthy Aging, Kumamoto University, Kumamoto 860-8556, Japan.
8 Program of Biomedical Science, Graduate School of Integrated Sciences for Life, Hiroshima University, Hiroshima 739-0046, Japan.
9 Division of Biomedical Information Analysis, Institute for Biomedical Sciences, Iwate Medical University, Iwate 028-3694, Japan.
10 Institute of Resource Development and Analysis, Kumamoto University, Kumamoto 860-0811, Japan.
11 Institute for the Advanced Study of Human Biology (WPI-ASHBi), Kyoto University, Kyoto 606-8501, Japan.
12 Medical-risk Avoidance based on iPS Cells Team, RIKEN Center for Advanced Intelligence Project (AIP), Kyoto 606-8507, Japan.
13 AMED-CREST, AMED, Tokyo 100-0004, Japan.
14 Division of Stem Cell Pathology, Center for Experimental Medicine and Systems Biology, Institute of Medical Science, The University of Tokyo, Tokyo 108-8639, Japan.
15 Department of Immunology, Faculty of Life Sciences, Kumamoto University, Kumamoto 860-8556, Japan.
†:共同第一著者、*:責任著者 - 掲載誌
- Communications Biology
- doi
- 10.1038/s42003-022-03241-y
- URL
- https://www.nature.com/articles/s42003-022-03241-y
お問い合わせ先
研究に関すること
熊本大学大学院先導機構/同大学院生命科学研究部 老化・健康長寿学講座
准教授 三浦恭子
報道に関すること
熊本大学 総務部 総務課 広報戦略室
東京大学医科学研究所 国際学術連携室(広報)
広島大学財務・総務室 広報部 広報グループ
岩手医科大学法人事務部 総務課 広報係
AMED事業に関すること
日本医療研究開発機構(AMED)
老化メカニズムの解明・制御プロジェクト
疾患基礎研究事業部 疾患基礎研究課
再生医療実現拠点ネットワークプログラム(幹細胞・再生医学イノベーション創出プログラム)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課