2022-04-21 生理学研究所,日本医療研究開発機構
パーキンソン病※1は手足のふるえ、強張り、動作困難などの症状を示す神経難病です。薬によって治療できますが、病気が進行すると薬による症状のコントロールが難しくなります。そのような患者さんに対して、脳の深部にある大脳基底核※2に電極を埋め込んで連続的に電気刺激を加える脳深部刺激療法(DBS)※3が行われています(2000年から健康保険適用)。しかし従来型のDBSは24時間同じ強度と頻度で刺激を行うため、刺激への慣れによる効果の減弱や、電池交換のため3~5年に一度の小手術による患者さんの負担などが問題になっていました。
今回、自然科学研究機構生理学研究所のオリビエ ダービン研究員・畑中伸彦助教・知見聡美助教・南部篤教授らの研究チームは、パーキンソン病モデルサルを用い、運動皮質から運動開始を指令する信号を記録し、それに基づきDBSの刺激方法をコントロールする新たな治療法を開発しました。この適応型DBSは、効率よくパーキンソン病症状を治療でき、また消費電力も少なくて済むことが明らかになりました。本研究成果はScientific Reports誌(2022年4月20日号)に掲載されました。
研究の背景
パーキンソン病は、脳の深部にある大脳基底核でドーパミンという物質を作る神経細胞が減少することによって起こる神経難病です。手足のふるえ、動かしにくさ、強張りなどを主な症状とし、最終的には寝たきりになります。患者数は60歳以上では100人に1人と、超高齢社会の日本では大きな問題となっています。病気の初期においては、不足しているドーパミンを薬で補う治療法が有効ですが、数年経過すると薬によるコントロールが難しくなります。このような進行期の患者さんに対しては、脳の深部にある大脳基底核のうち視床下核という部位に電極を挿入して連続的に電気刺激を加える脳深部刺激療法(DBS、deep brain stimulation)が有効で、日本でも2000年より健康保険が適用されるようになっています。しかし、従来型のDBSは24時間同じ強度と頻度で刺激を行うため、刺激への慣れによる効果の減弱や、比較的早い電池消費(3~5年ごとに、小手術によって交換する必要がある)などの問題があり、より良い刺激方法の開発が待たれていました。
今回の研究について
これまでの本チームの研究から、パーキンソン病では大脳皮質(運動皮質)から出された運動の指令が大脳基底核でブロックされるため、運動がおこりにくくなっていることや、視床下核の活動を人為的に操作しブロックを解除すると症状が回復することがわかっていました。そこで、運動皮質から運動指令の神経活動を記録し、それに基づいて視床下核のDBSの刺激強度や刺激頻度をコントロールすれば、効率よくパーキンソン病を治療できるのではないかと考えました。
本研究では、パーキンソン病モデルサルを用い運動皮質の神経活動に基づいたDBSの刺激を行いました。まず研究チームは、運動皮質から神経活動(皮質脳波)の記録を行い、どのような信号が運動に関連しているのか調べました。その結果、ガンマ2帯域と呼ばれる80-200 Hzの脳波が関連していることがわかりました。
次に、視床下核に刺激電極を挿入して電気刺激を行いました。その際、サルに目の前のLEDに向かって手を伸ばす運動をさせ、症状がどの程度改善するのか調べました。何も刺激を与えない状態では、ゆっくりとしか手をLEDに伸ばせませんでしたが、従来型の連続型DBS(図1左)を加えたところ、手をスムーズに伸ばせるようになりました。次に運動皮質のガンマ2帯域の脳波をもとにDBSの刺激パラメータ(強度と頻度)をコントロールするようにしたところ(適応型DBS、図1右)、従来型と同程度、場合によってはより早く手を伸ばせるようになり、治療効果があることがわかりました。また、従来型に比べて消費電力も約2/3に減少することもわかりました。
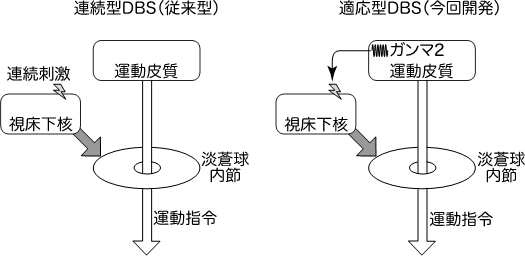
図1 従来の連続型DBSと今回開発した適応型DBSパーキンソン病では大脳皮質(運動皮質)から出された運動指令が大脳基底核の淡蒼球内節でブロックされるため、運動がおこりにくくなっています。従来の連続型DBS(左)では、視床下核に刺激電極を埋め込み24時間、連続して一定の刺激強度、頻度の電気刺激を与えます。これが淡蒼球内節でのブロックを解除することにより、治療効果を発揮すると考えられます。それに対し、今回開発した適応型DBS(右)では、運動皮質から運動開始に関連するガンマ2帯域(80-200 Hz)の神経活動を記録し、それに基づいて視床下核に対して刺激を加えることにより、運動指令が出される時にのみ、ブロックを解除することができます。
これらの結果から、今回新たに開発した、運動皮質の運動開始に関連する信号に基づきDBSの刺激パラメータをコントロールするという治療法がきわめて有効であることがわかりました。これは患者さんにも応用できる技術であり、パーキンソン病に対するDBSの改良につながることが期待されます。
助成金などの必要情報
本研究は文部科学省科学研究費補助金(新学術領域研究「オシロロジー」、基盤研究、国際共同研究加速基金)、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)」「戦略的国際脳科学研究推進プログラム(国際脳)」、自然科学研究機構産学連携支援事業の補助を受けて行われました。
今回の発見
- パーキンソン病モデルサルにおいて、運動皮質から運動開始に関連する神経活動を記録し、それに基づいてパラメータをコントロールする「適応型DBS」を開発し、効果的にパーキンソン病症状を改善することに成功しました。
- 適応型DBSの症状改善効果は、従来の連続型DBSと同程度か、より優れていることがわかりました。
- 適応型DBSは従来の連続型DBSに比べて消費電力が少ないことを示しました。
- 適応型DBSは患者さんの治療に応用可能な技術であり、パーキンソン病治療におけるDBSの改良につながると期待されます。
この研究の社会的意義
進行期のパーキンソン病患者に対して、脳の深部に刺激電極を挿入して24時間連続電気刺激を行う脳深部刺激療法(DBS)が行われ効果を上げています。今回、パーキンソン病モデルサルを用いて運動皮質の神経活動に基づいてDBSの刺激パラメータをコントロールすることにより、より効果的にパーキンソン病症状を治療する方法を開発しました。従来型とは異なり、運動皮質から神経活動を記録する必要があり、記録に基づいて刺激パラメータをコントロールする装置も必要になるなど課題はありますが、24時間連続刺激を行わずにすむため、刺激への慣れによる治療効果の減弱を防いだり、電池寿命が延長できる可能性があります。実際に患者さんに用いることができれば有効な治療法になると期待されます。
用語解説
- ※1 パーキンソン病
- 大脳基底核においてドーパミンという物質が不足することによって起こる神経難病である。手足のふるえ、動かしにくさ、強張りなどを主な症状とし、60歳以上では100人に1人と患者も多い。初期には不足しているドーパミンを薬で補う治療法が有効であるが、数年経過すると薬によるコントロールが難しくなる。進行期の患者に対して、脳の深部に電極を埋め込み24時間連続刺激を行う脳深部刺激療法が行われている(2000年から健康保険適用)。
- ※2 大脳基底核
- 大脳の深部に存在する一連の神経細胞群で、線条体(被殻と尾状核に分かれる)、淡蒼球(内節と外節に分かれる)、視床下核、黒質(網様部と緻密部に分かれる)などの脳部位からなる。運動をコントロールしており、その不調により、パーキンソン病、ジストニア、バリズムなどを来す。
- ※3 脳深部刺激療法(DBS)
- パーキンソン病などの運動異常症の患者に対して、脳の深部にある大脳基底核に刺激電極を埋め込み24時間連続的に電気刺激を加えることにより、症状を改善しようという脳外科的治療法である。ターゲットとなる脳部位は、視床下核、淡蒼球、視床などで、パーキンソン病以外にジストニア、本態性振戦などにも適用される。
論文情報
Subthalamic nucleus deep brain stimulation driven by primary motor cortex γ2 activity in parkinsonian monkeys
Olivier Darbin, Nobuhiko Hatanaka, Sayuki Takara, Nobuya Kaneko, Satomi Chiken, Dean Naritoku, Anthony Martino, Atsushi Nambu
Scientific Reports. 2022年 4月20日
https://doi.org/10.1038/s41598-022-10130-1
お問い合わせ先
研究に関すること
自然科学研究機構 生理学研究所
生体システム研究部門
教授 南部 篤(ナンブ アツシ)
助教 畑中 伸彦(ハタナカ ノブヒコ)
助教 知見 聡美(チケン サトミ)
広報に関すること
自然科学研究機構 生理学研究所 研究力強化戦略室
AMED事業に関すること
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
脳とこころの研究推進プログラム
(革新的技術による脳機能ネットワークの全容解明プロジェクト)