2022-06-29 慶應義塾大学医学部,日本医療研究開発機構
慶應義塾大学医学部内科学教室(消化器)の原田洋輔特任助教、内視鏡センターの筋野智久専任講師、内科学教室(消化器)の金井隆典教授らの研究グループは、小腸の上皮直下に存在する免疫細胞が腸内細菌によって形成される低酸素環境(注1)に適応することで誘導維持されることを発見しました。
ヒトをはじめとする哺乳類の消化管では、外界から来る食べ物や細菌に過度に反応することなく必要な栄養を取り込みながら、危険なものを判別・排除するといった高度な選択のバランスが保たれています。小腸では、胃から送られてくる物質の通り道との境界線に小腸上皮細胞が並んでつくる層があり、その細胞の隙間に挟まるようにしてさまざまな免疫細胞が存在することが知られています。とくに、小腸上皮間に多く存在するCD4+CD8aa+細胞(注2)は病原菌による腸炎の抑制に働くことが知られています。しかし、この細胞がどのような因子によって生まれ、維持されているのかについてはあまりよくわかっていませんでした。
今回、研究グループは腸内細菌によって形成される低酸素環境と、低酸素環境に適した特徴的な遺伝子を発現し調節することによって酸素需要の少ないCD4+CD8aa+細胞が小腸上皮領域で存在できることを発見しました。
近年では腸内環境の乱れがさまざまな疾患の発症と密接な関係にあることがわかってきているなかで、免疫細胞が巧みに低酸素環境下で適応する仕組みを有しており、ホメオスタシス(注3)の維持に貢献していることを見出しました。本研究の進展により、酸素化や低酸素における発現遺伝子を中心とした新しい治療開発につながることが期待されます。
本研究の成果は、2022年4月15日(米国時間)に国際学術誌である『iScience』に掲載されました。
研究の背景と概要
私たち哺乳類の腸は、常に体の外からやってくる食べ物や病原菌といった異物にさらされています。腸組織は皮膚や口腔内のように外界との境界にあたる組織で、栄養などの物質の取り込みとバリア機能を担う腸上皮細胞が層となって境界線を形成しています。その境界線に存在するさまざまな免疫細胞は、異物に対して排除する働き(免疫応答)あるいは過度に反応しないように抑える働き(免疫寛容)をすることでバランスを取っています。本研究で着目したCD4+CD8aa+細胞(DPIEL)は、腸の上皮層内に存在し、腸の炎症を抑制する役割を持つことが知られていましたが、発生と維持に必要な因子については不明でした。特に哺乳類の細胞が生存していくには酸素が必要ですが、腸管の中において酸素が少ない状態でどのように細胞が発生維持しているのかという観点での解析はありませんでした。
研究の成果と意義・今後の展開
まず研究グループは、通常の飼育環境(腸内細菌が存在する環境)と無菌環境(腸内細菌が存在しない環境)で飼育したマウスの小腸で組織の酸素濃度を比較しました。すると、腸内細菌が存在することで小腸の上皮層が低酸素状態となることを見出しました。さらに低酸素状態において、特に免疫抑制に働くDPIELが増加することがわかりました(図1)。
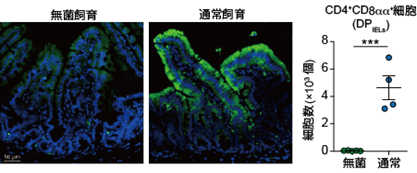
図1(左)小腸繊毛の組織観察画像。緑色で標識された低酸素領域が通常飼育マウスで見られるが、無菌飼育マウスでは見られない。
(右)小腸上皮のCD4+CD8aa+細胞の数の比較。腸内細菌の有無により大きな違いが見られる。
また、腸管上皮内で増加するDPIELは他の細胞種よりも酸素とグルコースを消費せず、特に酸素消費における重要な因子であるミトコンドリアの形状が大きく異なっていることがわかりました(図2)。以上より、腸管上皮内で増加するDPIELは腸内細菌により誘導される低酸素状態に適応する細胞集団であることがわかりました。
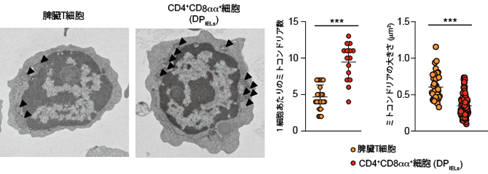
図2(左)脾臓、小腸上皮から単離した細胞(それぞれ脾臓T細胞(注4)、CD4+CD8aa+細胞(DPIEL))の電子顕微鏡観察画像。黒矢印はミトコンドリアを示す。
(右)脾臓T細胞と小腸上皮DPIELのミトコンドリアの数と大きさの比較。未熟である脾臓T細胞の場合に比べ、DPIELでは数が多く、サイズは小さいという特徴を持つ。
次に、低酸素状態であることによって働く因子とその調節に関わる因子を欠損したマウスを調べ、DPIELの発生・維持に必要な遺伝子群を突き止めました(図3)。興味深いことに、DPIELは腸管上皮内に到達し分化する前に一度低酸素応答性の遺伝子群を上昇させ、その後低下させることで分化するという複雑系が存在することを見出しました。
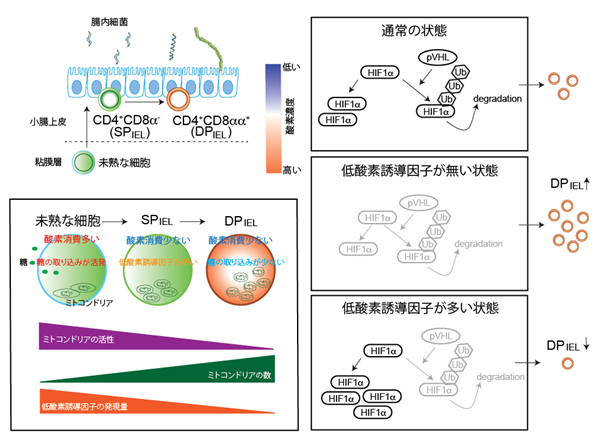
図3(左上)小腸組織の酸素濃度と免疫細胞の存在する場所の関係。
(左下)CD4+CD8aa+細胞とその他の免疫細胞との特徴の違い。
(右)低酸素誘導因子、代謝関連因子の量的コントロールによるCD4+CD8aa+細胞の増減の関係。
本研究を通して、腸内細菌の存在が小腸上皮内のDPIEL分化誘導、維持に好都合な低酸素環境を生み出していること、DPIELも他の免疫細胞とは異なる代謝調節により低酸素環境に適応していることが新たにわかりました。腸管上皮内にユニークに存在するDPIELの作用機序は未だ不明ですが、炎症を抑制することも報告されていることから、この成果は酸素化、低酸素応答を腸管内で制御することで特定の免疫細胞を教育、誘導するといった新しい治療法開発につながることが期待されます。
特記事項
本研究は日本医療研究開発機構(AMED)革新的先端研究開発支援事業ユニットタイプ 微生物叢と宿主の相互作用・共生の理解と、それに基づく疾患発症のメカニズム解明 研究開発領域における研究開発課題「腸内細菌-上皮細胞相互作用から読み解く疾患発症メカニズムの解明」、JSPS科研費19K17503・17K19668・17H05082・19K22624・20H03665・21K18272・19K08402・21H02905・21K07084、(公財)持田記念医学薬学振興財団、(公財)武田科学振興財団医学系研究助成、グラクソ・スミスクライン(株)GSKジャパン研究助成、ヤクルト・バイオサイエンス研究財団一般研究助成の支援によって行われました。
論文
- 英文タイトル
- Intracellular metabolic adaptation of intraepithelial CD4+CD8aa+ T lymphocytes
- タイトル和訳
- 腸管上皮CD4+CD8aa+ T細胞の細胞内代謝調節
- 著者名
- 原田洋輔、筋野智久、宮本健太郎、野村絵奈、吉松裕介、種本俊、梅田智子、大野恵子、三上洋平、中本伸宏、高林薫、細江直樹、緒方春彦、池ノ上恒夫、平尾淳、久保田義顕、金井隆典
- 掲載誌
- iScience
- DOI
- 10.1016/j.isci.2022.104021
用語解説
- (注1)低酸素環境
- 通常の大気中は約21%程度の酸素濃度であるが、生体内では平均5~7%であり、低酸素環境にある。
- (注2)CD4+CD8aa+細胞
- 小腸上皮内に多く見られる免疫細胞の一種。病原菌感染による腸の炎症を抑える働きを持つことがわかっている。
- (注3)ホメオスタシス
- 生物の体または生存のためのシステムが、体の内外の環境変化を受けながらも安定した状態に保つ働き。恒常性とも呼ばれる。
- (注4)脾臓T細胞
- 脾臓はリンパ節と同様に多くの免疫細胞で構成される免疫応答に重要な組織で、比較的未熟な細胞が多く存在する。そこから得られる未熟な脾臓T細胞はより高機能なT細胞との比較によく用いられる。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部 内科学教室(消化器)
特任講師 筋野 智久(すじの ともひさ)
本リリースの配信元
慶應義塾大学信濃町キャンパス総務課:山崎・飯塚・奈良
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)シーズ開発・研究基盤事業部革新的先端研究開発課