2022-07-11 量子科学技術研究開発機構
ポイント
- 慢性ストレスにより全身性エリテマトーデスにおける精神変容が引き起こされる分子機構を発見。
- 慢性ストレスで前頭皮質神経のミクログリアが活性化し、サイトカインを介した神経活性化を誘導。
- 中枢神経系におけるサイトカイン制御によって、精神神経ループスへの新規治療開発に期待。
概要
北海道大学遺伝子病制御研究所、量子科学技術研究開発機構量子生命科学研究所、自然科学研究機構生理学研究所の村上正晃教授らの研究グループは、同大学大学院医学研究院免疫・代謝内科学教室(渥美達也教授)と共同研究で、正常マウスでは、単独で病態を誘導しない睡眠不足による慢性ストレスが、全身性エリテマトーデス(SLE)*1モデルマウスにて、大脳特定神経核のミクログリア活性化を介した神経の異常活性化の影響で異常行動を伴う重症化を引き起こす分子機構を解明しました。
代表的な自己免疫疾患のSLEでは、気分障害などを示す精神神経ループス(NPSLE)と呼ばれる重症の病態があり、その発症の分子機構は不明でした。研究グループは、その病態への慢性ストレスの関与を疑い、SLEモデルマウスを用いて検証しました。
慢性ストレス導入は、正常マウスでは不安を増強しましたが、SLEモデルでは逆に不安を減少させ、NPSLE様の脱抑制様行動を誘導しました。また、内側前頭前皮質で異常に活性化したミクログリア*2からサイトカイン*3の一種であるインターロイキン(IL-)12/23p40が産生され、神経細胞も活性化しました。これらの変化は、IL-12/23p40中和抗体投与で抑制されました。また、健常者や軽症のSLE患者と比べて、NPSLE患者では、モデルマウスと同様に髄液IL-12/23p40濃度が高値であり、前頭前皮質の体積がより小さかったことから、ヒトにおいても同様の発症機構が関与している可能性が示唆されました。これらの結果から、SLEにおける前頭前皮質ミクログリアからの慢性ストレス誘導性のIL-12/23p40産生は、NPSLEの新たな治療標的となる可能性があります。
本研究は日本医療研究開発機構(AMED)ムーンショット型研究開発事業における課題名「病気につながる血管周囲の微小炎症を標的とする量子技術、ニューロモデュレーション医療による未病時治療法の開発」と光・量子飛躍フラッグシッププログラム(課題番号:JPMXS0120330644)の研究費を用いて実施されました。
なお、本研究成果は、日本時間2022年7月11日(月)午後11時公開の Annals of the Rhematic Diseases誌にオンライン掲載されました。
背景
SLEは代表的な自己免疫疾患であり、様々な臓器の障害を起こす疾患ですが、とりわけ精神神経症状は重症度が高く、なかでも気分障害、精神病、急性昏迷などのびまん性精神神経症状を示すNPSLEは、背景に血管障害や血液脳関門破綻、サイトカインや自己抗体の中枢神経浸潤、中枢神経細胞障害などが想定されていますが、その詳細な発症機序の分子機構は不明でした。
研究グループはこれまでに、重力、痛み、電気刺激、慢性ストレス、光などの環境刺激・人為的刺激が、特異的な神経回路を活性化し、特定の血管部位に炎症性疾患を誘導・制御する新たな神経系と免疫系の連関である「ゲートウェイ反射*4」を発見し、報告してきました。本研究では、睡眠不足を介する慢性ストレスがNPSLEの病態形成に関与するのではないかという仮説を立て、SLEのモデルマウスを用いて検証しました。
研究手法
本研究はマウスに2週間の睡眠不足を誘導する睡眠不足ケージを用いて、SLEモデルであるMRL/lprマウスに慢性的なストレス負荷をかけて実施しました。ここで用いた睡眠不足による慢性ストレスは比較的軽度なもので、正常なマウスでは健康障害を引き起こさないものです。MRL/lprマウスはアポトーシス誘導受容体であるFasをコードする遺伝子lprに変異をもち、自己反応性免疫細胞が増加することで、関節炎、腎炎、中枢神経障害などの全身性エリテマトーデス様症状を示します。6-8週齢では全身の炎症は乏しい中でも中枢神経障害は起きることが知られており、本週齢のマウスを実験に用いました。
MRL/lprマウスと対照マウス群に先の慢性ストレスを負荷し、行動試験や行動変化に関わる脳領域の神経活性化、ミクログリア活性化、その遺伝子発現や形態学的変化について評価しました。また、病態に関与している液性因子を同定し、その中和抗体や下流シグナル経路阻害薬を投与したときの行動試験、神経活性化・形態変化やミクログリア活性化について評価しました。
さらに、びまん性精神神経症状の有無で分けたSLE患者の髄液における同定された液性因子濃度の測定に加えて、脳MRIで関連する脳領域の体積を解析しました。
研究成果
慢性ストレスは通常マウスの不安を増強しますが、対照マウス群とは反対に、MRL/lprマウスでは不安はむしろ減少するという脱抑制様行動を示すようになりました(図1)。ストレスは脳領域の腹側被蓋野を活性化し、その神経投射先として内側前頭前皮質が知られており、慢性ストレスはその活性化は低下させるものの、MRL/lprマウスでは強い神経活性化を示しました。内側前頭前皮質の網羅的遺伝子発現解析により、ミクログリア活性化遺伝子の発現増加があり、髄液中において炎症性サイトカインであるIL-12/23p40の濃度上昇を認めました。また、ミクログリア活性化・IL-12/23p40産生亢進、神経樹状突起スパインの増加が認められました。このストレス誘導性の変化は、脳室内へのIL-12/23p40中和抗体投与、下流シグナル分子であるTyk2阻害薬の投与によりキャンセルされました。
さらに、NPSLE患者では、IL-12/23p40濃度は対照健常者やびまん性精神神経症状を示さないSLE患者と比べて高値であり、内側前頭前皮質の萎縮もより高度でした。
今後への期待
本研究の成果により、びまん性精神神経症状、とりわけ脱抑制様行動を示すNPSLE患者において、中枢神経症状に対する特異的治療としてIL-12/23シグナル経路を阻害する治療が有効であることが期待されます。
論文情報
論文名 Pathogenic neuropsychiatric effect of stress-induced microglial interleukin-12/23 axis in systemic lupus erythematosus(全身性エリテマトーデスにおけるストレス誘導性ミクログリア由来インターロイキン-12/23軸による病原性精神神経性効果)
著者名 阿部靖矢1、2、垂水政人1、2、藤枝雄一郎2、高橋伸彦1、狩野浩平2、内田萌菜1、河野通仁2、田中勇希1、3、長谷部理絵4、5、加藤 将2、Amengual Olga2、有沼良幸6、奥 健志6、佐藤和貴郎7、Khin Khin Tha8、9、山崎美和子10、渡辺雅彦10、渥美達也2、村上正晃1、3、5(1北海道大学遺伝子病制御研究所分子神経免疫学分野、2北海道大学大学院医学研究院免疫代謝内科学教室、3量子科学技術研究開発機構量子生命科学研究所量子免疫学研究チーム、4北海道大学遺伝子病制御研究所附属感染癌研究センター、5自然科学機構生理学研究所分子神経免疫研究部門、6北里大学医学部膠原病・感染内科、7国立精神・神経医療研究センター神経研究所免疫研究部、8北海道大学病院放射線診断科、9北海道大学大学院医学研究院医理工学グローバルセンター、10北海道大学大学院医学研究院解剖発生学教室)
雑誌名 Annals of the Rheumatic Diseases(イギリスの医学の専門誌)
DOI 10.1136/ard-2022-222566
公表日 日本時間2022年7月11日(月)午後11時(グリニッジ標準時2022年7月11日(月)午後2時)(オンライン公開)
参考図
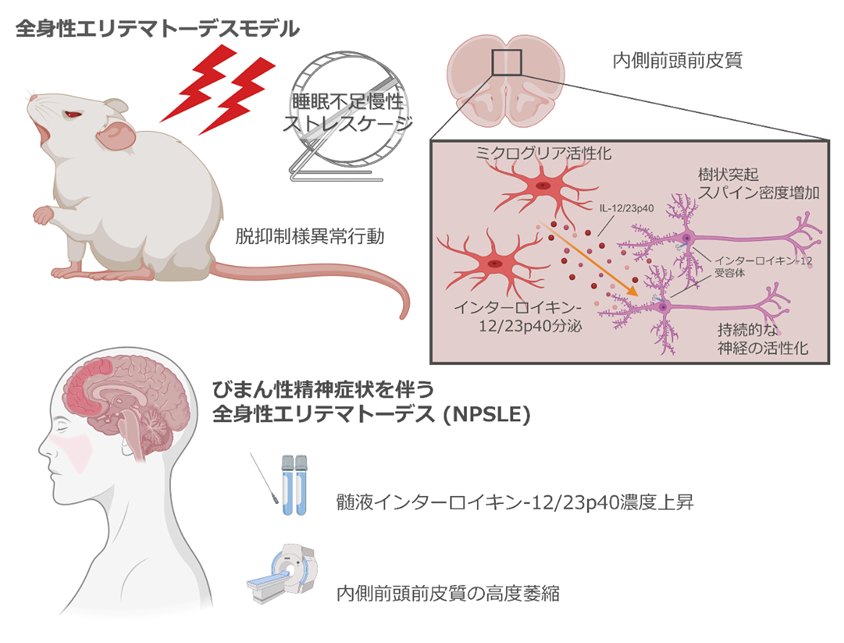
図1.慢性ストレスによる自己免疫疾患「全身性エリテマトーデス」の重症化の分子機構
SLEモデルマウスMRL/lprに慢性睡眠不足ストレスを負荷することで、不安の減少という脱抑制様行動異常や内側前頭前皮質のミクログリア活性化、インターロイキン(IL-12/23p40)増加、神経の活性化と活性化に重要な樹状突起スパイン増加が誘導された。類似した症状を示すびまん性精神症状を伴うNPSLE患者でも髄液IL-12/23p40増加や内側前頭前皮質萎縮があり、病態の相同性が推測された。
用語解説
*1 全身性エリテマトーデス(SLE)… 妊娠可能年齢の若年女性に好発する全身性炎症性自己免疫疾患であり、皮疹、関節炎、腎炎、血液障害や中枢神経症状などの多臓器病変を示す疾患。治療方法はグルココルチコイドや免疫抑制薬の投与が主体だが、最近になり、生物学的製剤や分子標的薬などのより特異的な病態生理を標的とした治療法が開発されている。
*2 ミクログリア … 中枢神経系に存在するグリア細胞の一種で5-20%を占める。貪食能があり、造血幹細胞から生じる単球、マクロファージ系の細胞である。活性化するとサイトカインなどを発現して炎症を加速する場合がある。
*3 サイトカイン … 細胞から分泌される低分子の生理活性タンパク質の総称。細胞間相互作用に関与し、細胞機能に様々な影響を与える。インターロイキン、インターフェロン、腫瘍壊死因子、造血因子、増殖因子などに分類される。
*4 ゲートウェイ反射 … 特定の環境刺激・人為的刺激により、特異的神経回路が活性化し、神経伝達物質であるノルアドレナリンが特定の⾎管部位に放出されることで、通常は免疫細胞が侵⼊できない中枢神経系(脳、脊髄)の⾎管に、血液中の免疫細胞の侵⼊⼝(血管ゲート)が形成される現象のこと。2012年に村上教授らの研究グループが世界で初めて発⾒した現象であり、これまでに重力、筋⾁への微弱な電気刺激、痛み刺激、慢性ストレス、光によるゲートウェイ反射を報告している(北海道大学村上正晃研究室ホームページ参照)。