軸索死を引き起こす重要な分子の働きを解明、新たな治療法につながる可能性 Research into how key molecule triggers axon death may lead to new therapies
2022-10-26 ワシントン大学セントルイス
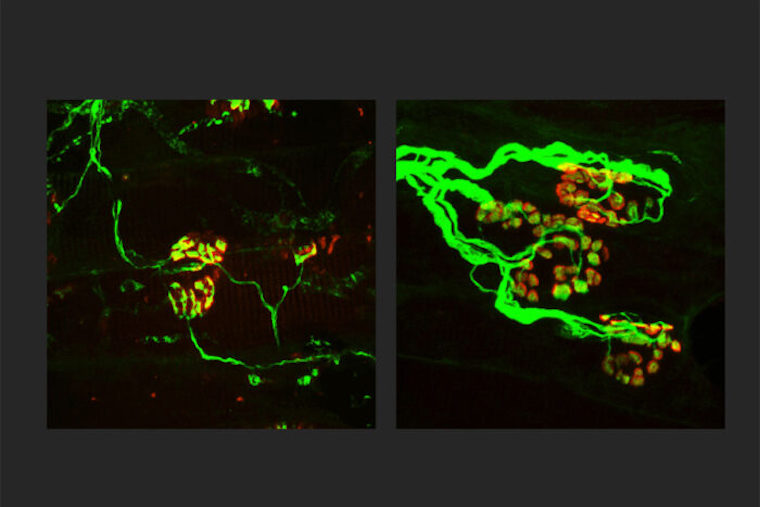
Researchers at Washington University School of Medicine in St. Louis are working toward a treatment for neurodegenerative diseases that targets SARM1, a key molecule in the death of axons, the wiring of the nervous system. Shown, the axons (green) are thinner in a rodent model of an inherited axonal peripheral neuropathy (left). When SARM1 is missing from rodents with the disorder, the axons are thicker (right) and indistinguishable from normal, healthy axons. Finding ways to block SARM1 could lead to new therapies for a broad range of neurodegenerative diseases.
SARM1の働きを阻害することで、末梢神経障害からパーキンソン病、緑内障から筋萎縮性側索硬化症(ALS)まで、多くの神経変性疾患に関与している軸索の喪失を防ぐことができるのです。
軸索喪失は、末梢神経障害からパーキンソン病、緑内障から筋萎縮性側索硬化症(ALS)まで、多くの神経変性疾患に関与していると考えられている。
患者のゲノムを解析したところ、軸索の喪失は、NMNAT2という遺伝子の遺伝子エラーによって引き起こされていることが判明した。この遺伝子エラーにより、SARM1が常に活性化され、軸索破壊の引き金となっているのだ。研究者らは、CRISPR遺伝子編集技術を用いて、これらの変異をマウスで再現した。これらのマウスは、同症候群の患者と同様に、成人まで生存したが、運動機能障害が悪化し、末梢軸索が失われ、さらに重要なことに、マクロファージという免疫細胞の浸潤が見られた。
研究チームは、マクロファージの数を減らすと、マウスの軸索の喪失と疾患症状が逆転することを発見した。
この研究は、SARM1が軸索の喪失に直接関与しているだけでなく、神経炎症を促進する役割を果たし、問題をさらに悪化させるだけであることを示唆している。また、この研究結果は、一部の神経変性疾患は、マクロファージやその他の炎症性免疫細胞をブロックする免疫調節薬で治療できる可能性を示唆している。
2番目の論文では、シャルコー・マリー・トゥース病2aにおけるSARM1の役割の可能性について検討した。
研究チームは、シャルコー・マリー・トゥース病2a型のげっ歯類モデルでSARM1を欠損させると、ミトコンドリアの異常とは無関係に、この動物が示す問題のほとんどが停止することを見出した。SARM1を除去すると、軸索死、筋萎縮、ミトコンドリア異常、神経筋接合部(神経細胞が筋肉と接する部分)の問題を阻止または遅らせることができた。変異型マイトフシン2タンパク質が存在しても、SARM1を除去することで、ミトコンドリアは、さらなる分解と機能不全から保護された。
SARM1を阻害すると、軸索を保護するだけでなく、より健康なミトコンドリアが得られる
<関連情報>
- https://source.wustl.edu/2022/10/new-strategy-shows-potential-to-block-nerve-loss-in-neurodegenerative-diseases/
- https://pubmed.ncbi.nlm.nih.gov/36287209/
- https://pubmed.ncbi.nlm.nih.gov/36287202/
マクロファージ枯渇による先天性SARM1依存性ニューロパチーの阻止 Macrophage depletion blocks congenital SARM1-dependent neuropathy
Caitlin B Dingwall, Amy Strickland, Sabrina W Yum, Aldrin Kay-Yuen Yim , Jian Zhu , Peter L Wang, Yurie Yamada, Robert E Schmidt, Yo Sasaki, A Joseph Bloom, Aaron DiAntonio, Jeffrey Milbrandt
Journal of Clinical Investigation Published:2022 Oct 26
DOI: 10.1172/JCI159800
Abstract
Axon loss contributes to many common neurodegenerative disorders. In healthy axons, the axon survival factor NMNAT2 inhibits SARM1, the central executioner of programmed axon degeneration. We identified two rare NMNAT2 missense variants in two brothers afflicted with a progressive neuropathy syndrome. The polymorphisms resulted in amino acid substitutions, V98M and R232Q, which reduced NMNAT2 NAD+-synthetase activity. We generated a mouse model of the human syndrome and found that Nmnat2V98M/Nmnat2R232Q compound-heterozygous CRISPR mice survived to adulthood but developed progressive motor dysfunction, peripheral axon loss, and macrophage infiltration. These disease phenotypes were all SARM1-dependent. Remarkably, macrophage depletion therapy blocked and reversed neuropathic phenotypes in Nmnat2V98M/R232Q mice, identifying a SARM1-dependent neuroimmune mechanism as a key driver of disease pathogenesis. These findings demonstrate that SARM1 induces an inflammatory neuropathy and highlight the potential of immune therapy to treat this rare syndrome and other neurodegenerative conditions associated with NMNAT2 loss and SARM1 activation.
シャルコー・マリー・トゥース病2A型ラットモデルにおけるSARM1/ミトコンドリア・フィードバック・ループによる神経病態の解明 A SARM1/mitochondrial feedback loop drives neuropathogenesis in a Charcot-Marie-Tooth disease type 2A rat model
Yurie Yamada, Amy Strickland, Yo Sasaki, A Joseph Bloom, Aaron DiAntonio, Jeffrey Milbrandt
Journal of Clinical Investigation Published:2022 Oct 26
DOI: 10.1172/JCI161566
Abstract
Charcot-Marie-Tooth disease (CMT) type 2A is an axonal neuropathy caused by mutations in the mitofusin 2 (MFN2) gene. MFN2 mutations result in profound mitochondrial abnormalities, but the mechanism underlying axonal pathology is unknown. SARM1, the central executioner of axon degeneration, can induce neuropathy and is activated by dysfunctional mitochondria. We tested the role of SARM1 in a rat model carrying a dominant CMT2A mutation (Mfn2H361Y) that exhibits progressive dying-back axonal degeneration, NMJ abnormalities, muscle atrophy, and mitochondrial abnormalities, all hallmarks of the human disease. We generated Sarm1 knockout and Mfn2H361Y, Sarm1 double mutant rats and find that deletion of Sarm1 rescues axonal, synaptic, muscle, and functional phenotypes, demonstrating that SARM1 is responsible for much of the neuropathology in this model. Despite the presence of mutant MFN2 protein in these double mutant rats, loss of SARM1 also dramatically suppressed many mitochondrial defects, including the number, size, and cristae density defects of synaptic mitochondria. This surprising finding indicates that dysfunctional mitochondria activate SARM1, and activated SARM1 feeds back on mitochondria to exacerbate mitochondrial pathology. As such, this work identifies SARM1 inhibition as an exciting therapeutic candidate for the treatment of CMT2A and other neurodegenerative diseases with prominent mitochondrial pathology.