ハンチントン病患者の皮膚細胞から作った神経細胞が、認知機能の低下に光明を見出す Neurons made from Huntington’s disease patients’ skin cells shed light on cognitive decline
2022-10-28 ワシントン大学セントルイス
新しい研究によると、患者の年齢が上がるにつれて、この病気はオートファジーと呼ばれる、細胞から老廃物を除去する重要な細胞維持プロセスを徐々に損なわせていることが示された。ハンチントン病では、特定の種類の神経細胞に老廃物が蓄積すると、その細胞が早死にするため、このハウスキーピングが重要である。
研究チームはまた、ハンチントン患者の皮膚細胞から作った神経細胞でオートファジーの経路を強化することで、その細胞が死滅するのを防ぐことも明らかにしました。
研究者たちは、症状のあるハンチントン病の高齢患者の皮膚細胞から再プログラムした中棘ニューロンが、非常に高いレベルでmiR-29b-3pというマイクロRNA分子を生成することを発見している。この高いレベルは、若いハンチントン病患者の再プログラムされた神経細胞や、年齢に関係なく健康な人の再プログラムされた神経細胞ではみられなかった。研究チームは、このマイクロRNAが、これらの細胞でオートファジーを阻害するなどの一連の現象を引き起こしていることを明らかにした。皮膚細胞が神経細胞への転換を完了すると、問題のマイクロRNAを産生するようになり、自食作用が鈍化して、細胞が死滅し始めたのだ。
研究では、正常な加齢に伴う認知機能の低下を理解するための有力な手がかりも発見された。症状のある神経細胞を症状の出る前の神経細胞や、若年者と高齢者の健康な神経細胞と比較したところ、健康な高齢者の神経細胞は有害なマイクロRNAをわずかに産生するが、その量は症状のあるハンチントン病患者の神経細胞よりもはるかに少量であることが判明したのだ。この研究により、正常で健康な加齢においても、中棘細胞は徐々にこのマイクロRNAを低レベルで産生するようになり、オートファジーによる健全な細胞のハウスキーピングを妨害している可能性が示唆された。
<関連情報>
- https://source.wustl.edu/2022/10/cellular-housekeeping-process-implicated-in-fatal-neurological-disorder/
- https://www.nature.com/articles/s41593-022-01185-4
加齢に伴うハンチントン病の進行を、患者由来線条体ニューロンの直接再プログラムでモデル化し、オートファジーの障害を浮き彫りにする Age-related Huntington’s disease progression modeled in directly reprogrammed patient-derived striatal neurons highlights impaired autophagy
Young Mi Oh,Seong Won Lee,Woo Kyung Kim,Shawei Chen,Victoria A. Church,Kitra Cates,Tiandao Li,Bo Zhang,Roland E. Dolle,Sonika Dahiya,Stephen C. Pak,Gary A. Silverman,David H. Perlmutter & Andrew S. Yoo
Nature Neuroscience Published:27 October 2022
DOI:https://doi.org/10.1038/s41593-022-01185-4
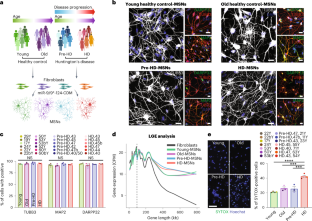
Abstract
Huntington’s disease (HD) is an inherited neurodegenerative disorder with adult-onset clinical symptoms, but the mechanism by which aging drives the onset of neurodegeneration in patients with HD remains unclear. In this study we examined striatal medium spiny neurons (MSNs) directly reprogrammed from fibroblasts of patients with HD to model the age-dependent onset of pathology. We found that pronounced neuronal death occurred selectively in reprogrammed MSNs from symptomatic patients with HD (HD-MSNs) compared to MSNs derived from younger, pre-symptomatic patients (pre-HD-MSNs) and control MSNs from age-matched healthy individuals. We observed age-associated alterations in chromatin accessibility between HD-MSNs and pre-HD-MSNs and identified miR-29b-3p, whose age-associated upregulation promotes HD-MSN degeneration by impairing autophagic function through human-specific targeting of the STAT3 3′ untranslated region. Reducing miR-29b-3p or chemically promoting autophagy increased the resilience of HD-MSNs against neurodegeneration. Our results demonstrate miRNA upregulation with aging in HD as a detrimental process driving MSN degeneration and potential approaches for enhancing autophagy and resilience of HD-MSNs.