2023-01-31 理化学研究所
この動画にはナレーションはありません
理化学研究所(理研)開拓研究本部 萩原生体模倣システム理研白眉研究チームのカシナン・スッティワニット 特別研究員、萩原 将也 理研白眉研究チームリーダーの研究チームは、ピペット操作で簡単に複数の細胞周囲環境を空間的に制御する技術を開発しました。
本研究成果は、現在世界中で開発が進められているミニ臓器(オルガノイド)[1]をより高次形態に成長させることを可能にするもので、創薬や再生医療に貢献すると期待できます。
従来、オルガノイドは全方位均一な条件下で培養して作られることから、球状あるいはランダム方向の分岐を持つものがほとんどであり、体内の形態とはかけ離れているという問題がありました。
今回、研究チームは、3Dプリンターを用いてL字型のフレームを持つ培養器を作製し、異なる性質を持つ複数のゲル(マトリゲル[2]など)を、表面張力を利用して空間的に自在の位置に配置するキューブ型の培養プラットフォーム「MultiCUBE」を開発しました。これにより、細胞に対して空間情報が与えられ、オルガノイドを生体により近い複雑な構造の環境下で成長させることが可能になりました。
本研究は、科学雑誌『Advanced Materials Technologies』オンライン版(1月29日付)に掲載されました。
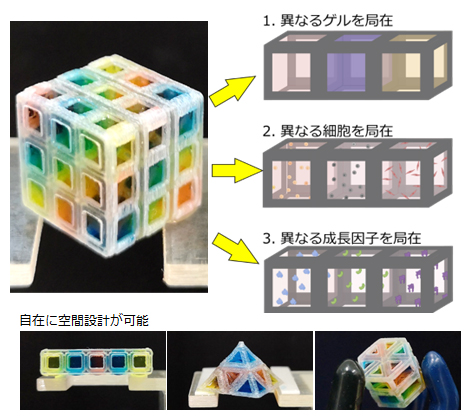
MultiCUBEによる細胞外周囲環境の設計・制御
背景
細胞の周囲を取り囲んでいる、非細胞素材であるコラーゲンなどの細胞外マトリックス[3]は、細胞に対して力学的・生化学的なシグナルを与えることで、臓器の成長に大きく関わっています。臓器周辺の細胞外マトリックスの構造・成分は多様であり、細胞が集団として組織を形成する際に位置情報を与える役割も果たしています。
このような非細胞素材の重要性にもかかわらず、体外でミニ臓器(オルガノイド)を再構築する研究では、多くの場合、細胞全体を均一のゲルで覆うなど、単一の条件下で培養した細胞の自律的な形作りが行われています。
オルガノイドは、ヒトの遺伝子を持った細胞を用いて体外で臓器機能を再構成するため、薬の候補化合物の安全性や効果のテストやヒトの発生の理解に大きく役立つと期待されていますが、前述の培養方法の結果、従来のオルガノイドは球状あるいはランダム方向の分岐を持つものがほとんどであり、体内の形態とはかけ離れています。そのため、この方法で臓器本来のマクロな構造を作ることは至難であり、病態再現や移植においては細胞レベルが限界だと考えられています。
一方、周囲環境をより体内に近い形に整えるため、バイオプリンター[4]やマイクロ流体チップといった工学技術を用いた研究も進められています。しかし、これらの技術には高い専門性と専用の機器が必要であることが応用の幅を制限していました。そこで研究チームは、細胞外マトリックスの空間的な多様性を体外で簡単に再現できる手法の開発に取り組みました。
研究手法と成果
細胞外マトリックスの多様性を再現するには、複数種類のゲルを3次元的に配置する必要がありますが、複数のゲルを隣合わせに配置すると、形状を保持できず境界面がすぐに混じり合います。そこで研究チームは、断面がL字型のフレームで囲まれた空間(ユニット)を複数持ち、ゲルを表面張力のみで各ユニットにとどめることで、複数のゲルを空間的に配置するキューブ型の培養プラットフォーム「MultiCUBE」を開発しました(図1)。
隣り合うユニット間でゲル同士は接触していますが、ゲルの粘性が高いこともあり、すぐには混じり合いません。ゲルの配置が終わった後にゲルを架橋し固めると、ゲル間に物理的境界がなく細胞が行き来できる一方、位置によってゲル内部の成分が異なる状態になります。つまり、細胞に空間的な情報を与えられるようになります。これにより、異なる物性を持つゲルを立体的に配置するだけでなく、特定の成長因子や細胞をあらかじめゲルに混ぜておくことで、細胞に複数要素の空間的局在を与えることが可能です(図1)。
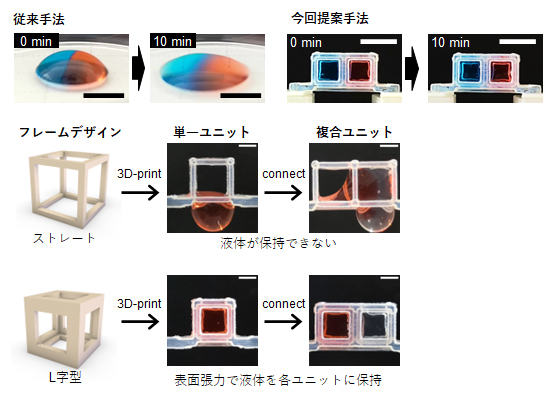
図1 L字フレームで囲まれたユニットによる液状ゲルの空間配置
(上段左)液状ゲルを隣り合わせで配置すると、10分後にはドーム状のゲルの構造がつぶれて、境界面があやふやになる。スケールバーは2mm。
(上段右)L字フレームユニットを組み合わせたMultiCUBEに液状ゲルを配置したもの。表面張力によってゲル形状が保持され、隣り合わせのゲルもすぐには混じり合わない。スケールバーは5mm。
(中段/下段)フレームデザインによる液状ゲルの保持性能の差。フレームを構成する辺の断面がL字型になるようにすることで、ゲルとの接着面積が増し、保持能力が確保できた。
MultiCUBEの最も大きな特徴は、未架橋の液状ゲルを単純なピペット操作だけで空間的に自在の位置に配置できることです。フレームを設計・作製しさえすれば、特別な機器を使わずにゲルを空間的に制御できるため、工学の実験に不慣れな研究者でも簡単に取り扱えます(図2)。また、フレームは3Dプリンターで作製するため、幅広い形状・用途に適応できます。
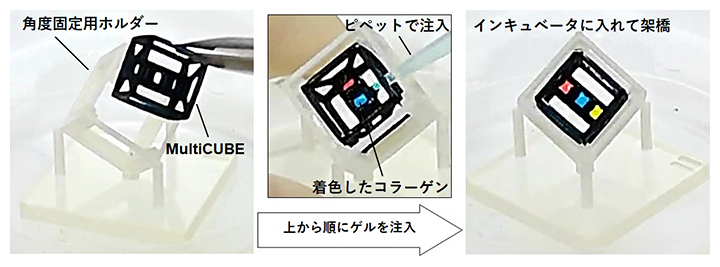
図2 MultiCUBEによるゲルの空間配置
MultiCUBE(黒)を角度固定のためのホルダー(白)に入れ、あとはピペット操作のみで液状ゲルを空間的に配置できる。
MultiCUBEを用いて、ゲルの中に特定の成長因子を加えることで、因子の空間局在を持たせる実験を行いました。ヘパリン結合EGF様成長因子[5]を混ぜたゲルを、何も混ぜないゲルと隣り合わせに配置し、気管支上皮細胞を一列に並べて培養しました。すると、3日後に成長因子を混ぜたユニットのみに分岐が多数形成され、それ以外のユニットは凝集して棒状の形態を形成しました。このように、細胞周囲環境において成長因子とともに空間的な局在を人為的に作り出すことで、単離した個々の細胞を多細胞組織へと誘導する過程を空間的に操作でき、より複雑な形態へと成長させられることが示されました(図3)。
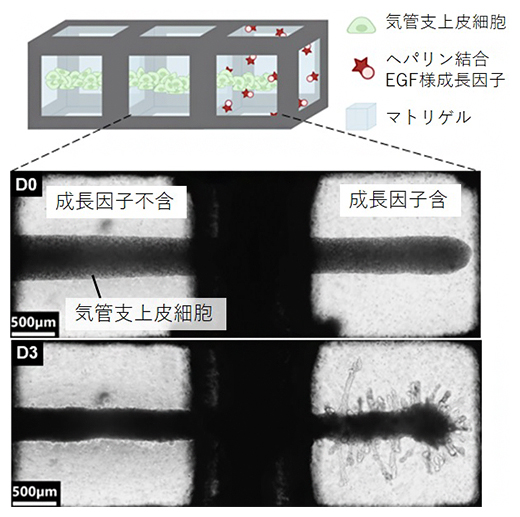
図3 成長因子空間局在による気管支分岐パターンの形態制御
MultiCUBEの右側のユニットにのみ成長因子を入れたゲル、それ以外は何も混ぜないゲルを配置した。そこに気管支上皮細胞を一列に並べて培養すると、3日後には、右側のユニットでは分岐が多数発生した。
また、体内のがん細胞の周囲には新しく血管が作られることが知られており、これを防ぐ薬を開発すれば、がん細胞への栄養供給を妨げることができます。そこで、MultiCUBEを用いて細胞の空間局在を制御し、肝がん上皮細胞に向かう血管新生を再現することを試みました。中央のユニットには血液を凝固させる働きがあるフィブリンと肝がん上皮細胞の塊をゲル内に配置し、左右のユニットには血管内皮細胞を混ぜたゲルを配置しました。この状態で7日間ほど培養したところ、左右の血管内皮細胞が中央のがん細胞に向けて伸長している様子が観察できました(図4)。
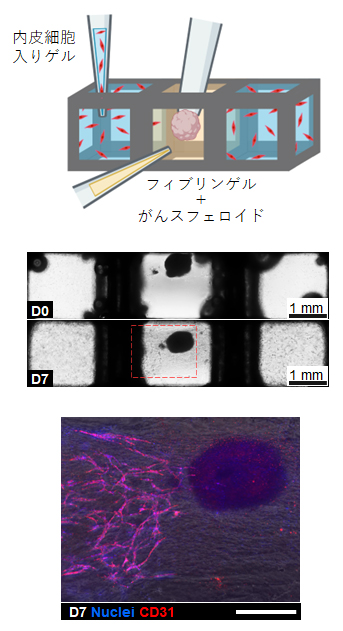
図4 MultiCUBEによる細胞の空間配置
(上)MultiCUBEの左右に血管内皮細胞入りのゲルを配置し、中央に肝がん上皮細胞のスフェロイド(細胞の塊)入りのフィブリンゲルを配置した。
(中)上は細胞とゲルを注入した直後、下は培養7日目の様子。左右のユニットから血管内皮細胞(小さな黒点)が伸長し、7日目にはがんスフェロイドに到達した。
(下)血管内皮細胞のマーカーであるCD31(赤)と核(青)の染色結果を、明視野の画像とオーバーラップさせたもの。血管内皮細胞が連なって伸長している様子が確認できる。スケールバーは500μm。
今後の期待
今回開発したMultiCUBEを用いることで、ピペット操作だけで簡単に細胞周囲の環境を設計・制御できるようになりました。これにより、細胞を生体内により近い環境で培養でき、従来よりも格段に高次の形態を持つオルガノイドの形成が期待できます。また、実験作業はピペット操作だけのため、工学技術に不慣れな作業者も簡単に取り扱うことができ、幅広い応用が期待できます。
本研究チームの別の研究において、既に細胞集団の位置をMultiCUBEを構成するCUBE内で自在に配置する技術は達成済みであり、今回その細胞の周囲環境の配置も制御できるようになりました。これらの技術を組み合わせることで、細胞から臓器への形づくりを高精度に設計できるようになり、生体内システムを、より高度に生体外で表現できるようになると期待できます。
現在、本技術を含めたCUBEプラットフォームによる生体模倣システムの事業化に向けて開発を進めています。
補足説明
1.ミニ臓器(オルガノイド)
人工的に作られる、生体内の組織または臓器に似た細胞組織体。
2.マトリゲル(ゲル)
Corning社が開発した細胞外マトリックスの一種。
3.細胞外マトリックス
コラーゲンなど細胞の外側に存在し、三次元的に細胞が存在するための足場となる物質。細胞に直接働き掛ける役割もある。
4.バイオプリンター
ゲルや細胞をノズルから打ち出し、3Dプリンターのように立体構造を作製するプリンター。
5.ヘパリン結合EGF様成長因子
EGFタンパク質ファミリーの一つ。EGFと同じ受容体に作用しつつ、抗凝固薬のヘパリンに対して強い結合性を持つ。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「三次元培養環境場の計測・制御プラットフォームによる組織形成ダイナミクス解析(研究代表者:萩原将也)」による助成を受けて行われました。
原論文情報
Kasinan Suthiwanich, Masaya Hagiwara, “Localization of Multiple Hydrogels with MultiCUBE Platform Spatially Guides 3D Tissue Morphogenesis In Vitro”, Advanced Materials Technologies, 10.1002/admt.202201660
発表者
理化学研究所
開拓研究本部 萩原生体模倣システム理研白眉研究チーム
特別研究員 カシナン・スッティワニット(Kasinan Suthiwanich)
理研白眉研究チームリーダー 萩原 将也(ハギワラ・マサヤ)
報道担当
理化学研究所 広報室 報道担当