2023-05-16 理化学研究所
理化学研究所(理研)生命機能科学研究センター 動的恒常性研究チームの岡田 守弘 研究員(理研 開拓研究本部 Yoo生理遺伝学研究室 研究員)、ユ・サガン チームリーダー(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員)らの研究チームは、ショウジョウバエ[1]を用いた実験により、がん細胞が分泌する「ネトリン[2]」というタンパク質ががんによる全身症状の発症に関わっていることを明らかにしました。
本研究成果は、多くの進行がん患者に認められる「がん悪液質[3]」という筋肉や脂肪の減少といった全身症状の基本的な仕組みの理解に貢献すると期待できます。
がんが進行すると、がん細胞から離れた臓器や全身に悪影響が現れるがん悪液質と呼ばれる状態に陥り、予後に悪影響を及ぼします。しかし、局所に生じたがんが全身症状を引き起こし、個体に悪影響を及ぼす詳しい仕組みは不明でした。
今回、研究チームは、ショウジョウバエ幼虫の将来眼になる組織に発生させたがん細胞から、タンパク質のネトリンが分泌されることを発見しました。ネトリンは、がん細胞から離れた脂肪体[4]と呼ばれる組織に作用し、全身の脂肪酸[5]代謝の恒常性を乱していました。一方、がん細胞からのネトリン分泌や脂肪体組織におけるネトリンの作用を阻害すると、がん細胞自体には影響はなかったものの、個体の生存率が上昇することが分かりました。
本研究は、科学雑誌『The EMBO Journal』オンライン版(5月4日付)に掲載されました。
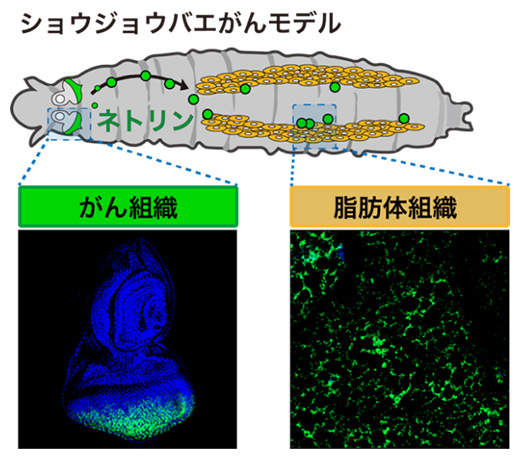
ショウジョウバエ幼虫のがん組織から分泌され、遠隔の脂肪体組織に作用するネトリン(緑色)
背景
がんが発生する仕組みについてはさまざまな研究が行われており、細胞のがん化を防ぎ、がん化した細胞を除去するための予防・治療法の開発が進められています。一方、発生したがんが個体に与える影響については、いまだに多くのことが分かっていません。
その中でも、「がん悪液質」と呼ばれる筋肉や脂肪の減少といった全身症状は進行がん患者の80%以上に認められ、予後に悪影響を及ぼします注1)。がん悪液質の存在は古代ギリシャの医学書にも記述がありますが、がん悪液質を完治し、生存率を大幅に改善した報告はこれまでありません。研究が立ち遅れている原因は、がん悪液質は生理的な異常が複雑に絡み合う全身性の代謝障害のため、個体を使った解析が必須であるにもかかわらず、その解析が困難な点にあります。
今回、研究チームは組織・時期特異的な遺伝学的操作が可能であり、複雑な生理的異常を個体レベルで解析できる点に秀でるショウジョウバエをモデルに選びました。そして、どのような仕組みでがんが全身に悪影響を及ぼし、個体の死が誘導されるのかを調べました。
注1)Biswas AK, Acharyya S. Understanding cachexia in the context of metastatic progression. Nat Rev Cancer. 2020 May;20(5):274-284. doi: 10.1038/s41568-020-0251-4. Epub 2020 Mar 31. PMID: 32235902.
研究手法と成果
ヒトのさまざまながんにおいて、変異が確認されているがん遺伝子の一つにRas[6]があります。研究チームは、幼虫の将来眼になる組織(成虫眼原基)に、ショウジョウバエの変異型Ras遺伝子を発現させ、ショウジョウバエがんモデルを作製しました。成虫眼原基に生じたがん細胞は転移や大量増殖はしなかったものの、がんを誘導して数日以内に80%以上の個体が死亡しました。
そこで、「がん細胞そのものではなく、がん細胞から分泌された因子が全身に悪影響を与えている」という仮説を立てました。網羅的な遺伝子発現解析[7]を行った結果、がん細胞で発現が上昇する20種類の分泌因子[8]を特定しました(図1A)。次に、分泌因子の生理的な機能を理解するために、がん細胞で分泌因子の遺伝子発現を阻害し、生体の生存率への影響を調べました。その結果、「ネトリン」の発現をがん細胞で抑制すると、がん細胞自体の増殖には影響がないにもかかわらず、個体の生存率が著しく上昇することを発見しました(図1B、C)。
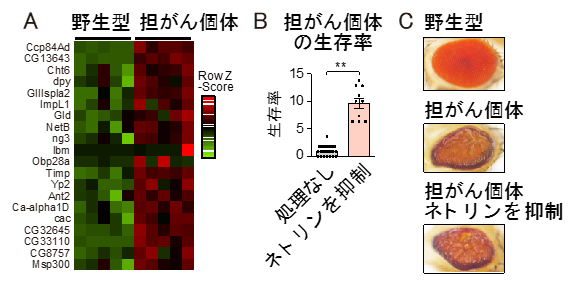
図1 がん細胞で発現する分泌因子ネトリンが個体の生存率に及ぼす影響
A)がん細胞で発現が上昇することが判明した20種類の分泌因子。相対的な発現量の違いを赤(高発現)と緑(低発現)のマトリックスで表示した。なお縦の5列は、野生型とがんを発生させた個体(担がん個体)のそれぞれ数十匹から取り出した成虫眼原基をまとめて解析した実験について、5回繰り返して得られたデータを表示したもの。本研究では、20種類の分泌因子のうちネトリン(NetB)に着目した。
B)がん細胞でネトリンの発現を抑制すると、担がん個体の生存率が上昇する。生存率は、幼虫のうち成虫になった個体数の割合とした。比較した2群の有意水準は、**はp<0.01。
C)成虫眼原基でがんを発生させた成体の表現型。野生型と比較し、担がん個体の眼は乱れた構造を示す。この表現型異常はがん細胞でネトリンの発現を抑制しても変化せず、がん自体への影響は見られなかった。
では、がん細胞から分泌されたネトリンはどの組織に作用して、全身に悪影響を与え、個体を死に誘導しているのでしょうか。がん細胞から分泌されるネトリンだけを蛍光タンパク質で可視化できるトランスジェニック個体[9]を作製し、遠隔組織に対する作用機序を調べました。その結果、がん細胞から体液中に分泌されたネトリンは、代謝恒常性に必要不可欠な組織である脂肪体(哺乳類の肝臓や脂肪に相当する組織)に作用し、ネトリン受容体であるUnc-5[2]タンパク質に結合することが明らかになりました。
本来、ネトリンは神経回路形成に関わる因子として、ネトリン分泌細胞に向かって神経軸索を誘導する(引き寄せる)機能が広く知られてきました。しかし今回、ネトリンがホルモンのように体液中に分泌され、離れた組織に作用する因子として機能することが初めて示されました。
最終的に、がん細胞で生成されたネトリンは、がん細胞から離れた脂肪体組織においてカルニチン[5]という物質の産生を抑制し、個体全体でのカルニチン量を低下させていることが分かりました。カルニチンは細胞内の脂肪酸をエネルギーに変える脂肪酸代謝に必須なため、カルニチン量の低下がエネルギー不足を引き起こし、個体を死に至らせることが示されました(図2)。
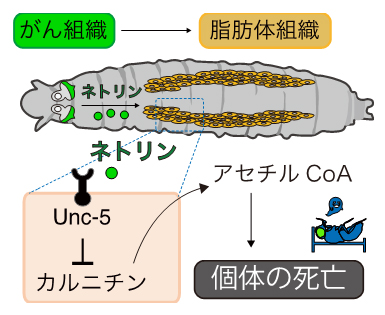
図2 ネトリンによる遠隔組織のカルニチン代謝抑制と死の誘導
がん細胞から体液中に分泌されたネトリンは、脂肪体においてネトリンの受容体であるUnc-5に結合し、カルニチン合成を阻害する。カルニチンは、脂肪酸をミトコンドリア内に運ぶ役割を担っている。ミトコンドリアに運ばれた脂肪酸は多くの過程を経て、アセチルCoAに変換されエネルギーが産生される。そのため、カルニチン不足によってアセチルCoA産生量が低下し、エネルギー不足が引き起こされ、最終的に死に至るモデルを想定している。
最後に、ネトリンによって引き起こされる全身症状を改善することで、個体の生存率が改善できないかを調べました。がん細胞から離れた脂肪体組織のネトリン受容体やその下流のシグナルを抑制すると、カルニチン量が上昇し、個体の生存率が著しく上昇しました。その際、がん細胞自体には影響はありませんでした。また、がんを発症した個体に不足しているカルニチンや、カルニチンの働きで作られるアセチルCoA[5]を投与すると、生存率が回復できることも分かりました。
今後の期待
本研究成果の最大の意義は、神経軸索の誘引因子としての機能が広く知られてきたネトリンが、離れた臓器同士を連関させる液性シグナルとして機能し、がん悪液質に関与することの発見です。ヒトの場合でもがん患者には、血液や尿におけるネトリン量の上昇と、血液で検出されるカルニチン量の低下が認められます。この二つはこれまで一見無関係な現象と考えられてきましたが、本研究のショウジョウバエがんモデルは、がん患者のがん悪液質の生理状態を反映したモデルになる可能性があります。ネトリンを標的としたがん治療について、今後の検証が待たれます。
さらに本研究では、がん細胞自体を変化させなくても、がん細胞から離れた組織の代謝状態を変化させるだけで、個体の死を回避させられることが示されました。この成果は、たとえがんが存在したとしても、全身症状のコントロールにより生存率の改善を目指せる可能性があることを示しています。
補足説明
1.ショウジョウバエ
体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れているモデル生物。ショウジョウバエを用いたがん研究は歴史が長く、がんの分子機構の解明に貢献している。
2.ネトリン、Unc-5
ネトリンは、神経軸索を誘引する分泌タンパク質の一種であり、線虫、ショウジョウバエ、哺乳類が共通して持つ。本研究では、ショウジョウバエのネトリンであるNetrinB(NetB)を解析している。なおヒトでは、がんでネトリンの発現が上昇することが報告されている。Unc-5は線虫で発見されたネトリン受容体の一種であり、やはりショウジョウバエ、哺乳類に共通した因子である。
3.がん悪液質
筋肉や脂肪が著しく消耗する病態で、多くの進行がん患者に認められる。通常の栄養サポートで完全に改善することは困難である。
4.脂肪体
ショウジョウバエを含む昆虫に広く存在し、哺乳類の肝臓や脂肪にあたる組織。
5.脂肪酸、カルニチン、アセチルCoA
エネルギー源としての脂肪が消費される際には、脂肪酸とグリセロールに分解され、脂肪酸から高エネルギー化合物であるアセチルCoAが生成される。カルニチンは、脂質の代謝に関与するアミノ酸由来のビタミン様物質であり、脂肪酸をアセチルCoAの生成場所であるミトコンドリア内に運ぶ役割を担い、アセチルCoAの生成において重要な役割を果たす。
6.Ras
細胞増殖の制御において重要であり、がんの中で最も高頻度に異常を示すがん遺伝子。
7.網羅的な遺伝子発現解析
生体細胞内における全てのmRNA量を網羅的に解析する手法。特定のサンプル間で発現量が変動する遺伝子を探索する目的で使われる。
8.分泌因子
細胞から分泌されるタンパク質で、細胞間や臓器間の情報伝達の役割を担っている。代表的な分泌因子としてはホルモンやサイトカインなどがある。
9.トランスジェニック個体
人為的操作により外部から特定の遺伝子を導入した個体。本研究では、ネトリンと蛍光タンパク質の融合遺伝子を導入した個体を用いた。
研究チーム
理化学研究所 生命機能科学研究センター 動的恒常性研究チーム
チームリーダー ユ・サガン(Sa Kan Yoo)
(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員)
研究員 岡田 守弘(オカダ・モリヒロ)
(理研 開拓研究本部 Yoo生理遺伝学研究室 研究員)
テクニカルスタッフⅠ 高野 智美(タカノ・トモミ)
(理研 開拓研究本部 Yoo生理遺伝学研究室 特別技術員)
大学院生リサーチ・アソシエイト(研究当時)池川 優子(イケガワ・ユウコ)
国際プログラム・アソシエイト(研究当時)ハンナ・シエシエルスキー(Hanna Ciesielski)
特別研究員(研究当時)西田 弘(ニシダ・ヒロシ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、開拓研究、奨励課題(研究代表者:岡田守弘))で実施し、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「老化の遺伝学的・非遺伝学的分子基盤の解明(研究代表者:兪史幹)」、日本学術振興会(JSPS)科学研究費助成事業若手研究(A)「個体レベルでの物理的損傷に対する応答・修復メカニズムの解明(研究代表者:兪史幹)」、同基盤研究(B)「老化中の恒常性破綻機構の解明(研究代表者:兪史幹)」、同若手研究「栄養状態を切り口とした、癌が全身の生理状態に与える悪影響の仕組みの解明(研究代表者:岡田守弘)」、同基盤研究(C)「がん悪液質におけるカルニチン代謝を制御する分泌因子の分子機構解明(研究代表者:岡田守弘)」、科学技術振興機構(JST)創発的研究支援事業「エレボーシスを切り口とした腸恒常性維持機構の解明(研究代表者:兪史幹)」、笹川科学研究助成日本科学協会「生き物はどのようにして癌で死ぬのか?(研究代表者:岡田守弘)」による助成を受けて行われました。
原論文情報
Morihiro Okada, Tomomi Takano, Yuko Ikegawa, Hanna Ciesielski, Hiroshi Nishida, Sa Kan Yoo, “Oncogenic stress-induced Netrin is a humoral signaling molecule that reprograms systemic metabolism in Drosophila”, The EMBO journal, 10.15252/embj.2022111383
発表者
理化学研究所
生命機能科学研究センター 動的恒常性研究チーム
研究員 岡田 守弘(オカダ・モリヒロ)
(理研 開拓研究本部 Yoo生理遺伝学研究室 研究員)
チームリーダー ユ・サガン(Sa Kan Yoo)
(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員)
報道担当
理化学研究所 広報室 報道担当