2023-11-24 理化学研究所
理化学研究所(理研)生命機能科学研究センター 生体機能動態イメージング研究チームの崔 翼龍 チームリーダー(研究当時、現 分子標的化学研究チーム 客員主管研究員)、標識化学研究チームの土居 久志 チームリーダー(研究当時、現 分子標的化学研究チーム 客員主管研究員)、健康・病態科学研究チームの渡辺 恭良 チームリーダー(研究当時、現 分子標的化学研究チーム 客員主管研究員)らの国際共同研究グループは、ウイルス感染後の倦怠感に脳内の局所炎症が関わることを発見しました。
本研究成果は、新型コロナウイルスなどの末梢感染後に引き起こされる倦怠感の分子神経機序の解明や、その緩和・治療法の確立に貢献すると期待できます。
ウイルスなどの病原体が感染すると、急性期の発熱や痛みなどの全身症状だけではなく、長期にわたる倦怠感や意欲低下などを招くことが知られています。今回、国際共同研究グループは、疑似的に末梢組織でのウイルス感染を再現したモデルラットの脳を陽電子放射断層撮影法(PET)[1]で撮像し、脳内の炎症を定量解析しました。その結果、背側縫線核[2](はいそくほうせんかく)などでの脳内炎症の強さが、その後の倦怠感(自発行動の低下)と正に相関していることを明らかにしました。
本研究は、科学雑誌『Frontiers in Immunology』オンライン版(11月9日付)に掲載されました。
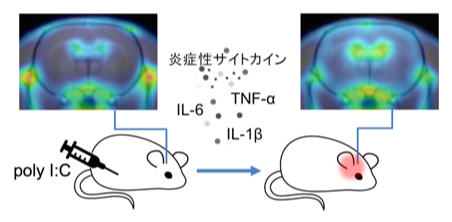
ラット末梢組織(腹腔)への疑似感染が引き起こした脳内炎症
背景
新型コロナウイルス感染症をはじめさまざまなウイルスの感染が、急性期の発熱や痛みなどの全身症状を引き起こすだけではなく、精神神経活動の異常に由来すると考えられる、長期にわたる倦怠感や意欲低下などを招くことがしばしば報告されています。発熱や痛みについてはその分子神経メカニズムが比較的よく解明されています。ところが、倦怠感は日常的によく経験する身近な現象にもかかわらず、いまだに実態が不明で、その分子神経基盤は明らかになっておらず、有効な緩和処置や治療法が確立されていません。
1984年に米国ネバダ州で発生したEpstein-Barrウイルス[3]の大規模感染では、原因不明な倦怠感を主訴とする慢性疲労症候群[4]の集団発生が報告され、感染症と倦怠感の関連を調べる臨床研究が広く行われるようになりました。慢性疲労症候群の発症メカニズムは未解明ですが、患者の脳内の一部領域において脳内炎症が生じていることが分かっています注1)。脳内炎症はうつ病や統合失調症などの精神神経疾患の病態に深く関わっている他、免疫反応において末梢組織から放出される炎症性サイトカイン[5]が脳血管内皮細胞[6]や迷走神経求心路[7]を介して、脳内炎症を引き起こすことも報告されています。これらのことから、ウイルス感染後の倦怠感に脳内炎症が関わる可能性が示唆されていましたが、その詳細な分子神経基盤は分かっていませんでした。
注1)2014年4月4日プレスリリース「慢性疲労症候群と脳内炎症の関連を解明」
研究手法と成果
本研究では、生体の脳内炎症を高感度で検出可能なPETイメージングを用いて、ウイルス感染モデルラットの脳内炎症を定量評価し、その個体が呈する倦怠感と比較検討することで、ウイルス感染による脳内炎症と倦怠感の関連について詳細な検討を行いました。
国際共同研究グループはまず、ウイルス感染に類似した全身症状を引き起こすことが知られている合成2本鎖RNA(poly I:C [8])をラットの腹腔内に投与し、ウイルス感染(疑似感染)による急性期の身体症状について検討しました。その結果、poly I:C投与2時間後より血中の炎症性サイトカインが著しく上昇し、発熱が数時間にわたって持続することを確認できました(図1)。
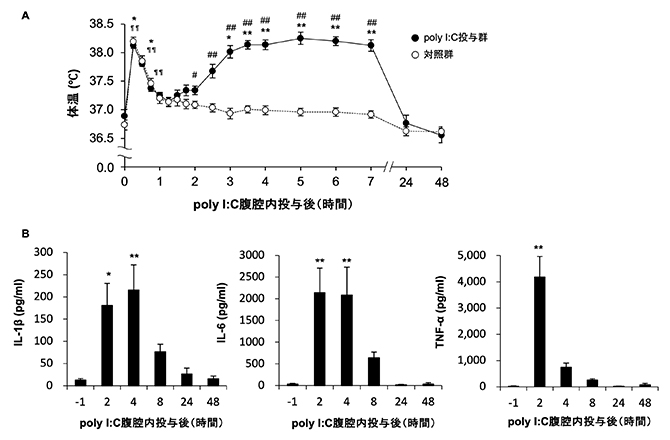
図1 ラット腹腔への疑似感染に伴う急性症状
A)poly I:C腹腔内投与に伴う体温変化。発熱のピークは投与5時間後であり、24時間後までに平熱に戻っていった。
B)炎症性サイトカインであるIL-1β(左)、IL-6(中)、TNF-α(右)の血中濃度は、投与2時間後から上昇が観察された。
次に、poly I:C腹腔内投与による疑似感染が引き起こす倦怠感を定量評価するため、飼育容器内での自由行動下の自発行動量の変化を赤外線センサーで計測し、定量解析しました。自発行動は行動意欲と関連しており、倦怠感は行動意欲を低下させます。観察の結果、poly I:C腹腔内投与によって自発行動量が著しく低下し、数日間かけてゆっくり回復することが分かりました(図2)。これは、急性症状の発熱が治った後も、倦怠感が持続していることを示しています。
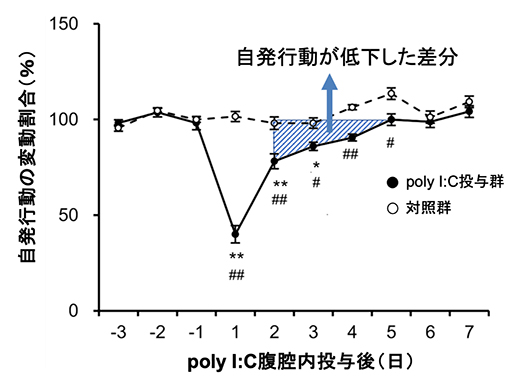
図2 疑似感染後の持続的な自発行動の低下
poly I:C腹腔内投与1日後に自発行動が著しく低下し、その後の回復は数日間にわたってゆっくりと進んだ。回復期の自発行動の低下を定量的に評価する指標として、poly I:C処置前の同じ個体の平均的な自発行動との差分(グラフの斜線で表した面積)を用いた。
続いて、これらのpoly I:Cの腹腔内投与による疑似感染が脳内炎症を引き起こすかをPETイメージングで検討しました。疑似感染初期の脳内炎症を定量評価するため、脳内の活性化ミクログリアを特異的に認識するPETプローブ[18F]DPA-714[9]を用いて撮像を行った結果、poly I:C腹腔内投与1日後に脳内の広範な領域において[18F]DPA-714の集積が増加することを確認できました(図3)。実際のウイルス感染では、末梢組織から放出された炎症性サイトカインが脳血管内皮細胞や迷走神経求心路を刺激し、脳内で炎症を引き起こすことが報告されています。本研究のpoly I:Cの腹腔内投与による末梢組織での疑似感染でも、迷走神経求心路に当たる孤束核[10](こそくかく)や結合腕傍核[10](けつごうわんぼうかく)で脳内炎症が有意に上昇することを確認できました。
さらに、脳内炎症が見られた各領域での[18F]DPA-714の集積量(脳内炎症)と自発行動量の低下(倦怠感)の相関解析を行った結果、背側縫線核などでの脳内炎症が倦怠感と正に相関することが明らかとなりました。背側縫線核にはセロトニン[11]神経細胞が多く分布し、セロトニン神経系は古くから倦怠感との関連が指摘されてきました。例えば、慢性疲労症候群の患者やがんの免疫治療により強い倦怠感を訴えている患者にセロトニン再取り込み阻害剤であるSSRI[11]を処方すると、倦怠感が軽減することが知られています。
![[18F]DPA-714の集積量(脳内炎症)と自発行動量の低下(倦怠感)の相関解析の図](https://www.riken.jp/medialibrary/riken/pr/press/2023/20231124_2/20231124_2_fig3.jpg)
図3 [18F]DPA-714の集積量(脳内炎症)と自発行動量の低下(倦怠感)の相関解析
左)疑似感染後に脳内炎症が観察された領域のうち、背側縫線核と中脳網様体の炎症を捉えたPET画像。
右)背側縫線核の炎症の強さを反映する[18F]DPA-714の集積量(縦軸)と、回復期の自発行動の低下量(横軸)の相関を示すグラフ。自発行動の低下量が大きいほど、[18F]DPA-714の集積量も高い。
以上の結果から、ウイルス感染による脳内炎症と倦怠感の関連を説明するメカニズムとして、
1.末梢組織に感染したウイルスは、脳内の背側縫線核などで炎症を起こす
2.脳内炎症はセロトニン神経機能に異常をもたらす
3.セロトニン神経機能の異常が、最終的に長期にわたる倦怠感を引き起こす
という分子神経基盤の存在が示唆されました。
今後の期待
倦怠感は脳内で生まれてくる主観的な感覚ですが、その実態はよく分かっていません。昨今の新型コロナウイルス感染による倦怠感の発症機序も不明であり、その有効な緩和・治療法もいまだに確立されていません。
本研究は、poly I:Cの腹腔内投与による疑似感染モデルラットにより、背側縫線核などの局所的な脳内炎症が倦怠感の惹起に関わることを明らかにしました。
今後、神経生理学、行動薬理学、遺伝子工学的な手法を組み合わせることで、倦怠感の詳細な分子神経基盤の解明が期待されます。これらの分子神経基盤の解明は、新型コロナウイルス感染をはじめとした、さまざま感染症による慢性的な倦怠感の緩和や治療法の確立にもつながると期待しています。
補足説明
1.陽電子放射断層撮影法(PET)
陽電子を放出する放射性同位体を薬などの分子に組み込んで個体に投与し、体内で崩壊して放出されるγ線を測定して分子の体内分布を見る方法。PETはPositron Emission Tomographyの略。
2.背側縫線核
セロトニンを分泌する神経細胞が集まった神経核の一つで、脳の広い領域に投射し、睡眠調節や食欲制御などの恒常性維持に関わっている。また、ストレス応答など生体防御機構としても機能している。
3.Epstein-Barrウイルス
2本鎖DNAをゲノムとするヘルペスウイルスの一種。感染してもほとんどは無症状だが、バーキットリンパ腫など一部のがんとの関連が指摘されている。
4.慢性疲労症候群
原因不明の極度の疲労が半年以上続き、正常な社会生活を営むことが困難な状態に陥る病気。従来の検査では異常を見つけることができず、治療法も確立していない。
5.炎症性サイトカイン
サイトカインは、細胞同士の情報伝達に関わるさまざまな生理活性を持つタンパク質の総称。炎症性サイトカインとは、体内への病原体の侵入や細胞の傷害などを受けて産生されるIL-1β、IL-6、TNF-αなどのサイトカインで、生体防御に関与する多種類の細胞に働き、炎症反応を引き起こす。
6.脳血管内皮細胞
脳血管の内腔を覆う一層の細胞の一種で、血液と脳組織の間にバリアを形成し、血液中の物質が直接脳組織に入ることを制限する。
7.迷走神経求心路
迷走神経は胃、腸、心臓や血管などの内臓に広く分布している脳神経の一つで(第X脳神経)、体内の内部環境をコントロールしている。内臓の内部環境の変化は迷走神経の求心路を介して脳に伝達される。
8.poly I:C
リボヌクレオチドであるイノシン(I)とシトシン(C)が重合した人工2本鎖RNA。動物の体内に投与すると、RNAウイルスが細胞に感染したときと同様の生体反応を引き起こす。
9.[18F]DPA-714
脳内の活性化したミクログリアで多量に生産される18 kDa translocator proteinという膜タンパクと特異的に結合するPETプローブ。
10.孤束核、結合腕傍核
孤束核は、延髄にあり、迷走神経求心路を介して内臓器官からの情報を受け取る神経核。結合腕傍核は、孤束核から味覚や内臓感覚情報を受け取り、高次脳に中継する神経核。
11.セロトニン、SSRI
セロトニンは神経伝達物質の一つで、本能行動、情動、認知機能に深く関連することが知られている。SSRIはうつ病の治療薬の一つとして多く用いられる医薬品であり、セロトニンの再取り込みを選択的に抑制することにより、シナプス間隙(かんげき)のセロトニン濃度を上昇させ、抗うつ効果を示すことが知られている。SSRIはSelective Serotonin Reuptake Inhibitorsの略。
国際共同研究グループ
理化学研究所 生命機能科学研究センター
生体機能動態イメージング研究チーム(研究当時)
チームリーダー(研究当時)崔 翼龍(サイ・ヨクリュウ)
(現 分子標的化学研究チーム 客員主管研究員)
短期国際プログラムアソシエイト(研究当時)
李 丹渓(リ タンケイ)
研究員(研究当時)胡 迪(コ・テキ)
リサーチアソシエイト(研究当時)越智 祐太(オチ・ユウタ)
テクニカルスタッフⅠ(研究当時)重田 美香(シゲタ・ミカ)
リサーチアソシエイト(研究当時)武 玉萍(ウー・ユーピン)
研究員(研究当時)根山 広行(ネヤマ・ヒロユキ)
(現 分子標的化学研究チーム 客員研究員)
研究員(研究当時)田原 強(タハラ・ツヨシ)
(現 分子標的化学研究チーム 客員研究員)
標識化学研究チーム(研究当時)
チームリーダー(研究当時)土居 久志(ドイ・ヒサシ)
(現 分子標的化学研究チーム 客員主管研究員、大阪公立大学研究推進機構 特任教授)
テクニカルスタッフⅠ(研究当時)新垣 和貴子(アラガキ・ワキコ)
(現 分子標的化学研究チーム テクニカルスタッフⅠ)
専門技術員(研究当時)馬渡 彩(マワタリ・アヤ)
健康・病態科学研究チーム(研究当時)
チームリーダー(研究当時)渡辺 恭良(ワタナベ・ヤスヨシ)
(現 分子標的化学研究チーム 客員主管研究員、神戸大学大学院科学技術イノベーション研究科 特命教授)
専門技術員(研究当時)林中 恵美(ハヤシナカ・エミ)
(現 分子標的化学研究チーム 専門技術員)
副チームリーダー(研究当時)和田 康弘(ワダ・ヤスヒロ)
北京中医薬大学(中国)
教授 李 峰(リ・ホウ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本医療研究開発機構(AMED)長寿・障害総合研究事業「イメージングと新規バイオマーカーを用いた慢性疲労症候群の客観的診断法の開発(研究代表者:渡辺恭良)」、同創薬基盤推進研究事業「ポジトロンCTで脳内炎症が確認された患者に対するミクログリア活性化抑制薬の有効性検証(研究代表者:渡辺恭良)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「疲労の慢性化機序の解明およびその臨界期の同定と抗疲労・健康戦略の創出(研究代表者:崔翼龍)」、同挑戦的研究(萌芽)「疲労の慢性化プロセスにおける臨界期の同定と抗疲労・健康戦略への挑戦(研究代表者:崔翼龍)」による助成を受けて行われました。
原論文情報
Danxi Li, Di Hu, Yuta Ochi, Wakiko Arakaki, Aya Mawatari, Mika Shigeta, Yuping Wu, Emi Hayashinaka, Hiroyuki Neyama, Tsuyoshi Tahara, Yasuhiro Wada, Feng Li, Hisashi Doi, Yasuyoshi Watanabe, Yilong Cui, “Regional neuroinflammation induced by peripheral infection contributes to fatigue-like symptoms: a [18F]DPA-714 positron emission tomography study in rats”, Frontiers in Immunology, 10.3389/fimmu.2023.1261256
発表者
理化学研究所
生命機能科学研究センター 生体機能動態イメージング研究チーム(研究当時)
チームリーダー(研究当時)崔 翼龍(サイ・ヨクリュウ)
(現 分子標的化学研究チーム 客員主管研究員)
標識化学研究チーム(研究当時)
チームリーダー(研究当時)土居 久志 (ドイ・ヒサシ)
(現 分子標的化学研究チーム 客員主管研究員)
健康・病態科学研究チーム(研究当時)
チームリーダー(研究当時)渡辺 恭良(ワタナベ・ヤスヨシ)
(現 分子標的化学研究チーム 客員主管研究員)
報道担当
理化学研究所 広報室 報道担当