2024-03-19 京都大学
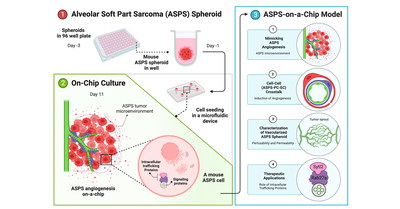
1.胞巣状軟部肉腫ASPSのスフェロイドを作製し、2.マイクロ流体デバイス内において血管内皮細胞およびペリサイトとの共培養系を確立した。これにより、ASPSの血管新生を模倣(3-1)、ASPS細胞ーペリサイトー血管内皮細胞の相互作用を評価(3-2)、血管化したASPSスフェロイドを評価(3-3)すると共に、血管新生因子の輸送促進因子の阻害を評価する生体模倣システムを確立した(3-4)。
マイクロエンジニアリング専攻の横川隆司教授、S. Chuaychob特定研究員(現:京大エネルギー理工学研究所特定助教)らの研究グループは、東京医科大学医学総合研究所未来医療研究センター実験病理学部門の中村卓郎特任教授、公益財団法人がん研究会がん研究所がんエピゲノムプロジェクト田中美和主任研究員らとの共同研究で、胞巣状軟部肉腫(alveolar soft part sarcoma, ASPS)を模倣したASPS-on-a-Chipを開発し、腫瘍形成時に血管新生を誘導する血管新生因子が輸送される仕組みを生体外で再現することに成功しました。
ASPSは希少がんである軟部肉腫の一つで、AYA世代(思春期・若年成人)に好発します。腫瘍の増殖は緩やかですが、血管形成が盛んなことから全身に転移する傾向が強く、予後不良な疾患です。ASPSの標的遺伝子には血管形成因子自体と、それらを運ぶ細胞内輸送促進因子が含まれ、ASPSにおける独特な血管構造の原因となっていることがわかっています(M. Tanaka et al., Nat Commun, 2023)。
今回、腫瘍細胞、周皮細胞、および血管内皮細胞からなる共培養系により、血管が豊富なASPS-on-a-Chipを作製して腫瘍微小環境を模倣しました。これにより、機能的および形態的に生体内のASPSを模倣し血管網の透過性が上昇すること、および細胞内輸送促進因子であるRab27aとSytl2が血管新生を誘導することを実証しました。今後、輸送促進因子機能を抑える全く新しい治療方法の開発にもつながる成果と期待されます。
本研究成果は2024年3月22日(米国東部時間)に国際学術誌「Proceedings of the National Academy of Sciences (PNAS)」(米国科学アカデミー紀要)のオンライン版に掲載されました。
研究詳細
胞巣状軟部肉腫のオンチップモデルにより血管新生メカニズムを明らかに~Microphysiological systems (MPS)を活用した血管新生標的分子の評価~
研究者情報
横川 隆司
S. Chuaychob
書誌情報
タイトル
Mimicking Angiogenic Microenvironment of Alveolar Soft Part Sarcoma in a Microfluidic Co-Culture Vasculature Chip
著者
Surachada Chuaychob、Ruyin Lyu、田中美和、萩庭歩美、北田敦也、中村卓郎、横川隆司*
(*は責任著者)
掲載誌
Proceedings of the National Academy of Sciences (PNAS)
DOI
10.1073/pnas.2312472121