2024-06-07 京都大学iPS細胞研究所
ポイント
- ヒトiPS細胞から作製したCD4+T細胞は、培養条件を最適化することで制御性T細胞(Treg)注1)に特徴的な転写因子であるFOXP3を発現する(iCD4+Treg様細胞)。
- iCD4+Treg様細胞は、混合培養したヒトの細胞傷害性T細胞注2)の活性化を抑制した。
- HLA-A2を認識するキメラ抗原受容体(CAR)注3)を導入したiCD4+Treg様細胞は、免疫不全マウスの体内でHLA-A2をもつ免疫細胞による移植片対宿主病(GVHD)注4)の進行を抑制した。
1. 要旨
矢野 寿 元研究員(CiRA増殖分化機構研究部門、元タケダ-CiRA共同研究プログラム(T-CiRA)、名古屋大学大学院医学系研究科)、金子 新 教授(CiRA増殖分化機構研究部門、T-CiRA)らの研究グループは、ヒトiPS細胞から制御性T細胞(Treg)と同等の細胞を作製することに成功しました。またこの細胞にキメラ抗原受容体(CAR)を導入することで、細胞傷害性T細胞の分裂を抑制し、免疫不全マウスの移植片対宿主病(GVHD)を抑制することを示しました。
造血幹細胞移植の際に、ドナー由来の細胞が患者さんの体の細胞を他人と認識して起こしてしまう免疫反応(移植片対宿主病:GVHD)の治療方法として、ヒトiPS細胞から誘導したCD4+ T細胞(iCD4+T細胞)が期待されています。しかし、iCD4+T細胞は、炎症性サイトカイン注5)を分泌する、免疫反応を促進するT細胞でした。研究グループは、iCD4+T細胞に制御性T細胞のマスター転写因子であるFOXP3を高発現させました(iCD4+Treg様細胞)。この細胞は、活性化しても炎症性サイトカインを分泌しませんでした。さらに、制御性T細胞に特徴的な脱メチル化が生じており、免疫抑制性の細胞に転換したと示唆されました。iCD4+Treg様細胞は、HLA-A2をもつ細胞傷害性T細胞(CTL)との混合リンパ球反応アッセイにおいて細胞傷害性T細胞(CTL)の分裂を阻害し、HLA-A2をもつ免疫細胞を移植した免疫不全(NSG)マウスにおいて、HLA-A2 を認識するCARを導入したiCD4+Treg様細胞は移植片対宿主病(GVHD)を抑制しました。この抑制効果は、天然の制御性T細胞(CD25+CD127- Treg)と同程度でした。
この研究成果は2024年6月7日(日本時間)に「Cell Stem Cell」で公開されました。
2. 研究の背景
過剰な免疫反応によって引き起こされる自己免疫疾患やGVHDなどの疾患は、根本的な治療法がなく、新しい治療法が求められています。免疫抑制作用をもつTregが自己免疫を抑制し、GVHDを制御する上で重要な役割を果たすことはよく知られています。Tregを用いた細胞療法は、すでに数件の臨床試験が行われています。GVHDの予防において有望な結果が報告されており、Treg療法の可能性が示されています。しかし、Tregを体外で治療に必要な数だけ増殖させながら、その免疫抑制機能を維持することは難しいため、Treg移植の応用はあまり進んでいません。
金子教授らの研究グループはiPS細胞からT細胞へと再分化させる研究を行っています。iPS細胞から誘導したT細胞は疲弊しておらず、その増殖能力は強力です。最近、人工胸腺オルガノイド(ATO)をつかって、iPS細胞からヒトCD4ヘルパーT細胞が誘導されたと報告されています。ほとんどのCD4ヘルパーT細胞は炎症性サイトカイン(IFN-γやIL-4など)を分泌する従来型ヘルパーT細胞(Tconv)です。しかし、Tconvの中でも、一部の細胞はTregに変換できます。そこで、iPS細胞からこのTconvを作製することで、大量のTregを生産することが期待できます。
3. 研究結果
1)3次元人工胸腺オルガノイド(ATO)培養によるiPS細胞からCD4+T細胞の作成
報告されているATOを使ったリンパ球分化方法に従ってヒトiPS細胞からCD4 +T細胞へと分化させました。しかし、これらのCD4+T細胞は、Tregのマスター転写因子であるFOXP3をほとんど発現していませんでした。
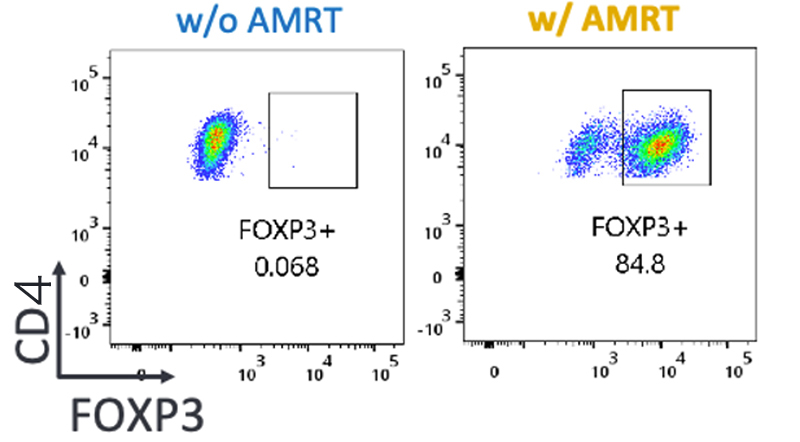
Tregへと誘導する効果が知られている4つの試薬(AMRT:AS2863619、MR2-1、ラパマイシン、TGF-β)を組み合わせて作用させると、FOXP3が高発現し(Fig.1)、高レベルに増殖させることができました。また、Treg特異的な脱メチル化も高い割合で検出され、天然のTregに類似した傾向が見られました。
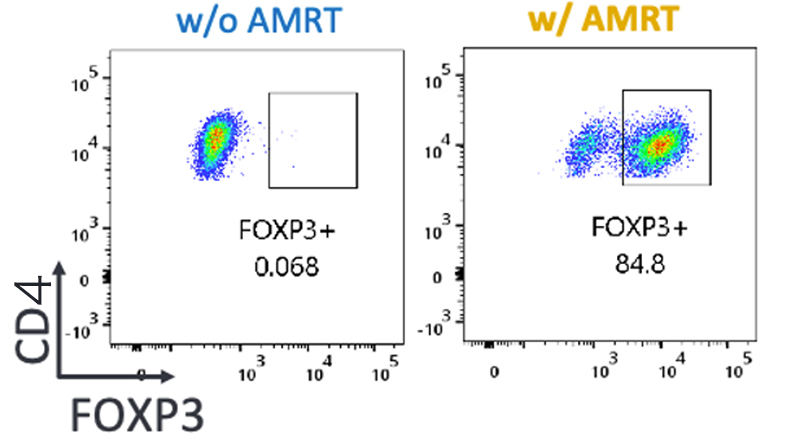
Fig.1 FOXP3の誘導を示すフローサイトメトリーの結果
AMRTで処理した場合(右)にFOXP3陽性の細胞(枠内)の数が増えている。
2)AMRTで処理したiCD4 T細胞は用量依存的に活性化T細胞の細胞分裂を抑制する
Tregの細胞を制御する機能を測定するために、iCD4+T細胞を、HLA-A2を持つCD8 CTLと様々な割合(1:16〜4:1)で共培養したところ、AMRTで処理した iCD4+T細胞(iCD4+T AMRT)は、用量依存的にCD8 CTLの増殖を抑制しました。また、GVHDの抑制にはHLAに対する抗原特異的なT細胞が有効であることが示されているため、HLA-A2に特異的なCARをiCD4+T細胞に導入しました(iCD4+T AMRT with CAR)。こちらも同様にCD8 CTLの増殖を抑制しました(Fig.2)。
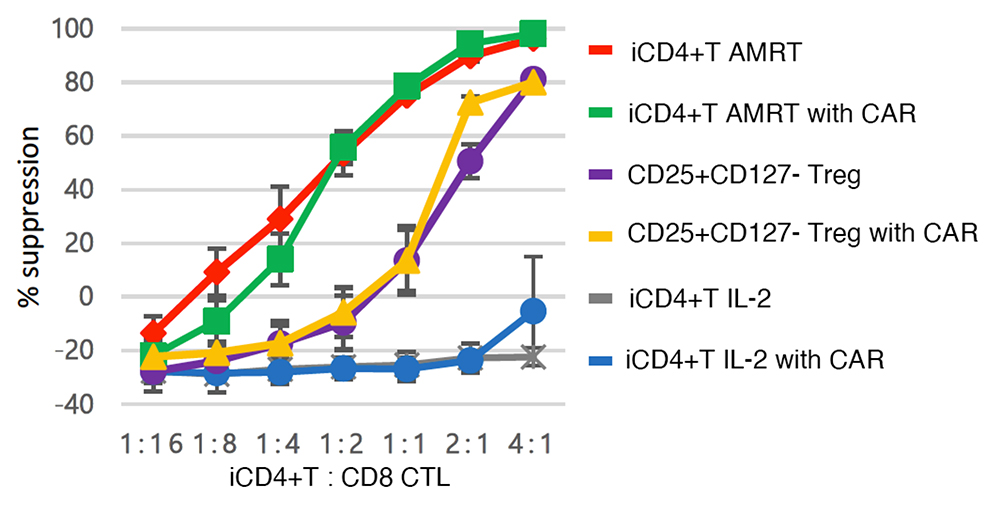
Fig.2 混合リンパ球アッセイの結果
AMRTで処理したiCD4+T細胞はCAR導入の有無にかかわらず同等のCTL増殖抑制能を示しました。
3)抗HLA-A2 CAR修飾およびAMRT処理iCD4+T細胞注射がGVHDの進行を抑制する
続いてマウスの体内で試験を行いました。免疫不全マウス(NSGマウス)に、HLA-A2+をもつヒトT細胞を含む細胞(PBMC)、AMRT 処理をしたiPS細胞由来iCD4+ T細胞(iCD4+T AMRT)、CD25+CD127- Tregsを静脈内移植し、マウスの体重推移と生存期間を測定しました。無処置群と比較して各集団で有意な効果を示したのは、いずれもCARを用いたCD25+CD127-Treg with CAR とiCD4+T AMRT with CAR細胞の2つのみで、AMRT iCD4+ CAR-T細胞は、CD25+CD127- CAR-Tregと同程度に体重減少を抑制し、生存期間を延長したことがわかりました。
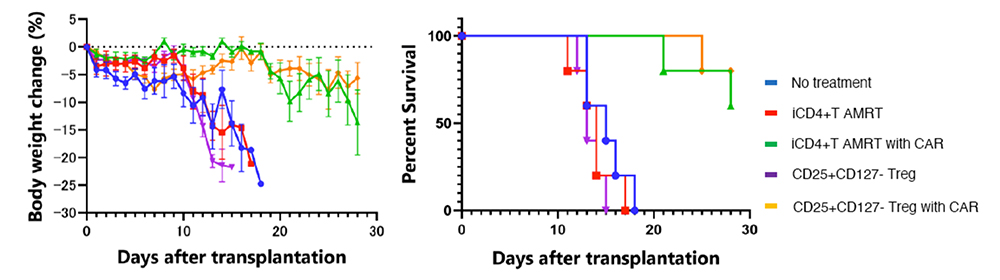
Fig.3 iCD4 T細胞を移植したマウスの体重変化と生存曲線
4. まとめ
iPS細胞から作製したCD4+T細胞において、FOXP3を誘導する4つの試薬の組み合わせを同定し、制御性T細胞と同等の性質をもつ細胞を作製することができました。今回作製したiCD4+Treg様細胞は、GVHDモデルにおいて、CD25+CD127- Tregと同様のパフォーマンスを示しました。したがって、この研究は、大量のiPSC由来抗原特異的免疫抑制T細胞をヒトに送達する戦略の可能性を示しています。
5. 論文名と著者
- 論文名
Human iPSC-derived CD4+ Treg-like cells engineered with chimeric antigen receptors control GVHD in a xenograft model - ジャーナル名
Cell Stem Cell - 著者
Hisashi Yano1,2,3, Keiko Koga2,4, Takayuki Sato2,4, Tokuyuki Shinohara2,4, Shoichi Iriguchi1,2, Atsushi Matsuda2,4, Kazuki Nakazono2,4, Maki Shioiri2,4, Yasuyuki Miyake1,2, Yoshiaki Kassai2,4, Hitoshi Kiyoi3 and Shin Kaneko1,2*
*:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- タケダ-CiRA 共同研究プログラム(T-CiRA)
- 名古屋大学大学院医学系研究科 血液・腫瘍内科学
- 武田薬品工業株式会社 R&Dリサーチ グローバルアドバンストプラットフォーム
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- JSPS Grant (JP20K22776)
- タケダ-CiRA共同研究プログラム(T-CiRA)
7. 用語説明
注1)制御性T細胞(Treg)
自己に対する免疫反応が起こらないように抑制する働きを持つT細胞。
注2)細胞傷害性T細胞(CTL)
T細胞の一種で、宿主にとって異物になる細胞を認識して破壊する。キラーT細胞とも呼ばれる。
注3)キメラ抗原受容体(CAR)
抗体のターゲット認識部位を細胞外に、T細胞活性化タンパク質を細胞内に内包した人工タンパク質の総称。CD19タンパク質をターゲットとしたCARを発現したT細胞において完全寛解を達成した患者さんもいることから、免疫細胞療法において注目されている。
注4)移植片対宿主病(GVHD)
移植した細胞の中に含まれる免疫細胞が、移植された側(患者さん)の細胞を異物と認識して引き起こす免疫反応。造血幹細胞移植などの際に起こる。
注5)炎症性サイトカイン
生体内でさまざまな炎症反応を引き起こすタンパク質のこと。